光学表面等离子共振生物传感器检测脱落酸的试验研究
穆琳瑛, 王满苹, 王 顺, 王婷婷, 曹百穹, 孙晓辉, 朱娟花, 胡建东
(1.河南农业大学机电工程学院,河南 郑州 450002;2.河南农大迅捷测试技术有限公司,河南 郑州 450002)
光学表面等离子共振(Surface plasmon resonance,SPR)生物传感技术是一种先进的、多用途的免标记光学生物检测技术,它涉及光学工程、机械工程、电子工程和生物化学等多个学科[1].由于SPR生物传感技术具有实时、快速、无需标记及灵敏度高等特点,得到了人们极大的关注,被广泛应用于农业、食品安全、环境监测、生物医学和药物筛选等领域[2~8].植物激素的研究几乎涉及到植物学研究的各个领域,例如植物激素调控机制的研究已成为人们认识和理解纷繁神秘植物生命现象的重要途径,使本身就处于科学前沿的植物激素研究进入全新的快速发展阶段[9].植物激素脱落酸(Abscisic acid, ABA)就是一种几乎存在于所有高等植物中的植物激素[9].植物激素ABA不仅在植物发育的诸多重要过程中起着重要的调节作用,而且也作为植物体内重要的逆境响应激素,与干旱、高盐、低温、损伤、低氧、光照以及病原体侵染等多种生物和非生物胁迫有关,是植物体响应逆境胁迫信号,也是引起植物适应性调节反应和基因表达的重要因子[10,11].植物激素ABA的测定最早采用生物测试方法,随着免疫学技术的发展,将免疫学技术应用于植物激素ABA的测定则更有力地促进了ABA定量研究的发展.现今酶联免疫吸附法(ELISA)和酶标免疫测定法(EIA)已是测定植物ABA含量的重要手段[12,13].物理化学方法中的色谱学也是测定植物激素ABA常见的方法,其利用物质在不同介质中的分配原理进行测定,包括纸上层析、高效液相色谱(HPLC)、气相色谱(GC)、薄层层析(TLC)以及气质联用(GC-MS)等[14~24].近几年,光学SPR生物传感技术用于植物激素的快速检测引起了国际相关领域科学家的高度重视[25].本研究采用光学SPR生物传感技术间接抑制法测定植物激素ABA的含量,建立了一种快速、低检测限的测定植物激素ABA含量新方法.
1 试验设计
1.1仪器与试剂
1.1.1 仪器 光学生物传感器TSPR1K23从美国德州仪器公司(Texas Instruments,TI)公司购买,内部集成封装了光学检测系统,在光学生物传感器表面蒸镀了50nm金膜,用于产生表面等离子共振光谱.光学SPR生物传感器测定植物激素ABA的装置系自行设计.
1.1.2 试剂 N-羟基琥珀酰亚胺(NHS)(美国Sigma公司),1-(3-二甲氨基丙基)-3-乙基炭二亚胺盐酸盐(EDC)(美国Sigma公司),半胱胺盐酸盐(AET),牛血清白蛋白(BSA),乙醇胺(Eth),PBS缓冲液,ABA标准品,ABA单克隆抗体(河南省农业科学院提供),高氯酸、氢氧化钠、氯化钠、磷酸二氢钠、去离子水均为分析纯.
1.2试验方法
1.2.1 光学SPR生物传感器检测ABA原理 光学SPR生物传感器测定ABA的原理实质是对耦联在金膜表面的ABA分子质量进行检测.SPR生物传感器检测ABA的原理见图1.集成光学生物传感器为非扫描性光学SPR生物传感器,将光束以一定角度入射到表面蒸镀50 nm金膜的高折射率的光学棱镜上,光线从该界面产生全反射,全反射产生的倏逝波引起金膜内的自由电子产生运动,形成表面等离子波,当表面等离子波的传播常数与入射光的传播常数匹配时,表面等离子波将产生共振.将ABA抗原固定在金膜的表面,通过间接抑制法使样品溶液中未反应完全的ABA抗体与抗原结合,从而引起金膜表面微小量的物质量的变化.金膜表面物质量的变化会引起表面等离子波共振波长的改变从而反映ABA抗原抗体结合情况,即可获得被测样品中的ABA含量.

图1 光学SPR生物传感器检测ABA原理
间接抑制法是将ABA抗原通过巯基丙酸固定在光学棱镜的金膜上制成分子识别膜.分析时需要先进行预反应,预反应时在检测样本中加入定量且过量的ABA抗体,抗体和样本混合后孵育,使样本中ABA抗原和ABA抗体结合达到平衡状态,之后再通过光学SPR生物传感器表面分子识别膜,检测未被结合的自由抗体分子.间接抑制法的检测过程见图2.抗原浓度越高,分子识别膜上结合自由抗体分子越少,即结合的分子质量与样本中抗原浓度成反比关系.

图2 光学SPR生物传感器间接抑制法
1.2.2 试验设计 光学SPR生物传感器测定植物激素ABA的装置如图3所示,它由集成光学SPR传感器、微流池、蠕动泵、光学响应信号采集电路以及处理软件组成.样本溶液经过微流池在SPR生物传感器上产生表面等离子共振现象,使得从光学生物传感器的反射光光强发生变化,这一变化被光电响应信号采集电路处理采集后在触摸屏上实时显示,包括生物分子整个结合与解离的动态过程和光学SPR共振信号.同时,流经传感器表面的样本经蠕动泵进入废液缸.

图3 ABA检测原理装置图
1.2.3 ABA分子识别膜制备 (1) 首先向传感器金膜表面以30 μL·min-1的流速注入PBS缓冲液,待基线趋于稳定后,向金膜表面注入 0.01 mol·L-1的AET,实时监控响应曲线,直至响应信号趋于稳定,停止注入,用缓冲液冲洗,待信号稳定,从而在金膜表面固定1层氨基.(2) 注入用0.1 mol·L-1NHS和0.4 mol·L-1EDC活化后的BSA溶液,使其更容易和AET上氨基结合,活化时间1 h.(3) 注入活化的100 ng·L-1的ABA抗原,实时监控响应曲线,待响应信号趋于稳定,停止注入,用PBS缓冲液冲洗,至信号稳定,这样ABA抗原便固定在金膜上.(4) 最后注入1 mol·L-1乙醇胺溶液,封闭金膜上未被ABA抗原结合的活性位点,完成分子识别膜的制备.
1.2.4 测试过程 将定位抗体的质量浓度为0.575 g·L-1.分别加入0,25,50,200,500,1 000 mg·L-1不同质量浓度的抗原.按抗原质量浓度从大到小的顺序进行测试,蠕动泵转速为0.3 r·min-1.
2 结果与分析
2.1ABA在金膜上的固定
ABA按1.2.3的方法在金膜上固定,在金膜表面流过AET,AET分子一端巯基与金膜相联,另一端氨基与NHS/EDC活化的BSA中的羧基相连,BSA较好的固定在传感器表面.之后传感器表面流过ABA抗原,ABA中的羧基与BSA分子上的氨基耦合,再用乙醇胺对金膜表面未结合位点进行封闭,完成ABA分子识别膜的制备,如图4所示, ABA较好的固定在金膜上.
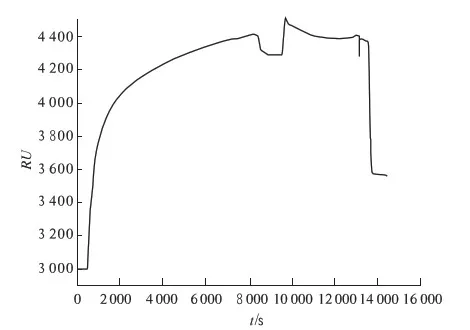
图4 ABA的固定及剩余活性位点的封闭
2.2标准曲线的建立
将定位抗体质量浓度稀释至0.575 g·L-1后,与不同质量浓度抗原混合(0,25,50,200,500,1 000 mg·L-1),对混合物依次进行测试得到一定时间段内不同抗原质量浓度的响应值(RU)的关系.随着ABA抗原质量浓度依次增加,其响应值依次减小,即抗原质量浓度越大发生共振的时候光强越弱.对应到图中就是响应值越低,响应值随抗原添加量的增加而减少,符合竞争抑制性检测规律,且各质量浓度间具有很好的区分度.
取适当时间点不同质量浓度抗原样品的响应值,并与所对应的抗原质量浓度作图(图5).
对该响应结果做曲线拟合,拟合方程为RU=157.655 36-1.732 24c,相关系数为-0.998.由此可知,当抗体稀释后,信号响应值和ABA抗原质量浓度成反比关系,并且具有很好的线性关系.由此建立了利用光学SPR技术采用间接抑制方法检测ABA的标准曲线.
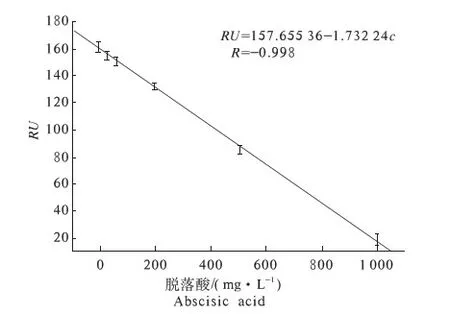
图5 ABA质量浓度与SPR响应信号之间的关系
2.3重复性试验
从样品中挑选取质量浓度200 mg· L-1ABA抗原连续检测6次(蠕动泵转速为0.3 r·min-1,每次6 min),实时监控响应值分别为123,134,126,136,129,138.重复性实验结果求得RSD=4.13%.可见检测重复性良好.
3 结论
本研究采用便携式光学表面等离子共振生物传感器快速检测植物激素脱落酸.将植物激素ABA的抗原固定于传感芯片表面,利用间接抑制法测定ABA含量.分别将0,25,50,200,500,1 000 mg·L-1的ABA抗原添加入ABA抗体溶液中进行竞争反应,将反应后的分析物流经光学SPR芯片表面,建立了ABA测定标准曲线,其相关系数为-0.998,重复性试验结果求得RSD=4.13%.研究结果显示,该方法能够快速检测ABA的含量,具有样品无需标记、重复性好和快速定量等特点,为植物激素ABA的快速测定提供了一种新颖的定量检测方法.
参考文献:
[1]HU J D, HU J F, LI F K, et al. Design and validation of a low cost surface plasmon resonance bioanalyzer using microprocessors and a touch-screen monitor [J]. Biosensors and Bioelectronics, 2009, 24(7):1974-1978.
[2]ALEXI N N,SCOLL D S, DWIGHT U B, et al. A portable surface plasmon resonance (SPR) sensor system with temperature regulation[J]. Sensors and Actuators B, 2003, 96(1/2):253-260.
[3]葛 晶,殷涌光,王 凯,等.使用SPR 生物传感器快速检测大肠杆菌E.ColiO157:H7[J].吉林大学学报, 2005, 35(2) :214-218.
[4]WU L, ZHANG Q, SU L, et al. Effects of small molecular inhibitors on the binding between HIV-1 reverse transcriptase and DNA as revealed by SPR biosensor [J]. Sensors and Actuators B:Chemical, 2007, 122(1):243-252.
[5]SEEKALLUI S V, TOOSI B M, ZEIGLER A, et al.Effects of estradiol and progesterone on circulating LH and FSH secretion and ovarian antral follicle growth in anestrous ewes[J]. Small Ruminant Research, 2010, 91(2):178-185.
[6]余兴龙,刘俊锋,定 翔,等.基于SPR相位检测的蛋白质芯片信号获取与处理研究[J].生命科学仪器, 2005, 3(3):21-25.
[7]向四海,崔大付,蔡浩源,等.利用表面等离子体谐振技术检测金黄色葡萄球菌肠毒B[J].中国实验诊断学, 2003, 7(3):190-194.
[8]ZHANG Z F, LIU J, XU K X,et al. Development of a miniature optic biosensor-based inhibition immunoassay for detection of ampicillin residues in milk[J]. Nanotechnology and Precision Engineering , 2009, 7(6):484-489.
[9]许智宏,李家洋.中国植物激素研究:过去、现在和未来[J]. 植物学通报, 2006, 23(5):433-442.
[10]匡 勇,夏石头,匡逢春,等.脱落酸(ABA)对植物生长发育的促进效应[J]. 湖南农业科学, 2009 (1):33-36.
[11]姚曼红,刘 林,曾幼玲,等.五大类传统植物激素对事物影响盐胁迫的调控[J]. 生物技术通报, 2011 (11):1-5.
[12]马智鸿,黄 飚,屠 蔷,等.应用生物素-链霉亲和素的酶联免疫吸附法检测谷物中的玉米赤霉烯酮[J]. 安徽农业科学, 2009, 37(15):6849-6851.
[13]GAO X, KONG F, WANG F,et al. Inhibit or yrole of gibberellins in throbr oxide-induced flowering of pharbit isnil [J]. Journal of Plant Physiology,2006(4):398-404.
[14]王 洁,李 敏,张宜辉,等.HPLC测定木榄繁殖器官内源ABA和GA3含量[J]. 厦门大学学报, 2008,47(5):752-756.
[15]兰彦平,许雪峰,韩振海,等.反相高效液相色谱法测定平邑甜茶植株内源ABA、IAA含量[J]. 生物技术, 2000(6):43-45.
[16]黄 靖,刘艳芝,刘国伟,等.高效液相色谱法测定植物内源激素研究进展[J]. 山东农业科学, 2011(8):101-103.
[17]陈晓鹏,王秀峰,孙小镭.高效液相色谱测定黄瓜瓜条中赤霉素和脱落酸含量[J]. 山东农业科学, 2005(1):65-67.
[18]马海燕,王美丽,张震文,等.葡萄新梢生长过程中内源激素含量的动态变化[J]. 西北农业学报, 2007, 16(2): 177-179.
[19]雷 蕾,康庆华,张晓波.反相高效液相色谱法分离和测定亚麻植物中植物激素[J]. 黑龙江农业科学, 2001(6): 21-22.
[20]卢巧梅,张 兰,陈天文,等.液相色谱-串联质谱分析盐胁迫下植物激素的含量变化[J]. 中国科学:B辑, 2009, 39(8):785-792.
[21]SILVIA F C, MARK H B, JOHN W M,et al. A rapid and robust method for simultaneously measuring changes in the phytohormones ABA, JA and SA in plants following biotic and biotic stress [J]. Plant Methods, 2008, 16(4): 2-8.
[22]FLETCHER A T, MADER J C. Hormone profiling by LCQT of-MS/MS in dormant macadamia integrifolia: correlations with abnormal vertical growth [J]. Plant Growth Regul, 2007, 26(4): 351-361.
[23]MA Z, GE L, LEE A, et al. Simultaneous analysis of different classes of phytohormones in coconut water using high-performance liquid chromatography and liquid chromatoguaphy-tademass spectrometry after solid-phase extraction [J]. Anal Chim Acta, 2008,16(2): 274-281.
[24]刘长江,刘旸旸,李书倩,等.HPLC法测定软枣猕猴桃中内源激素脱落酸含量[J]. 食品研究与开发, 2012, 33(2):162-164.
[25]李会芹,李遂亮,李 伟,等.光学表面等离子共振测定盐酸克伦特罗的试验研究[J]. 河南农业大学学报, 2012, 46(4):198-202.

