再锻炼期间真菌侵染油松幼苗的抗寒性和电阻抗参数的测定
张 昱, 孟 昱, 张 钢, 封新国, 徐成立, 李云飞
(1.河北农业大学园艺学院,河北 保定 071001; 2.河北省林业厅,河北 石家庄 050000;3.河北省木兰围场国有林场管理局,河北 承德 068450)
菌根冬季抗寒性的信息对森林苗圃培育有非常实用的价值,如果冬季雪覆盖变浅,或秋季苗木移至冷库时间太早,根系和菌根受到霜冻胁迫,将会降低苗木活力.随着全球气候变暖,北方林区冬季温度升高,在温暖条件下,土壤结冻-解冻循环的频率加大,雪的融化和降雨的增加,对树木根系和菌根产生一定的影响.中国北方地区,春季树木脱锻炼抗寒性下降期间,每日温度常发生很大波动;晴天昼夜温度变化剧烈,对植物生长危害极大.如果受到低温侵袭,树木尤其是苗木即会遭受寒害.因此,树木必须有足够的抵御低温和抵抗脱水的能力才能减轻寒害.研究表明,一些树种的脱锻炼过程可能是可逆的,即在温暖气候条件下脱锻炼一段时间后,如遇寒冷天气,抗寒性可能会恢复[1,2].前人对接种外生菌根对林木幼苗共生关系及抗寒性进行了研究[3,4],但对脱锻炼及再锻炼过程中,北方树木接种外生菌根对苗木抗寒性的作用研究很少;在前人对电阻抗的研究中,只单纯对植物进行电阻抗的测定和分析,没有考虑微生物的影响.本研究对经过2种真菌侵染处理的油松(Pinustabulifomis)幼苗春季脱锻炼结束后,再以低温处理一段时间后对它们的生长情况及抗寒能力的恢复情况进行了研究,旨在研究真菌侵染油松幼苗再锻炼期间与无真菌侵染的幼苗的生长及抗寒性差异,探究真菌侵染对油松幼苗的作用,为脱锻炼期间提高幼苗生长量和增强抗寒性提供理论依据和实践借鉴.
1 材料与方法
1.1试验材料
以中国林业科学研究院购买的土生空团菌(CenococcumgeophilumFr.)和红蜡蘑(Laccarialaccata(Scop. : Fr.) Berk. et Br.)作为测试菌种;以河北承德围场种苗站提供油松(Pinustabulaeformis) 种子 (发芽率95%)为试验材料进行抗寒性测试分析.
1.2试验方法
1.2.1 菌丝体纯化培养 将买来的新鲜马铃薯洗净去皮(已发芽的要挖掉芽眼),称取400 g切成薄片,置于铝锅加水煮沸30 min,用4层纱布过滤取汁,补足水分到1 000 mL;琼脂20 g加入马铃薯汁液内,微火加热,不时搅拌直至琼脂全部溶化,再加入葡萄糖20 g,加热几分钟,使其完全溶解.最后,将配好的马铃薯蔗糖培养基置于121.6 ℃高压蒸汽灭菌锅中灭菌30 min.在超净工作台内把培养基灌于平板内,冷却后将生长健壮的菌种接于其中,用封口胶封好,放入25 ℃ 的暗培养室培养,每7 d扩繁1次,扩繁不超过30 d.
1.2.2 油松幼苗培养
1.2.2.1 油松种子催芽 采用低温层积催芽.在播种前60~90 d,将种子用 0.5%高锰酸钾溶液消毒后,以50~60 ℃的温水浸种24 h,混以2~3倍消过毒的洁净湿沙,置于3~4 ℃恒温人工气候室内层积.播种前除去沙粒,取出种子,用去离子水漂洗数次后置于培养皿中备用.
1.2.2.2 油松幼苗培养基的制备 将5 L蛭石和1 L PDA液体培养基(无琼脂)混合,含水量以手握成团不滴水一触即散为宜.将混合均匀的基质装入规格为直径18 mm、长180 mm的试管的1/2处,塞紧棉塞用牛皮纸封口,置于121.6 ℃高压蒸汽灭菌锅内灭菌2 h.之后在超净工作台上,将镊子灼烧灭菌冷却后,取原培养基边缘的新菌0.5 cm2,接种于灭菌后的蛭石-PDA混合基质中,并置于25~26.5 ℃恒温避光的人工气候室内培养备用.
1.2.2.3 播种 在超净工作台上,将层积处理并灭菌后的油松种子播种到接有土生空团菌和红蜡蘑且生长良好的基质试管中,并且播种于一部分与无接种真菌的试管中作为对照.种子播在试管中央,每个试管内播2粒,然后覆盖灭过菌的湿沙,厚度为0.5~1 cm.塞紧棉塞用牛皮纸封口后,继续置于20~25 ℃恒温人工气候室内育苗,约30 d待出苗后种壳刚脱落时使用.
1.2.2.4 菌根侵染及生长指标的测定 菌根侵染率测定[6]:外生菌根感染率的计测采用统计计算法.将根样剪成1cm等长的根段,随机选取根样,每样60个根段.菌根感染率(%)=(感染菌根根段数/总根段数)×100%.油松幼苗的生长测定:幼苗生长期间,进行2次株高和地径(距地面1 cm)的测定.每次每个处理选择8株标准株进行测定,3次重复.并用直尺测量地上和地下部分的长度,计算根冠比.干物质含量测定:每个处理分根、茎、叶,每次称鲜质量约为1 g.将称量的样品进行密封,放入干燥箱,烘干48 h,取出称干质量,按照干质量/鲜质量计算干物质含量.3次重复.
1.2.2.5 油松幼苗的再锻炼处理 03-18将幼苗放入培养箱,培养箱设置的温度及光照分别为白天和夜晚10 ℃和6 ℃、光周期为14 h/10 h(光照/黑暗).湿度均为60%,光照强度为80%.03-17进行第1次各种指标的测试,之后将原设定温度由15~20 ℃降至6~10 ℃,使油松幼苗经过1次再锻炼的低温处理.处理时间为03-18—03-27,历时10 d.
1.2.3 电导法(EL)和电阻抗图谱法(EIS)测定抗寒性
1.2.3.1 冷冻处理 将幼苗用自来水冲洗几次,去除表面污染物,再用去离子水冲洗3次,用干净纱布轻轻吸干幼苗表面水分,之后装入塑封袋,喷少许去离子水,防止材料发生过冷现象.放入冰箱中进行冷冻处理,设置7个温度,见表1,其中以4 ℃为对照.到达每个设定温度后,保持4 h,再取出放入4 ℃冷藏室缓慢解冻24 h.冷冻温度的范围因植物发育阶段的不同而不同,发育阶段的差异性直接影响植物的抗寒性.
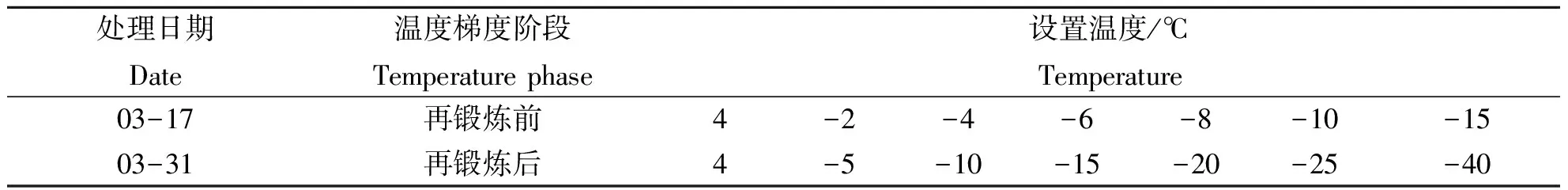
表1 2次冷冻处理测定抗寒性所设置温度
1.2.3.2 相对电导率的测定 采用电导法(EL法)进行抗寒性测定[7].缓慢解冻后,每个幼苗根、茎叶分别切取10 mm,纵切成4份,每个温度梯度设定4次重复.待混合均匀后,每个试管中放4个切好的小茎段.每个试管中加11 mL去离子水,保鲜膜封口,放入摇床中振荡24 h.用DDSL-308型电导仪(上海京科雷磁)测渗出液的初电导值(C1).保鲜膜封口后将试管置于沸水中煮沸20 min;再放入摇床中振荡24 h,测终电导值(C2).每次测定,去离子水作对照,测定空白电导值.用如下公式计算相对电导率(REL):
REL(%)=[(C1-C空白1)/(C2-C空白2)]×100%.
1.2.3.3 EIS参数的测定 参考ZHANG等[8]的方法进行EIS参数测定.缓慢解冻后,从每个处理中随机选取8株幼苗,根、茎、叶分别切取15 mm进行电阻抗测定.用测厚仪(Mitutoyo No.7331,Japan)测定厚度,精确到0.01 mm.试验采用Ag/AgCl电极,在电极上加电极凝胶,使茎段样本的横切面与凝胶接触.对阻抗仪(HP4284A,USA)进行开路和短路校正.校正后,测定从80~1 000 MHz共42个频率下的电阻值和电抗值.将上述各频率所得数值作为实部和虚部,做出随频率变化电阻和电抗的变化曲线,即EIS.等效电路参数采用ZARC模型,LEVM8.06 (MacdonaldJR)软件进行数据拟合,得出模型参数.
1.2.3.4 EL法和EIS法求抗寒性 相对电导率或电阻抗参数胞外电阻率re的变化与抗寒性的关系可用Logistic 方程表示,应用SPSS 17.0软件,通过计算方程的拐点温度表示组织半致死温度(LT50),估算抗寒性[7].
1.3统计分析
利用Microsoft Excel进行数据录入和作图,应用SPSS17.0软件进行方差分析和相关性分析[10].
2 结果与分析
2.1接种对油松幼苗菌根感染率的影响
菌根侵染率测定表明,接种不同外生菌根真菌苗木菌根感染率不同.接种土生空团菌的油松幼苗的感染率为73%,接种红蜡蘑的油松幼苗感染率为52.2%,对照油松幼苗未发生感染.
2.2接种对油松幼苗生长的影响
在对种子植入2种真菌后发现,3种处理在试验条件一致的情况下,种子发芽时间均在播种3 d后.土生空团菌、红蜡蘑、对照苗的出苗率分别为92.1%、90%和93.2%,表明菌根真菌对种子的出苗时间及出苗率影响不明显.出苗率与对照苗相比差别不大,对后期幼苗生长影响也不大,说明土生空团菌和红蜡蘑对油松幼苗高生长促进作用不明显.但是土生空团菌对油松幼苗地径、根冠比的影响较红蜡蘑和对照苗明显(P<0.05):土生空团菌对油松幼苗地径及地下生物量的促进作用显著(表2).

表2 土生空团菌和红蜡蘑对油松幼苗生长指标的影响
2.3再锻炼期间油松幼苗的抗寒性
2.3.1 油松幼苗抗寒性变化 用传统的电导法测定抗寒性的结果显示,再锻炼前后,真菌苗的抗寒性均比对照苗的抗寒性显著增强,其中土生空团菌苗的根、茎和针叶的抗寒性最强,与对照苗的抗寒性差异显著(P<0.05)(红蜡蘑真菌苗的根抗寒性除外)见(图1、2).3种处理的幼苗之间抗寒性差异显著,可能是由于真菌与幼苗侵染而产生的幼苗生长差异及生理生化差异导致的.
随着再锻炼的进行,真菌苗和对照苗的抗寒性都明显增强(图2).抗寒性提高的速率表现出一定程度的差异.再锻炼后,土生空团菌苗的根、茎和针叶的抗寒性比再锻炼前分别提高了4~8 ℃;红蜡蘑真菌苗的根、茎和针叶的抗寒性分别提高了4~6 ℃;对照苗的根、茎和针叶的抗寒性分别提高了约4~6 ℃.
综合再锻炼前后抗寒性的测定结果可以看出,接入土生空团菌的油松幼苗抗寒性最强,抗寒能力强弱排序依次为:土生空团菌>红蜡蘑>对照.再锻炼前后,真菌侵染苗及对照苗不同器官的抗寒性的强弱为根>茎或针叶(图1、图2).

注:Cg真菌指土生空团菌,H真菌指红蜡蘑.
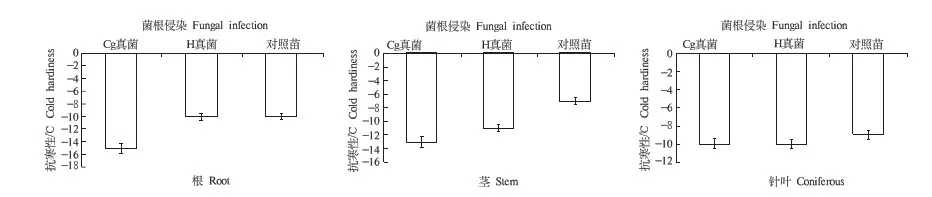
图2 再锻炼后(03-31)真菌侵染苗与对照苗不同器官的LT50温度比较图
2.3.2 EIS法与EL法测定抗寒性比较 用EIS法和EL法测得的植物抗寒性略有差别,但差异不显著.选择数据差异较明显的茎作为抗寒性对比.整体来看由EIS法的胞外电阻率re计算的抗寒性与EL法计算的抗寒性相关性最高,虽然比EL法计算的抗寒性要低,但二者测定的抗寒性的差异不显著(图3).回归方程为y=-0.388 6x2-8.793 9x-57.85(R2=0.78).
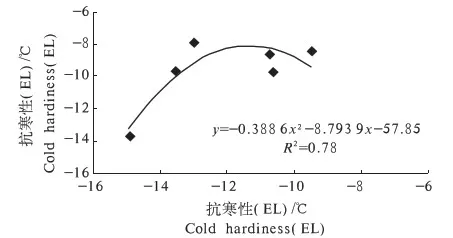
图3 EIS法的胞外电阻率re求出的抗寒性与EL法求出的抗寒性的相关性
3 结论与讨论
研究结果表明,接种了土生空团菌的油松幼苗比接种红蜡蘑和对照幼苗提高了地径、根冠比,而红蜡蘑真菌对油松幼苗的生长作用影响不显著,表明不同真菌对油松幼苗生长的作用是不一样的.在接种真菌时要针对性地选择真菌品种.林业中衡量苗木质量的一个重要指标就是根冠比,土生空团菌苗的根冠比显著高于对照,这对增强苗木抗逆性有利.
研究表明,接种过真菌和未接种过真菌的幼苗的抗寒性存在差异,真菌侵染增强苗木的抗寒性.研究结果与赵平娟等[8]的研究结果基本一致,但是在菌株的选择上有很大不同,具体区别如下:本研究的试验对象是被真菌侵染的油松幼苗,而影响抗寒性的因素不单纯是植物自身因素,还包括真菌侵染后对幼苗抗寒性的影响,因此,才会出现2种真菌入侵油松幼苗后,产生抗寒性强弱的差异;此外,由于真菌在生长过程中,侵染了油松幼苗根部的皮层处,与植物形成了共生关系,真菌形成了类似“根毛”的团状物,增加了植物吸收养分和水分的能力,从而提高了植物自身的抗性,以及转换淀粉和糖的能力,致使接种菌根的幼苗与对照幼苗的抗寒性产生差异.本研究发现:(1)真菌侵染根的抗寒性较茎、针叶的抗寒性强.真菌侵染主要作用于根系,而根系抗寒性的增强对苗株整体抗寒性的增强起重要作用.即一般来说,根系抗寒性高,植株抵御低温胁迫的能力更强.(2)再锻炼后的抗寒性较再锻炼前的显著提高.再锻炼后,土生空团菌侵染苗的抗寒性较对照苗有显著提高,根提高了约3.02 ℃,茎约4.13 ℃,针叶为4.08 ℃;红蜡蘑侵染苗根、茎、针叶的抗寒性较对照苗分别提高约2.5 ℃,3.25 ℃和3.01 ℃,也比对照苗的有一定幅度的增大.但土生空团菌侵染苗的针叶以及红蜡蘑侵染苗的根的抗寒性提高的幅度与对照无差异.看来不同真菌侵染对不同器官的作用是不一样的.植物通过真菌侵染和再锻炼使抗寒性增强幅度明显提高,植物对春节霜冻的抵御能力会更强.在生产上,在脱锻炼期间可通过这2种手段,帮助植物抵御春季低温胁迫.本研究显示,油松幼苗接种土生空团菌效果更佳.
本研究以EL法为标准,评价EIS法在油松幼苗抗寒性研究中的应用.研究发现,在EIS法中,胞外电阻率re求出的抗寒性与EL法存在相关性,与ZHANG等[9,10]、REPO等[11]和AZZARELLO等[12]用EIS法和EL法测定欧洲赤松(Pinussylvestris)、白皮松(Pinusbungeana)和油橄榄(Oleaeuropaea)的抗寒性结果相似.前人在对欧洲赤松抗寒性研究发现,在抗寒性较弱的时候,用EIS法和EL法测定的抗寒性值相差较小,而在抗寒性较强时期,2种方法测得的抗寒性差异较大[11],在本试验中,通过对油松幼苗电阻抗的测定表明,虽然不同树种之间存在差异,但是EIS法和EL法2者估测抗寒性均存在明显相关性,EIS法可以用来估测油松幼苗的抗寒性,且re是植物冷冻处理后测定其抗寒性的最佳参数.
参考文献:
[1]张 洁,张 钢,李金花.等.电导法和电阻抗图谱法测定脱锻炼期间欧美杨与大青杨杂交F1子代抗寒性[J].植物生理学通讯,2012(1):44-50.
[2]张 钢, 刘 民, 任元新. 春季白皮松实生苗的脱锻炼与再锻炼[J]. 植物生理学通讯, 2005, 41(6): 761-763.
[3]李桂兰,麻德业.白桦幼苗外生菌根的初步研究[J].山西农业大学学报:自然科学版,2002,22(2):127-128
[4]杨艳敏. 外生菌根真菌与桉树耐寒性的相关性研究[D].桂林: 广西大学,2007.
[5]宝秋利, 闫 尾, 梁显丽. 土生空团菌(CenococcumgeophilumFr.)菌丝体纯培养条件的初步研究[J]. 内蒙古农业大学学报, 2005(1): 33-36.
[6]宋瑞清 吴 克.红皮云杉外生菌根菌对苗木生长的影响 [J]. 微生物学报, 2005,45(06):910-914.
[7]李亚青,张 钢,卻书鹏.等.白皮松茎和针叶的电阻抗参数与抗寒性的相关性[J].林业科学,2008,44(4):28-34.
[8]赵平娟. 菌根真菌提高植物抗逆性的研究[D]. 杨凌:西北农林科技大学, 2004
[9]ZHANG G, LI Y Q, DONG S H. Assessing frost hardiness of Pinus bungeana shoots and needles by electrical impedance spectroscopy with and without freezing tests [J]. Journal of Plant Ecology, 2010, 3(4): 285-293.
[10]REPO T, LAPPI J. Estimation of standard error of impedance-estimated frost resistance[J]. Scandinavian Journal of Forest Research, 1989, 4: 67-74.
[11]REPO T, ZHANG G , RYYPPO A ,RIKALA R. The electrical impedance spectroscopy of Scots pine (PinussylvestrisL.) shoots in relation to cold acclimation [J]. Journal of experimental botany, 2000, 51(353): 2095-2107
[12]AZZARELLO,SERGIO,CAMILLA,et al. Comparing image (fractal analysis) and electrochemical (impedance spectroscopy and electrolyte leakage) techniques for the assessment of the freezing tolerance in olive [J]. Trees-Structure and Function, 2009, 23(1): 159-167.

