含gemini成分的正/负离子表面活性剂复配体系性质研究进展
吴小梅,梅 平,赖 璐,刘华荣,侯 聪,郑延成
(长江大学化学与环境工程学院,荆州 434023)
表面活性剂通常以混合物形式存在,因此表面活性剂复配是实际应用中的一个重要课题。表面活性剂复配后往往表现出较单一表面活性剂更优良的性能[1]。长期以来人们认为,因异性离子头基间的强静电相互作用,正/负离子表面活性剂复配体系在水溶液中易产生沉淀或絮状物。研究表明,在一定条件下正/负离子表面活性剂复配体系(C-A复配体系)具有更高的表面活性,显示出较大的增效作用。这可能是因为在C-A复配体系中,表面活性剂间存在强烈的静电相互作用,可形成丰富的微观结构,如球状、棒状、虫状胶束,层状、片状、盘状、带状、六方、立方液晶相,囊泡、沉淀等;也有人认为此混合体系可能形成了新的络合物。C-A复配体系中的这些微观结构具有广泛的应用,如虫状胶束可作为油井的压裂液,三次采油用驱油体系,分区供暖或供冷的减阻剂,家用清洗剂的增稠剂和非对称线型纳米结构的模板等;囊泡可以用作细胞膜的模型、药物载体、微反应器等。
在研究正/负离子表面活性剂复配方面,迄今主要集中在传统结构的表面活性剂间的复配。传统正/负离子表面活性剂混合水溶液通常具有比单一组分溶液高得多的表面活性[2]。而对于离子头基电荷密度及烷烃链疏水性均显著强于传统表面活性剂的gemini表面活性剂,与相反电荷的表面活性剂复配时,会产生更强的协同作用,从而大幅度提高体系的性能[3]。
在组成不同或组分间不同配比时,含gemini成分的正/负离子表面活性剂的混合体系可在水溶液中呈现出丰富的微观结构和复杂的相行为,故对于该系统的研究主要体现在混合体系协同效应、混合体系的微观结构及聚集行为、混合体系的相行为以及混合体系的应用等方面。
本文综述了含gemini成分的正/负离子表面活性剂混合体系性质的研究进展。
1 含gemini成分的正/负离子表面活性剂混合体系的协同效应
当表面活性剂混合体系所表现出的性质优于体系中任何单一组分体系时,该体系通常发生了协同效应[4]。含gemini成分的正/负离子表面活性剂混合体系因相反离子头基强静电吸引作用,导致吸附层中电性部分中和,减弱了表面吸附层中同种电荷离子间的静电排斥作用,大大降低了表/界面能,使复配系统溶液的表/界面张力得以降低,在溶液的表/界面上具有更强的吸附能力。如阳离子型gemini表面活性剂SRL-5与普通单链阴离子表面活性剂十二烷基苯磺酸钠(DBS)的复配体系中,当表面活性剂SRL-5的浓度为1.8×10-3mol/L和2.0×10-3mol/L时,复配效应达到最佳,使其界面张力降低至10-2数量级[5],而纯单一组分界面张力在1~10-1数量级。
晋来超等[6]研究了含羟丙基阳离子gemini表面活性剂(C12N)2OH及(C14N)2OH与十二烷基硫酸钠(SDS)复配,发现在低浓度下混合系统两种表面活性剂相互作用参数β均为负值,显示出极强的协同效应,(C12N)2OH体系在物质的量比为1∶9和2∶8时,临界胶束浓度(cmc)分别为4.17×10-4mol/L和3.16×10-4mol/L,对应的表面张力γcmc分别为33.80 mN/m和31.59 mN/m,而纯(C12N)2OH的cmc为7.59×10-4mol/L,γcmc为36.51 mN/m;(C14N)2OH体系在物质的量比为1∶9和2∶8时,cmc分别为1.02×10-4mol/L和8.10×10-4mol/L,γcmc分别为34.72 mN/m和32.60 mN/m,纯(C14N)2OH的cmc为1.82×10-4mol/L,γcmc为37.80 mN/m。
Rosen[7-11]采用表面张力法测定了不同表面活性剂的cmc,并确定了合适的方程以获得分子在界面上与混合胶束中的相互作用参数βσ和βm。其他课题组通过电导率法以及荧光光谱法测定了βm[12-15]。βm和βσ越负,表面活性剂间越易产生协同效应。通常βσ比βm更负,这意味着表面活性剂间的相互作用在表面层比在强烈卷曲的胶束中强,这是因为表面活性剂的两条疏水链嵌在曲面状的胶束中要比将两条疏水链融入到呈平面的吸附层困难所致。离子型gemini表面活性剂-相反电荷的传统表面活性剂混合体系具有较负的βm和βσ,同样较负的βm和βσ在相异电荷的传统表面活性剂混合体系中也有报道[16]。当传统表面活性剂的链长不变,而gemini表面活性剂的链长增加时,混合体系βm越负。随着2种表面活性剂链长趋近于相等,混合体系产生胶束的趋势以及协同效应的趋势越大。当gemini表面活性剂链长长于传统表面活性剂时,βm增加,原因可能是超出的碳氢链部分有可能发生弯曲而部分覆盖另一较短的碳氢链,使最外面碳氢链的密度相对下降,导致相互作用变弱[17]。
Liu和Rosen[18]研究了阳离子型gemini表面活性剂[CnH2n+1N+(CH3)2CH2CHOH]2·2Br-[n=8,10,12,简写为(CnN)2)]与阴离子传统表面活性剂复配体系。研究发现,当n=8,10时,(CnN)2与3种传统阴离子表面活性剂C10SO3Na,C12SO3Na,C12H25(C2H4O)4SO4Na之间相互作用强烈,体系在表面张力降低效率、表面张力降低能力及胶团形成能力等方面都产生很强的协同效应;且随着碳氢链的增长,表面活性剂分子的疏水性增强,表面活性剂分子间的相互作用也增强。比较(C8N)2/C12SO3Na 与(C8N)2/C12H25(C2H4O)4SO4Na两体系发现,后者的β值比前者大。这是由于C12H25(C2H4O)4SO4Na的体积较大,使得其与gemini表面活性剂的相互作用减弱。研究还发现,(C12N)2与C12SO3Na之间几乎没有协同作用,而(C12N)2与C12H25(C2H4O)4SO4Na之间也仅有微弱的协同作用。他们认为,这是由于(C12N)2与C12SO3Na碳链之间的相对应性而导致两者间作用力特别强烈,以至生成了可溶性的无表面活性聚集体,这大大降低了体系中表面活性剂单体浓度,从而减弱了体系的表面活性。肖进新等[19]则认为这是由于正/负离子表面活性剂头基间电性中和,生成了不溶于水的粒子所致。
2 含gemini成分的正/负离子表面活性剂混合体系聚集行为
含gemini成分的正/负离子表面活性剂混合体系在水溶液中能够形成丰富的微观结构,表现出复杂的相行为,且随着溶液中2组分的浓度及配比的改变,其体系中的微观结构会发生改变,对应微观及宏观性质均会发生改变。综合这2类特性,研究此体系聚集体方法可分为2类[20]:一类是对聚集体界面及体相溶液的宏观性质进行表征,如表面张力、电导率、流变学研究等;另一类是对聚集体的微观结构和形貌进行直接成像和间接成像研究[21],如利用显微镜系列[偏光显微镜、负染色透射电子显微镜、低温透射电子显微镜(Cryo-TEM)和冷冻刻蚀电子显微镜(FF-TEM,FF-SEM)等],直接观察聚集体的偏光纹理结构及形貌;还可利用各种波谱技术,如各种波段的光、X射线和中子散射、荧光猝灭、核磁共振等间接反映聚集体的结构特征。
2.1 聚集体宏观性质研究
2.1.1电导率法
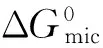
李飞飞[23]测定了双链阳离子表面活性剂双十二烷基二甲基溴化铵(DDAB)与单链阴离子表面活性剂十二烷基硫酸钠(SDS)复配体系的电导率曲线,当样品中含有少量SDS分子(摩尔分数X1=0.1)时,体系的电导率与纯DDAB的电导率相近,随着X1增大,电导率迅速增大。溶液的电导率是由带电囊泡的电导率以及溶液中自由离子的电导率组成,随着SDS的加入体系形成了阴/阳离子表面活性剂聚集体;但电导率随着X1增大迅速增大,主要是由于SDS释放出的Na+数量增多引起的。随后从X1=0.5到X1=0.9,电导率基本保持不变,虽然有更多Na+释放到溶液中,但是随着X1增大,形成的主要是富SDS聚集体,所带的负电荷越来越多, Na+被包裹于聚集体中的数目也会增多,故电导率变化不大。
2.1.2稳态荧光法
Zena等[24]研究了两种阴离子gemini表面活性剂(结构式如图1所示)混合物(两者比4∶1,记做S2)与单链阳离子表面活性剂C16TMABr(十六烷基三甲基溴化铵)二元混合体系,结果表明,用电导率法无法确定该体系混合胶团形成的临界浓度,而通过稳态荧光法测得摩尔分数为0.091的S2/C16TMABr混合体系胶团形成的临界浓度为0.091 mmol/L,远小于各单一组分的临界胶束浓度(cmc)值(纯C16TMABr的cmc为2.1 mmol/L[25],单一的S2的cmc由电导率和稳态荧光法测得,分别为0.20 mmol/L和 0.24 mmol/L),分别为单一组分的1/23和1/2.6;且混合体系的I1/I3(芘在373 nm处荧光强度与在384 nm处的比值)为1.30,介于C16TMABr和S2两个单一组分的I1/I3值之间(分别为 1.38 和 1.18)。

图1 两种阴离子gemini表面活性剂分子结构
2.1.3流变法
表面活性剂聚集体缔合结构的流变性质与聚集体的微观结构及其内部基团间的相互作用有直接关系。例如,蠕虫状胶束和网络结构具有较高的黏弹性,六角状和立方状液晶有较高的黏度,而层状液晶则黏度较低。一些表面活性剂聚集体在剪切作用下内部结构会发生变化,即所谓剪切诱导结构转变。
李修芝[26]研究发现,在30 ℃和剪切速率r为0~2 000 s-1时,体相中SDS的摩尔分数αSDS在0.10~0.33范围内的C12-3-C12·2Br/SDS 混合胶团水溶液,体系总浓度cT直至 200 mmol/L都表现为牛顿流体,αSDS不同时,溶液黏度η随着cT增加而增大。当超过某一临界浓度后,η陡然增大,可能是胶团形状发生改变所致。
杨新富[27]研究了羧酸盐gemini表面活性剂C11pPHCNa/C12TMABr混合水溶液,阴离子表面活性剂摩尔分数α1=0.75且总浓度cT<100 mmol·L时,在剪切速率r=0~500 s-1范围内均表现为牛顿体,当cT>100 mmol/L,r较小时为牛顿体,r>r*(临界剪切速率)后出现膨胀体特征。α1改变时,体系流型发生改变的cT不同,但流变特性与α1=0.75 相似。增加C12TMABr的量会导致胶团间表面活性剂分子相互作用力增大,从而引起 C11pPHCNa 胶团水溶液的黏度增大。胶团的增大有利于混合体系由牛顿体向膨胀体转变,因而随α1减小,混合体系由牛顿体向膨胀体转变的浓度减小。
对于混合体系水溶液零剪切黏度随总浓度的变化规律,研究发现,当浓度较小时,零剪切时的黏度η0随总浓度的变化并不敏感,其黏度与水相近;随着总浓度增加,η0缓慢增加;当总浓度达到一特定C*时,η0随总浓度增加而呈几个数量级的急剧增加,随后η0达到一最大值后缓慢降低。这与Kaler[28-30]和Zana[31]等在不同实验中观察到的现象一致。Kaler认为,这是由于浓度较低时,混合体系通常形成球状胶团;随着浓度增大,球状胶团易沿轴向生成棒状胶团;浓度继续增大,棒状胶团的继续伸长,最终导致胶团相互叠加,形成蠕虫状胶团,c*即对应于形成蠕虫状胶团的浓度;当黏度达到最大值时,胶团轴向长度不再增加,而是生成了带有枝链的蠕虫状胶团,从而导致随浓度增大黏度下降。Kaler研究还发现,不同正离子表面活性剂对C11pPHCNa 体系水溶液黏度影响程度从小到大依次为:C12TMABr,C12TBABr,C12TPABr,C12TEABr,C12-2-C12·2Br。
2.1.4浊度法
通常情况下,浊度值高表明溶液中存在大的或较多的聚集体[32]。李飞飞[33]利用浊度仪研究DDAB/SDS体系,随着X1(SDS摩尔分数)增大,样品的浊度先增大后减小,在X1=0.5时达到最大值。随着SDS的加入,SDS分子与DDAB囊泡双层结合而使囊泡溶胀,浊度增加,当X1=0.5时体系中形成最大沉淀量,当DDAB囊泡双层中SDS分子达到饱和,多余的SDS分子可在溶液中形成胶束而使部分DDAB插入到SDS胶束中,导致囊泡的降解而使浊度值下降[33]。增加体系总浓度或降低温度均可使体系浊度增加,这是由于体系颗粒数增加所致。总浓度为0.33 mmol/L、摩尔分数比接近0.5附近的体系,随着时间延长,体系浊度增加。这可能是在稀溶液中,正/负电荷比较接近,形成的聚集体所带的电荷比较弱,可使粒子发生融合、聚集等行为;而总浓度为1 mmol/L的体系随着时间延长,浊度降低,X1=0.6样品试管壁上面有大量白色沉淀,说明溶液中颗粒较少。他们还研究了阳离子gemini表面活性剂DDAB和双烃链阴离子表面活性剂二(2-乙基己基)磷酸钠(NaDEHP)混合体系的浊度,实验现象与上述现象类似,在X1=0.6时浊度达到最大,这与NaDEHP是一个强碱弱酸盐,在溶液中易水解有关。
2.1.5动态表面张力
动态表面张力是研究表面活性剂溶液动态吸附过程的物理量,其大小是由溶液中的表面活性剂传递到新鲜表面过程中的速率和表面吸附量的大小决定。马艳华[34]研究了羧酸盐gemini表面活性剂 C9pPHCNa与单链阳离子表面活性剂C10TMABr(十烷基三甲基溴化铵)复配体系,控制混合体系总浓度为0.4 mmol/L,C9pPHCNa在体相中摩尔分数不同,所求得的吸附能垒εa和表观扩散系数Da不同,在吸附初期,C9pPHCNa在体相中摩尔分数α1=0.5 时,Da出现最大值,这可能是体相中表面活性剂分子的扩散与疏水性相互竞争的结果;在吸附后期,α1=0.33时,即体系处于等电荷点时,吸附分子之间具有最小的静电斥力。此时,复配体系具有最小的εa(10.4 kJ/mol)以及最大的Da(0.873×10-10m2/s)。随着温度由15 ℃升高至45 ℃,其吸附初期的Da由0.2×10-10m2/s增加至16×10-10m2s,吸附后期的Da则由0.08×10-10m2/s增加至 0.9×10-10m2/s,复配体系的活化能在10 kJ/mol至20 kJ/mol之间。在所考察的比例范围内,复配体系的最小胶团解离常数出现在α1=0.2处,此时,复配体系的胶团最稳定。对C9pPHCNa/C10-2-E2-C10(结构式见图2)复配体系的动态表面张力曲线的研究发现,该曲线与传统表面活性剂复配体系的动态表面张力曲线不同,前者具有一个高平台。这可能是复配体系的表面活性剂分子在吸附过程中存在两种不同的吸附状态造成的。吸附初期,当α1=0.8时,1×10-3mol/L的C9pPHCNa/C10-2-E2-C10复配体系的动态表面张力曲线与c=0.6×10-3mol/L(等于复配体系中自由C9pPHCNa的浓度)的C9pPHCNa溶液的曲线重合,证明复配体系中两组分的强烈相互作用形成了扩散更慢的离子对,只有扩散较快的自由C9pPHCNa被吸附至表面。此后,复配体系的动态表面张力曲线与 0.6×10-3mol/L的C9pPHCNa动态表面张力曲线分离,进入了自由C9pPHCNa 吸附与离子对吸附同时进行的阶段。随着吸附继续进行,离子对逐渐扩散至亚表层,抢夺了亚表层中自由C9pPHCNa迁移至表面的机会,使吸附进入了离子对吸附占主导地位的阶段,导致溶液表面张力的进一步降低。随着体系的组成逐渐接近等电荷比,体系形成离子对增加,而自由C9pPHCNa减少;短时间范围内复配体系的表面张力将越大,而长时间范围的表面张力越低。甚至在α1=0.6时,体系中自由C9pPHCNa过少,体系中没有出现高平台。当溶液组成一定时,复配体系随着总浓度增加,动态表面张力曲线整体下移。
申长念[35]研究了一种磺酸盐gemini表面活性剂XC8(结构式见图2)与普通单链阳离子表面活性剂CnTMABr(n=12,14,16)复配体系的动态表面张力,研究结果表明,随着CnTMABr疏水链长度的增加,表面活性剂的疏水性增加,分子向表面扩散的速率Da增加,且胶团解离速率常数k减小,意味着形成的胶束更稳定,但对于每一种复配体系,增加体系浓度,k越大,即胶团越容易解离。

图2 C9pPHCNa,C10-2-E2-C10及XC8的分子结构
此外,还可以借鉴王作华[36]和张燕[37]等利用界面扩张流变技术研究复配体系的方法,研究含gemini成分的正/负离子表面活性剂混合体系形成吸附膜黏弹性的特性,从而反映界面与体相之间的动态性质。也可以利用紫外吸收方法分析混合体系浊度,如龚伟[38]研究了离子液体表面活性剂CnmimBr/SDS(n=8,12,16)混合稀溶液在 400 nm处的紫外吸光度值随SDS含量的变化情况,进而分析体系的浊度。还可以利用等温滴定微量热法测定分子间结合和相互作用胶束化过程中热量变化,亦能用核磁手段通过出峰位置及氢质子化学位移情况推测异性分子间相互作用的部位等。
2.2 聚集体微观性质研究
2.2.1聚集数测定
Menger等[39]研究了一种阴离子gemini表面活性剂与C16TMABr混合体系,结果表明,在C16TMABr中加入gemini表面活性剂,只有在gemini表面活性剂摩尔成分很低时形成交联胶团。这些胶团主要由C16TMABr组成,gemini表面活性剂的2条烷基链嵌入到2个不同C16TMABr的胶束中充当交联部分。此外,光散射显示,在C16TMABr/gemini表面活性剂物质的量比较小时,例如0.05~0.07,体系中存在大的粒子。
Zana等[24]测定了比上述研究中gemini表面活性剂有着更长更有弹性的联接基团的阴离子gemini表面活性剂Dim1与传统表面活性剂C16TMABr的混合体系,在C16TMABr浓度为5 mmol/L,NaBr浓度为50 mmol/L的溶液中,不同浓度的Dim1在不同温度时的胶团聚集数(N)。荧光猝灭结果显示,随着gemini成分增加,聚集数的变化更快速增大;低温透射电子显微镜表明,在30 ℃下、gemini的摩尔分数为0.091时,有囊泡以及比较大但不明确的结构出现,因而无法得出准确的N。这种体系接近于沉淀,这种大的结构可能与上述文献[34]报道的一致。当温度为45 ℃时,测得的表观胶团聚集数为420,但此时体系中已有大小不一的囊泡和其他一些特别大的聚集体生成,接近于沉淀。在XDi=0.021 2及XDi=0.055 2时,温度为30 ℃和35 ℃时,聚集数分别在200左右和300左右。在单一组分的C16TMABr时,最小球状胶团的聚集数约为100。很显然,N≥150时已不再是球状胶团,此时生成的胶团为多分散性的伸长胶团。
在gemini表面活性剂16-s-16(s=3,5,10)与传统表面活性剂C16TMABr混合体系中,固定C16TMABr浓度不变,逐渐增加16-s-16的浓度,以测得混合胶束的聚集数。C16TMABr可以看作为16-s-16对应的单体表面活性剂。研究结果表明,随着16-s-16的浓度增加,每个胶束中的十六烷基链(NT)逐渐增大;在gemini组分浓度相同时,混合胶束中聚集数从小到大依次为:16-10-16,16-5-16,16-3-16[40-41]。
De等[42]用小角中子衍射法(SANS)研究了16-s-16/C16TMABr混合体系胶团的大小,并利用Hayter和Penfold 模型处理大粒子溶液的方法计算了体系混合胶团间内部粒子结构因子,混合体系聚集体组分与从理想混合模型所测得的结果一致,可见该混合体系接近理想混合。SANS测定结果进一步表明,混合体系胶团聚集体的生长及形状变化,可通过混合体系中gemini表面活性剂的含量来调控:当含量s≤4时,混合胶团生长的倾向相当大;随着s增大,会使得混合胶团中结构改变和联接基团疏水链逐渐弯曲,导致胶团内核微极性变小。
2.2.2微观结构
李飞飞[23]研究了双链阳离子表面活性剂双十二烷基二甲基溴化铵(DDAB)与单链阴离子表面活性剂十二烷基硫酸钠(SDS)的复配体系,利用透射电镜(TEM)观察到,体系中SDS的摩尔分数Xl=0.1,0.3时,除了形成大的囊泡还形成小的聚集体[43];Xl=0.6时,形成相对较小的囊泡。利用动态光散射(DLS)研究不同比例聚集体的流体力学直径(Dh)及粒径分布情况,结果表明,当Xl<0.5时,存在2个峰(Xl=0.1时为120 nm和580 nm;Xl=0.3时为70 nm和550 nm),这2个小峰对应小囊泡[44]或阴阳离子胶束,粒径大的囊泡大于纯DDAB体系的Dh(约为400 nm),意味着形成了富DDAB阴/阳离子囊泡;当Xl>0.5时,只有1个峰约为300 nm,且小于纯DDAB囊泡的粒径,表示溶液中形成了富SDS阴/阳离子囊泡,故阴/阳离子囊泡的Dh随着SDS的加入(Xl增大)先增大后减小。
小角中子散射研究表明,向球形的C16TMABr胶束体系中加入gemini表面活性剂16-s-16时,逐渐形成了线状胶束,在联接链s=3时这种转变效果最为明显。然而在12-2-12形成的线状胶团中加入C12TMABr后,当C12TMABr摩尔分数为0.3时,透射电子显微镜直接观察到其转变为球形胶团。实际上,C12TMABr是12-2-12的单体表面活性剂,单一的C12TMABr形成球状胶束。利用小角中子散射研究表明,C12TMABr几乎均匀地分散在混合的线状胶束中,然而之前的研究一直认为形成球状胶束的表面活性剂分子分布在线状胶团两端的半球处。
12-2-12在浓度相当低时(如质量分数为1%时)即形成非常大的线状胶团[45-47],而其相应的单体表面活性剂C12TMABr在浓度较高时还一直保持为球状胶团[48]。研究发现,在一定浓度(如质量分数为1%时)、已经形成线状胶团的12-2-12溶液中,逐渐添加C12TMABr时可导致混合体系胶团形状的改变,在C12TMABr摩尔分数仅为0.3时,体系即形成了球状胶团[49]。在此混合体系聚集体形状由线状转变为球状之前,Schosseler等[50]用中子衍射法研究发现,C12TMABr在线性胶团中呈现均匀分布。随着C12TMABr摩尔量增加,混合胶团总体刚性和平均长度降低,同时刚性的降低会减弱胶团间的相互作用,此种现象也表明体系从某种程度定向排列到无序分布的转变。
2.3.3微极性与微黏度
微极性的变化可以反映胶束形成过程中的一些特征。包新颜等[51]研究了一种以乙氧基为联接基的酯型gemini阳离子表面活性剂N,N′-双(二甲基十二酸乙酯基)乙醚溴化铵(记为Ⅱ-12-EO2)与SDS复配体系的胶束化行为,以芘(Py)为荧光探针测定了混合体系I1/I3随总表面活性剂浓度变化曲线,发现Ⅱ-12-EO2的胶束栅栏层的微极性较一般表面活性剂大,达到1.4,这是由于乙氧基的亲水性所致。不同比例的Ⅱ-12-EO2/SDS体系中,微极性最终均达到同一水平,I1/I3均为1.2左右。这是由于SDS的加入,Ⅱ-12-EO2离子头之间的静电斥力被SDS削弱,使Ⅱ-12-EO2/SDS混合胶束的结构较Ⅱ-12-EO2胶束结构紧密。这也从另一方面说明了Ⅱ-12-EO2与SDS存在协同效应。
李修芝[26]利用荧光偏振技术测得C12-3-C12·2Br单组分胶团的微黏度ηM=22.5 mPa·s,大于单链表面活性剂胶团的微黏度,如C14TMABr和十四烷基硫酸钠(STS)的ηM分别为12.0 mPa·s和8.0 mPa·s[52],这与Zana等[53]在25 ℃时C12-3-C12·2Br胶团微黏度是C12TMABr胶团的2.68倍的结论相符。有文献[52]指出,当C14TMABr和STS构成1∶1 混合胶团时,ηM可达45 mPa·s,可见在等物质的量比的正/负离子表面活性剂强烈相互作用下,混合胶团结构变得密实。C12-3-C12·2Br/SDS混合体系在总浓度为0.64 mmol/L时,混合胶团的ηM值均大于C12-3-C12·2Br单组分胶团,增加αSDS使ηM逐渐增大。这与上述普通表面活性剂的情况类似[52],说明混合胶团变得愈加密实。测定C12-3-C12·2Br/SDS混合体系在总浓度为0.64 mmol/L时的I1/I3值,发现该值与普通表面活性剂胶团的I1/I3值相近,与C12TMABr/SDS体系的值也相近(αSDS=0.100时,该体系的I1/I3为1.21),说明 C12-3-C12·2Br/SDS混合胶团的结构类似于通常的表面活性剂胶团。
3 含gemini成分的正/负离子表面活性剂复配系统的相行为
正/负离子表面活性剂混合水溶液可生成多种形态的聚集体,如胶团、囊泡、液晶等,表面活性剂的相行为随溶液体系的变化而变化。当体系平衡共存着絮凝胶团和小胶团或者絮凝囊泡和分散囊泡时,因不同形态聚集体密度的差异,使水溶液自发分成稳定的两相,即表面活性剂双水相。
尚亚卓等[54]将偶联正离子表面活性剂C12H25(CH3)2N-(CH2)3-N(CH3)2C12H25·2Br(12-3-12·2Br-)和传统负离子表面活性剂(SDS)混合,在体系总浓度确定下,随着表面活性剂混合比的逐渐变化,溶液从一澄清透明的均相溶液逐渐转变为另一澄清透明的均相溶液,在混合体系比为0.5∶1附近出现浑浊或沉淀。这是由于此时正、负电荷恰好中和,生成的正、负离子表面活性剂的聚凝体分散于水中的缘故,当阳离子表面活性剂过量时还出现液晶区和两个表面活性剂水溶液共存的双水相(ATPS)区。该课题组[55]还观察到在体系的溶液中表面活性剂形成了棒状胶团、多层囊泡和液晶等多种聚集体,在较低浓度(0.03 mol/L)和狭窄比例区域(两者物质的量比约为1.3~2.1)形成了双水相,且形成双水相的时间较传统正/负离子普通表面活性剂形成双水相的时间长,这主要与gemini本身的性质有关。采用冷冻蚀刻技术、负染色技术及透射电子显微镜观察到双水相的两相中存在不同种类的表面活性剂的聚集体,且囊泡和棒状胶团可以共存于一相,这在普通表面活性剂混合体系形成的双水相中并未见到。
黄艺雄等[56]研究了C12TMABr/C11pPHCNa混合溶液的双水相,发现双水相的形成非常依赖于体系的总浓度cT及两相间的摩尔分数比R的大小,且此体系形成双水相的cT,min为15 mmol/L,比文献[55]混合体系还小。当cT为31.6 mmol/L时,上相体积随R减小而逐渐减小,但趋向澄清;而下相则逐渐变浑浊,两相界面逐渐清晰。固定R=4.5∶1,随着cT变大,上相体积变多且愈浑浊,下相则相反;当R=1∶1时,cT减小,上相由浑浊变澄清又变为浑浊,且体积减小,下相体积增大,且略有乳光;在R>2时形成的双水相上相较黏稠,R<2则相反。
4 结语
正/负离子表面活性剂复配体系,因相反电荷离子头基间强静电相互作用,表现出较强的协同效应及表面活性,这在实践及理论上皆有重要意义。gemini表面活性剂的离子头基电荷密度及烷烃疏水性均显著强于普通单链表面活性剂,将其与带相反电荷的普通单链表面活性剂复配,有望产生更强的协同效应,甚至将两种带相异电荷的gemini表面活性剂混合,在一定条件下,也许会产生更理想的效果。但到目前为止,对该体系的研究较少,且相关研究主要集中在形成胶束及降低表面张力效率、效能的协同作用及对微观结构的理论分析上,而具有应用前景的,诸如萃取、增溶、起泡性能等极少见报道。因此,对于该体系的性质研究工作还有待深入系统地开展。
[1]肖进新, 赵振国. 表面活性剂应用原理[M]. 北京: 化学工业出版社, 2003:422.
[2]Zhao G X, Chen Y Z, Ou J G, et al. Interaction between cationic and anionic surfactants in aqueous solution[J].ActaChimSin, 1980, 28(5): 5-17.
[3]Kem F, Lequeux F, Zana R, et al. Dynamic properties of salt-free viscoelastic micellar solutions[J].Langmuir, 1994, 10(6): 1714-1723.
[4]Sharma K S, Rodgers C. Studies of mixed surfactant solutions of cationic dimeric (gemini) surfactant with nonionic surfactant C12E6 in aqueous medium[J].JournalofColloidandInterfaceScience, 2003, 268 (2): 482-488.
[5]邵瑞利. Gemini表面活性剂的合成及在三次采油中的应用[D].西安: 西北大学, 2010.
[6]晋来超, 施云海, 李海涛,等.含羟丙基Gemini阳离子表面活性剂与SDS的复配性质研究[J].化学世界, 2010(增刊1): 1-4.
[7]Rosen M J, Zhu Z H, Gao T. Synergism in binary mixture of surfactants: 11. Mixtures containing mono- and disulfonated alkyl- and dialkyldiphenylethers[J].JournalofColloidandInterfaceScience, 1993, 157 (1): 254-259.
[8]Rosen M J, Gao T, Nakatsuji Y, et al. Synergism in binary mixtures of surfactants 12. Mixtures containing surfactants with two hydrophilic and two or three hydrophobic groups[J].ColloidsandSurfacesA:PhysicochemicalandEngineeringAspects, 1994, 88 (1):1-11.
[9]Liu L, Rosen M J. The interaction of some novel diquaternary gemini surfactants with anionic surfactants[J].JournalofColloidandInterfaceScience, 1996, 179 (2): 454-459.
[10]Li F, Rosen M J, Sulthana S B. Surface properties of cationic gemini surfactants and their interaction with alkylglucoside or -maltoside surfactants[J].Langmuir, 2001, 17(4):1037-1042.
[11]Rosen M J, Zhou Q. Surfactant-surfactant interactions in mixed monolayer and mixed micelle formation[J].Langmuir, 2001, 17(12):3532-3537.
[12]Zana R, Levy H, Kwetkat K. Mixed micellization of dimeric (gemini) surfactants and conventional surfactants. I. Mixtures of an anionic dimeric surfactant and of the nonionic surfactants C12E5 and C12E8 [J].JournalofColloidandInterfaceScience, 1998, 197 (2):370-376.
[13]Zhao J, Christian S D, Fung B M. Mixtures of monomeric and dimeric cationic surfactants[J].JPhysChemB, 1998, 102(39): 7613-7618.
[14]Esumi K, Miyazaki M, Arai T, et al. Mixed micellar properties of a cationic gemini surfactant and a nonionic surfactant[J].ColloidsSurfacesA, 1998, 135 (1/2/3): 117-122.
[15]Alargova R G, Kochijashky I I, Sierra M L, et al. Mixed micellization of dimeric (gemini) surfactants and conventional surfactants: II. CMC and micelle aggregation numbers for various mixtures[J].JournalofColloidandInterfaceScience, 2001, 235(1): 119-129.
[16]Holland P M, Rubingh D N. Cationic surfactant: Physical chemistry. Surfactant Science Series 37[M]. New York: Marcel Dekker, 1991.
[17]Rosen M J, Tracy D J. Gemini surfactants [J].JournalofSurfactantsandDetergents, 1998, 4(1):547-554.
[18]Liu L, Rosen M J. The interaction of some novel diquaternary gemini surfactants with anionic surfactants[J].JournalofColloidandInterfaceScience, 1996, 179(2):454-459.
[19]肖进新, 罗妙宣, 吴树森. 孪连表面活性剂[J]. 自然杂志, 1997,19(6): 335-338.
[20]周湘竹. 阴,阳离子表面活性剂高盐溶液及其与卵磷脂复配体系的聚集行为和性质的研究[D]. 济南: 山东大学, 2012.
[21]Binks B P. Modern characterization methods of surfactant systems. Vol. 83[M]. Florida: CRC Press, 1999.
[22]赵家乐.含三嗪环磺酸盐阴离子 Gemini表面活性剂的应用性能研究[D]. 太原:中北大学, 2012.
[23]李飞飞.含有双烃链表面活性剂阴阳离子聚集行为及在药物缓释中的应用[D]. 济南: 山东大学, 2011.
[24]Zana R, Levy H, Danino D, et al. Mixed micellization of cetyltrimethylammonium bromide and an anionic dimeric (gemini) surfactant in aqueous solution[J].Langmuir, 1997, 13(3): 402-408.
[25]Venable R L, Nauman R V. Micellar weights of and solubilization of benzene by a series of tetradecylammonium bromides. The effect of the size of the charged head [J].JphysChem, 1964, 68(12):3498-3503.
[26]李修芝. 季铵盐 Gemini 表面活性剂与 SDS 的相互作用——相行为、胶团化及流变特性[D]. 福州: 福州大学, 2003.
[27]杨新富. 羧酸盐 Gemini 表面活性剂性质以及与相反电性普通表面活性剂的相互作用——相行为、表面吸附、胶团化及流变特性[D]. 福州: 福州大学, 2004.
[28]Koehler R D, Raghavan S R, Kaler E W. Microstructure and dynamics of wormlike micellar solutions formed by mixing cationic and anionic surfactants[J].JPhysChemB, 2000, 104(47): 11035-11044.
[29]Raghavan S R, Fritz G, Kaler E W. Wormlike micelles formed by synergistic self-assembly in mixtures of anionic and cationic surfactants[J].Langmuir, 2002, 18(10):3797-3803.
[30]Schubert B A, Kaler E W, Wagner N J. The microstructure and rheology of mixed cationic/anionic wormlike micelles[J].Langmuir, 2003, 19(10):4079-4089.
[31]In M, Bec V, Aguerre-charid O. Quaternary ammonium bromide surfactant oligomers in aqueous solution:self-association and microstructure[J].Langmuir, 2000,16(1):141-148.
[32]Wang K, Yin H, Sha W, et al. Temperature-sensitive aqueous surfactant two-phase system formation in cationic anionic surfactant systems[J].JPhysChemB, 2007, 111(45):12997-13005.
[33]Feitosa E, Bonassi N M, Loh W. Vesicle micelle transition in mixtures of dioctadecyldimethylammonium chloride and bromide with nonionic and zwitterionic surfactants[J].Langmuir, 2006 ,22(10): 4512-4517.
[34]马艳华. 含Gemini组分的表面活性剂复配体系在气液表面的吸附行为[D].福州: 福州大学, 2005.
[35]申长念. X型磺酸盐 Gemini 表面活性剂与单链表面活性剂复配体系的研究[D]. 太原: 中北大学, 2013.
[36]王作华, 张春荣, 李浩程,等. 表面活性剂复配体系表面扩张流变性质研究[J].吉林师范大学学报:自然科学版, 2013 (1): 65-67.
[37]张燕. Bola型组氨酸基表面活性剂(H2D)及其复配体系的气/液界面吸附[D]. 扬州:扬州大学, 2010.
[38]龚伟. 离子液体表面活性剂CnmimBr与阴离子表面活性剂SDS复配体系的特性及其与α-生育酚的相互作用[D]. 扬州:扬州大学, 2010.
[39]Menger F M, Eliseev A V. Cross-linked micelles[J].Langmuir,1995, 11(6): 1855-1857.
[40]De S, Aswal V K, Goyal P S,et al. Role of spacer chain length in dimeric micellar organization. Small angle neutron scattering and fluorescence studies[J].JPhysChem, 1996, 100(28):11664-11671.
[41]Aswal V K, De S, Goyal P S, et al. Transition from disc to rod-like shape of 16-3-16 dimeric micelles in aqueous solutions[J].JChemSoc,FaradayTrans, 1998, 94:2965-2967.
[42]De S, Aswal V K, Goyal P S, et al. Small-angle neutron scattering studies of different mixed micelles composed of dimeric and monomeric cationic surfactants[J].JPhysChemB, 1997, 101(29): 5639-5645.
[43]Chakraborty H, Sarkar M. Optical spectroscopic and TEM studies of catanionic micelles of CTAB/SDS and their interaction with a NSAID[J].Langmuir, 2004, 20(9): 3551-3558.
[44]Marques E F, Regev O, Khan A, et al. Vesicle formation and general phase behavior in the catanionic mixture SDS-DDAB-Water. The anionic-rich side[J].JphysChemB, 1998, 102(35): 6746-6758.
[45]Zana R, Talmon Y. Dependence of aggregate morphology on structure of dimeric surfactants[J].Nature, 1993, 362:228-230.
[46]Alami E, Abrahmsen-Alami S, Eastoe J, et al. Interactions between a nonionic gemini surfactant and cyclodextrins investigated by small-angle neutron scattering[J].JournalofColloidandInterfaceScience, 2002, 255(2):403-409.
[47]Groswasser A B, Zana R, Talmon Y. Sphere-to-cylinder transition in aqueous micellar solution of a dimeric (gemini) surfactant[J].JPhysChemB, 2000, 104(17):4005-4009.
[48]Candau S J, Hirsch E, Zana R. New aspects of the behaviour of alkyltrimethylammonium bromide micelles :light scattering and viscosimetric studies[J].JPhys(France): 1984, 45:1263-1270.
[49]Kastner U, Zana R. Interactions between quaternary ammonium surfactant oligomers and water-soluble modified guars[J].JournalofColloidandInterfaceScience, 1999, 218(2):468-479.
[50]Schosseler F, Anthony O, Beinert G, et al. Mixed micelles of the dimeric surfactant ethanediyl-1,2-bis(dodecyldimethy lammonium bromide) and its corresponding monomer, the dodecyltrimethylammonium bromide: a neutron scattering study[J].Langmuir, 1995, 11(9):3347-3350.
[51]包新颜, 许虎君, 梁金龙. 一种酯型双子表面活性剂的合成及其协同效应[J].日用化学工业, 2006, 36(1):1-4.
[52]姜永才, 吴世康. 利用荧光偏振法对表面活性剂溶液中胶束特性的研究[J]. 感光科学与光化学, 1995, 13: 2.
[53]Zana R, In M, Levy H, et al. Alkanediyl-α,ω-bis (dimethylalkylammonium bromide): 7. Fluorescence probing studies of micelle micropolarity and microviscosity [J].Langmuir, 1997, 13:5552-5557.
[54]尚亚卓, 张倩, 刘洪来,等. 偶联表面活性剂和传统表面活性剂混合水溶液的性质[J]. 华东理工大学学报, 2004, 30 (4): 419-424.
[55]尚亚卓, 陈启斌, 韦园红, 等. 偶联表面活性剂与传统表面活性剂混合溶液的双水相[J]. 华东理工大学学报, 2003, 29(2): 206-213.
[56]黄艺雄, 姜蓉,赵剑曦,等. 含Gemini成分的正负离子表面活性剂混合体系的双水相[J]. 精细化工, 2005, 22 (增刊1):100-103.

