节肢动物共生细菌Hamiltonella的分布、传播、功能及基因组研究
邴孝利,饶 琼,栾军波,刘树生*
(1.浙江大学昆虫科学研究所农业部农业昆虫学重点实验室,杭州 310058;2.浙江农林大学农业与食品科学学院,杭州 临安 311300)
昆虫共生细菌是一类普遍存在于寄主昆虫体内的细菌,其在昆虫中的分布极为广泛(Hilgenboecker et al.,2008)。昆虫共生细菌可以分为两类:(1)原生共生细菌 (primary symbiont),如蚜虫体内的Buchnera,粉虱体内的Portiera等。原生共生细菌通常分布于特化的寄主昆虫组织内,与寄主昆虫具有严格的协同进化关系,且垂直传播。一种昆虫一般只有一种原生共生细菌 (Baumann,2005)。 (2)次生共生细菌(secondary symbiont),如 Hamiltonella、Regiella、Rickettsia、Wolbachia 等 (Moranetal., 2008;Oliver et al.,2010)。次生共生细菌侵染寄主昆虫的历史相对较短,与寄主昆虫间的协同进化关系不紧密。次生共生细菌可以分布于寄主昆虫多处组织细胞内 (Gottlieb et al.,2008)。与原生共生细菌不同,次生共生细菌除可以随母系生殖垂直传播外,有些也可以水平传播。一种昆虫可有一种或多种次生共生细菌。
1992年,Clark等 (1992)通过16S rRNA基因序列分析在烟粉虱体内发现了一种与豌豆蚜Acyrthosiphon pisum体内共生细菌亲缘关系很近的次生共生细菌,后来Darby等 (2001)在蚜虫中也发现了这种共生细菌,并将其称为pea aphid Bemisia-like symbiont(PABS)。PABS隶属于γ变形菌纲,肠杆菌科Enterobacteriaceae,是革兰氏阴性菌,也曾被称为T type共生细菌。2005年Moran等结合16S-23S rRNA基因、gyrB基因和recA基因的系统发育结果及电镜显微观察结果等数据,将PABS命名为“Candidatus Hamiltonella defensa”(Moran et al.,2005b)。鉴于目前研究表明其对寄主抗逆性等特性有重要作用,而国内学者对该菌的关注较少,本文综述了目前已有的研究结果,以供参考。为便于描述,本文中将其简称为Hamiltonella。
1 Hamiltonella的形态与分布
1.1 Hamiltonella的形态
荧光原位杂交与电镜的观察结果表明,Hamiltonella为杆状的细胞,其直径大约为0.6-0.7 μm,长为 1.5-10 μm(Darby et al.,2001,Moran et al.,2005b,Gottlieb et al.,2008)。
1.2 Hamiltonella的寄主范围
到目前为止,Hamiltonella只在半翅目昆虫体内被检测到,且主要发现于蚜虫和粉虱体内。其中被 Hamiltonella感染的蚜虫有:Acyrthosiphon pisum, Aphis craccivora, Aphis fabae, Aphis sarothamni, Chaitophorus sp., Cinara sp.,Geopemphigus sp., Hyperomyzus lactuceae,Macrosiphum euphorbiae,Metopolophium dirhodum,Pemphigus spyrothecae, Periphyllus bulgaricus,Uroleucon ambrosiae, Uroleucon astronomus,Uroleucon atripes, Uroleucon escalantii, Uroleucon nigrotuberculatum, Uroleucon pieloui, Uroleucon reynoldense,Uroleucon rudbeckiae, Uroleucon sonchi(Haynes et al.,2003,Russell et al.,2003,Degnan and Moran,2008,Telesnicki et al.,2012);被Hamiltonella感染的粉虱有:Trialeurodes vaporariorum和Bemisia tabaci(仅限于烟粉虱入侵隐种 B 和 Q)(Chiel et al.,2007;Gueguen et al.,2010;Skaljac et al.,2010;Chu et al.,2011,Pan et al.,2012;Bing et al.,2013)。除此之外,木虱Cacopsylla pyri体内也曾发现过 Hamiltonella(Russell et al.,2003)。
1.3 Hamiltonella在寄主昆虫体内的分布
Hamiltonella在不同寄主昆虫体内具有完全不同的分布方式 (图1)。在蚜虫体内,在次生含菌细胞 (secondary bacteriocytes)、鞘细胞 (sheath cells)、血淋巴、肠道、卵巢等部位都可以被检测到 (Darby et al.,2001,Moran et al.,2005b)。但是Hamiltonella在粉虱体内仅局限于含菌细胞内,或存在于卵柄的一端 (Gottlieb et al.,2008;Skaljac et al.,2010)。
2 Hamiltonella的传播方式
2.1 垂直传播
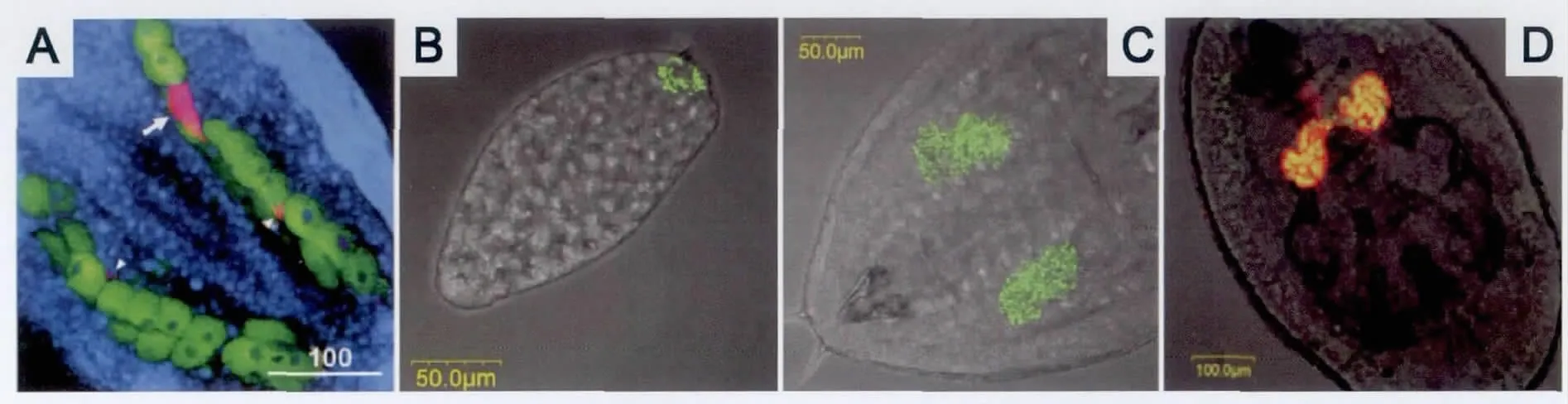
图1 Hamiltonella在昆虫体内组织分布的原位杂交图Fig.1 Localization of Hamiltonella in insect tissues(shown by FISH)
由于Hamiltonella存在于寄主蚜虫卵巢内,因此可以顺利地垂直传播 (Darby et al.,2001;Darby and Douglas,2003)。在烟粉虱繁殖过程中,完整的含菌细胞会进入卵巢,Hamiltonella在此过程中与Portiera一起被垂直传播到子代 (Szklarzewicz and Moskal,2001;Rosell et al.,2010)。
2.2 水平传播
Hamiltonella在不同蚜虫之间的水平传播可以通过一系列人工注射转移试验证明:将含有Hamiltonella的A蚜虫体内的血淋巴注射入另一无Hamiltonella的B蚜虫体内,则Hamiltonella可以在B蚜虫体内稳定垂直传播 (Oliver et al.,2003,Łukasik etal.,2012)。除此之外,给不含Hamiltonella的豌豆蚜和黑豆蚜Aphis fabae饲喂含有Hamiltonella的豌豆蚜细胞,则两种不含Hamiltonella的蚜虫都可以获得Hamiltonella且至少能传3代 (Darby and Douglas,2003)。Hamiltonella还可以在蚜虫雌雄两性间进行种内传播 (Moran and Dunbar,2006)。对大量田间蚜虫无性系的调查及显微观察结果也表明,共生细菌会入侵蚜虫细胞并在蚜虫世系间进行垂直和水平传播(Sandstrom et al.,2001)。最新的研究表明,寄生蜂科曼尼蚜茧蜂Aphidius colemani寄生时的产卵器针刺可造成Hamiltonella在黑豆蚜种内个体间的水平传播 (Gehrer and Vorburger,2012)。
但是,将不含 Hamiltonella的蚜虫与含有Hamiltonella的蚜虫放在同一植物上饲养时,却未发现Hamiltonella的水平传播现象 (Darby and Douglas,2003)。虽然豌豆蚜的蜜露和腹管分泌物中可以检测到Hamiltonella,但是豌豆蚜无法通过唾液分泌物将Hamiltonella注入植物组织 (Darby and Douglas,2003)。另外,寄生蜂 Eretmocerus emiratus、Eretmocerus eremicus和Encarsia pergandiella均不能通过取食烟粉虱感染Hamiltonella(Chiel et al.,2009)。
3 Hamiltonella在昆虫体内的功能
3.1 Hamiltonella增加蚜虫对寄生蜂的抗性
Hamiltonella之所以被命名为“defensa”是由于其可以保护寄主昆虫免受天敌的危害,特别是寄生蜂的寄生 (Moran et al.,2005b)。2001年Ferrari等发现在34个豌豆蚜种群中,不同种群对阿尔蚜茧蜂Aphidius ervi和A.eadyi的抗性有差异(Ferrari et al.,2001)。随后他们在研究中发现,含有Hamiltonella的豌豆蚜对A.eadyi的抗性最强,对阿尔蚜茧蜂的抗性次之。但这种相关性与当时使用的寄主植物有很大的关系 (Ferrari et al.,2004)。Oliver等 (2003)发现在控制基因背景的情况下,豌豆蚜在感染Hamiltonella后,可以使阿尔蚜茧蜂幼虫发育过程中的死亡率显著增高。阿尔蚜茧蜂在含有Hamiltonella的豌豆蚜和不含Hamiltonella的对照豌豆蚜上产卵数目一样,但阿尔蚜茧蜂产的卵很难在体内含有Hamiltonella的豌豆蚜上完成发育。因此,Hamiltonella可以保护蚜虫抵抗寄生蜂的攻击。
虽然Hamiltonella是由母本垂直传播的,但其在自然界中有时也可以水平传播,并建立具有不同遗传背景的带菌蚜虫种群。豌豆蚜对寄生蜂的抗性是否因不同蚜虫种群的基因型不同而异?为此,Oliver等建立了分别含有Hamiltonella五个分离株的同一豌豆蚜无性系种群和含有同一Hamiltonella分离株的五个不同遗传背景的豌豆蚜无性系种群,用以检测各豌豆蚜无性系种群对阿尔蚜茧蜂的抗性水平。结果发现:不同Hamiltonella分离株的豌豆蚜种群对阿尔蚜茧蜂的抗性为19%到接近100%不等,而含有同一Hamiltonella分离株的不同无性系种群中豌豆蚜对阿尔蚜茧蜂的抗性水平相似 (40%-60%)(2005)。这表明蚜虫对寄生蜂的抗性水平与Hamiltonella密切相关,寄主蚜虫的基因型没有直接影响蚜虫对寄生蜂的抗性水平。
蚜虫体内的次生共生细菌的种类数也影响蚜虫对寄生蜂的抗性,某些不同共生细菌的组合能增加蚜虫对寄生蜂的抗性,且Hamiltonella对寄生蜂的抵抗作用具有特异性 (Nyabuga et al.,2010)。豌豆蚜被Serratia symbiotica和Hamiltonella两种共生细菌双重侵染后,其对阿尔蚜茧蜂的抗性比只被其中任何一种共生细菌单独侵染的豌豆蚜产生的抗性都强 (Oliveretal.,2006)。而且Hamiltonella-Spiroplasma共存和Regiella insecticola-Hamiltonella共存时,豌豆蚜被寄生后僵化的数目都有所减少 (Nyabuga et al.,2010)。这说明,一些共生细菌可协同调控并增强寄主对寄生蜂的抗性。
为了探明感染Hamiltonella的蚜虫抵抗寄生蜂的作用机理,Moran等通过对蚜虫血淋巴中的DNA扩增得到了一些Hamiltonella的基因组序列和一种相关的噬菌体APSE-2(bacteriophage 2 of the A.pisum secondaryendosymbiont)(Moranetal.,2005a)。对序列分析后发现,Hamiltonella含有2个三型分泌系统 (typeⅢ secretion systems,TTSS)。APSE-2含有编码细胞致死性肿胀毒素(cytolethal distending toxin,cdtB)同族 体(homolog)的基因及与一种哺乳动物病原体基因类似的基因。ctdB能阻断真核细胞的细胞周期。与APSE-2类似的噬菌体在多种Hamiltonella分离株中都存在。因此,噬菌体很可能参与了蚜虫抵抗寄生蜂的活动(Oliveretal., 2009)。Hamiltonella的基因组测序完成后,再次证实了Moran的结论 (Degnan et al.,2009)。噬菌体的毒性基因编码的蛋白使蚜虫产生了对寄生蜂寄生的抗性,虽然APSE缺失会增加Hamiltonella的密度,但是APSE的缺失会严重干扰Hamiltonella对蚜虫的共生关系 (Degnan and Moran,2008;Weldon et al.,2013)。这些观察表明,APSE、Hamiltonella和蚜虫三者组成了一个复杂的互利共生体系。
此外,Hamiltonella对寄主蚜虫抵抗寄生蜂的作用会受到环境温度的影响。在20℃下一些含有Hamiltonella的蚜虫 (该蚜虫为在北美随机选择的种群)对阿尔蚜茧蜂的寄生具有完全的免疫能力。然而当温度升到25℃时,这种免疫能力明显下降;30℃时免疫能力下降更多。不含Hamiltonella的对照组蚜虫在各个温度下均对阿尔蚜茧蜂敏感(Bensadia et al.,2006)。
3.2 Hamiltonella影响寄生蜂对蚜虫的寄生行为
由于含有Hamiltonella会增加蚜虫对寄生蜂的抗性,阿尔蚜茧蜂在寄生豌豆蚜时,也已进化出相应的对策。阿尔蚜茧蜂会因豌豆蚜是否含有Hamiltonella而改变其产卵行为。在含有Hamiltonella的蚜虫体内产2粒卵会比只产1粒卵显著增加蚜茧蜂的寄生成功率。因此阿尔蚜茧蜂会在含有Hamiltonella的蚜虫体内产2粒卵,而在不含Hamiltonella的蚜虫体内只产1粒卵,借以提高其在豌豆蚜中的寄生成功率 (Oliver et al.,2012)。
3.3 Hamiltonella增加蚜虫对高温的耐受性
在Russell等 (2006)的试验中,对2日龄的豌豆蚜经历如下变温处理:从18℃开始,在2 h之内升温到37.5℃ (±0.5℃),维持4 h后,再降回至18℃。经此处理之后,含有Hamiltonella的豌豆蚜在热击后的存活率比不含Hamiltonella的豌豆蚜的存活率要高出34%,此耐热性几乎可以与S.symbiotica诱导的耐热性持平。
3.4 Hamiltonella有助于植物病毒在媒介昆虫体内的传播
以色列的B隐种烟粉虱可以传播番茄黄化曲叶病毒 (Tomato yellow leaf curl virus,TYLCV),而Q隐种烟粉虱无法传播TYLCV。B隐种烟粉虱体内含有Hamiltonella,而Q隐种烟粉虱体内无Hamiltonella。酵母双杂交和pull down assays两种方法均显示,B隐种烟粉虱体内的Hamiltonella表达的GroEL蛋白可以与TYLCV病毒进行互作结合。这说明烟粉虱Hamiltonella的GroEL蛋白在保护病毒传播中起关键作用 (Gottlieb et al.,2010)。在中国,烟粉虱B隐种和Q隐种都含有Hamiltonella且都能传播 TYLCV(Li et al.,2010;Chu et al.,2011;Bing et al.,2013)。 Su 等(2013)利用抗生素利福平去除掉中国境内的烟粉虱Q隐种体内的Hamiltonella后发现,与正常含有Hamiltonella的 Q隐种烟粉虱相比,不含Hamiltonella的Q隐种烟粉虱对TYLCV的获毒、持毒及传毒能力均有所下降,进一步证明了Hamiltonella在烟粉虱传播双生病毒的过程中起积极作用。
3.5 Hamiltonella与寄主昆虫营养的关系
Douglas等 (2006)比较了含有不同次生共生细菌的豌豆蚜在含有限定营养成分 (蔗糖与氨基酸)的人工饲料上的生物学表现,结果表明共生细菌对蚜虫的影响不仅仅是与营养有关。
另有研究发现,黑豆蚜在一种唇形科植物Lamium purpureum上比在另一种寄主植物蚕豆Vicia faba上生长更缓慢,而且当蚜虫体内共生细菌 R.insecticola和 Hamiltonella密度较高时,L.purpureum对蚜虫的不利作用表现更明显。分析发现,L.purpureum中的氨基酸含量很低,而生长在L.purpureum上的蚜虫体内 R.insecticola和Hamiltonella密度都较高。当使用类似的低氨基酸含量的人工饲料饲喂蚜虫时,蚜虫生长缓慢,且次生共生细菌的密度有所增加 (Chandler et al.,2008)。因此,植物韧皮部中的营养成分可以干扰昆虫控制其体内共生细菌丰度的能力。
3.6 含有Hamiltonella对蚜虫的利弊
虽然Hamiltonella可以帮助蚜虫增加对寄生蜂的抗性,因而使得蚜虫在有寄生蜂胁迫的环境中具有生存优势,但是在蚜虫的自然种群中,Hamiltonella的侵染率并不高 (Tsuchida et al.,2002;Simon et al.,2003;Oliver et al.,2006;Vorburger et al.,2009)。对黑豆蚜多个种群的比较试验结果表明,与不含Hamiltonella的蚜虫相比,含有Hamiltonella的蚜虫繁殖率更高 (Vorburger et al.,2009)。与之类似,Castaneda等 (2010)的研究也表明,含有Hamiltonella的黑豆蚜种群成虫体型更大,产仔量更高,内禀增长率更高。但含有Hamiltonella黑豆蚜与不含该菌的黑豆蚜相比,发育历期及后代个体大小差异均不显著。而在黑豆蚜种群饲养过程中,含有Hamiltonella的黑豆蚜与不含Hamiltonella的黑豆蚜相比,适应能力更强。Vorburger等 (2011)将6个不同Hamiltonella菌系转入2个不含Hamiltonella的黑豆蚜无性系中,仔细比较后发现,含有Hamiltonella显著降低了蚜虫的寿命。
在群体试验中,在没有寄生蜂胁迫的情况下,含有Hamiltonella的豌豆蚜在与不含该菌的豌豆蚜竞争时,其种群数量明显下降 (Oliver et al.,2008)。但在种群适应性试验中,Hamiltonella并未对蚜虫表现出不利影响,而且含有Hamiltonella的豌豆蚜比不含该菌的豌豆蚜相比,发育速率较块,生殖力较高 (Oliver et al.,2008)。这种寄主群体试验与个体试验之间的差异,原因尚不明了。另外,当豌豆蚜在感染了取自豆蚜Aphis craccivora的Hamiltonella菌系后,其在25℃下的平均相对生长速率与感染了取自豌豆蚜的Hamiltonella菌系的蚜虫相比,明显增加 (Russell and Moran,2005)。因此,来自不同寄主昆虫的Hamiltonella菌系对一种寄主昆虫的作用可有不同。
4 Hamiltonella基因组的研究
对豌豆蚜体内Hamiltonella的基因组测序结果显示,Hamiltonella基因组大小为2.11 Mb,远低于可以自由生长的细菌如Yersinia和Serratia(4.6-5.4 Mb)。Hamiltonella的基因组含有2100个预测的编码序列,其组成与其他共生细菌的基因组类似,A+T含量很高 (60%)。Hamiltonella只能合成2种必需氨基酸 (LYS,THR)和7中非必需氨基酸 (ASP,ASN,GLU,GLY,SER,CYS,ALA),以及除 VB1(thiamine)和 VB5(pantothenate)之外的大多数必需维生素 (Degnan et al.,2009)。Hamiltonella需要的大多数必需氨基酸都是蚜虫所取食的韧皮部汁液中所缺少的(Sandstrom and Pettersson,1994)。而蚜虫原生共生细菌Buchnera可以利用有限的碳源、氮源合成各种必需氨基酸 (Douglas,1998)。因此,Hamiltonella与其寄主蚜虫都依赖Buchnera提供必需营养。Hamiltonella编码的传代和调控细胞结构所需的基因要比 Buchnera编码的更多。Hamiltonella染色质也包含了编码一些可能的毒性位点的基因,这包括10个由两类Ⅲ型分泌系统传输的效应蛋白和10种完整的RTX(repeats in toxin)毒素及其相关的转运蛋白 (Degnan et al.,2009)。据报道,在一些具致病性的肠杆菌科微生物中(如Salmonella和Yersinia),Ⅲ型分泌系统有助于细菌入侵真核细胞 (Galán and Collmer,1999,Dale et al.,2002)。除此之外,Hamiltonella的基因组流动性很强,含有很多移动DNA,如插入序列、Ⅱ型内含子 (groupⅡ introns)、质粒等 (Degnan et al.,2009,Degnan et al.,2010)。
烟粉虱Q隐种体内的Hamiltonella的基因组草图显示其基因组大小≥1.84 Mb,至少含有1806个预测的编码序列和38个tRNA(Rao et al.,2012)。
5 讨论和展望
由于Hamiltonella有助于增加蚜虫对寄生蜂的抗性,因此在生物防治中使用寄生蜂防控蚜虫的时候,需要考虑Hamiltonella的存在对防控效果的影响。尤其是在防治温室中的蚜虫、粉虱危害时,由于环境封闭,外界环境因素对种群的干扰较少。此时,寄生蜂对蚜虫的选择压力是否会使Hamiltonella在蚜虫种群中的侵染率上升,进而引发蚜虫对寄生蜂的抗性,影响生物防治的效果,还有待研究。
共生细菌在寄主昆虫中的功能研究是近年的热点,但也因为其生物学性状的特殊性,研究起来难度较大。共生细菌多数不能在体外纯培养,因此无法利用传统的微生物学手段研究。利用抗生素去除共生细菌,虽有关于其效果的专一性存在争议,但仍被认为是研究共生细菌功能的重要手段。尤其在蚜虫中,该方法极大地帮助了科学家们研究Hamiltonella在蚜虫体内的生物学功能(Douglas et al.,2006;Chandler et al., 2008;McLean et al.,2010)。但是在某些生物系统中,抗生素处理的研究难度较大,且即便抗生素处理成功,利用去除某种细菌后的寄主种群所做试验的结果,可能也难以客观反映该菌的生物学功能。以烟粉虱为例,Hamiltonella所位于的含菌细胞高度特化,几乎相当于烟粉虱的一个器官。虽然已有文献报道抗生素处理对烟粉虱的影响,但是不同文献间的试验结果相差明显,且对引起差异的原因一无所知 (Ruan et al.,2006;Ahmed et al.,2010;Su et al.,2013)。因此,这类试验研究的生物学意义,还有待进一步验证。与在蚜虫体内的分布不同,Hamiltonella在粉虱体内与粉虱原始共生细菌Portiera共同分布于含菌细胞之内 (Gottlieb et al.,2008;Skaljac et al.,2010),二者之间必定有密切的互作而共同影响寄主昆虫的生物学特性。利用抗生素去除Hamiltonella后,原始共生细菌Portiera的作用可能受到明显影响。因此,去除Hamiltonella后烟粉虱所出现的生物学特性变化,可能并非Hamiltonella的直接作用所导致的。
除此之外,利用显微注射等技术使原本不含Hamiltonella的种群获得该共生细菌,进而比较获得细菌前后寄主昆虫的生物学变化,也是研究共生细菌功能的重要手段。该方法对揭示Hamiltonella协助蚜虫抵抗寄生蜂寄生的现象及其机理有重要贡献 (Oliver et al.,2003,2006,2009)。但是在烟粉虱的研究中,显微注射的技术一直没有发展起来,迄今为止,尚未发现成功利用显微注射技术使不含Hamiltonella的种群获得Hamiltonella的报道。其原因可能是烟粉虱个体非常小 (成虫体长约1 mm),被注射后死亡率非常高,因而无法建立相应的寄主种群。
近年来,转录组学及细菌基因组学的发展为研究共生细菌打开了另一扇窗。转录组学及细菌基因组学有助于宏观的分析锚定共生细菌的某些可能具有特殊功能的基因。共生细菌基因的操作有助于研究该基因在细菌或寄主昆虫中的潜在功能。且基因层面的研究可以摆脱抗生素处理对不同共生细菌间的非特异性影响可能导致的关联反应,因而更具针对性。
如何探索共生细菌在寄主昆虫中的功能,继而对共生细菌在寄主中的作用进行人为调控,探索害虫防治和益虫利用的新思路,将是以后研究的重点。
References)
Ahmed MZ,Ren SX,Xue X,et al.Prevalence of endosymbionts in Bemisia tabaci populations and their in vivo sensitivity to antibiotics[J].Current Microbiology,2010,61(4):322-328.
Baumann P.Biology of bacteriocyte-associated endosymbionts of plant sap-sucking insects[J].Annual Review of Microbiology,2005,59:155-189.
Bensadia F,Boudreault S,Guay JF,et al.Aphid clonal resistance to a parasitoid fails under heat stress[J].Journal of Insect Physiology,2006,52(2):146-157.
BingXL, Ruan YM, Rao Q, etal. Diversity ofsecondary endosymbionts among different putative species of the whitefly Bemisia tabaci[J].Insect Science,2013,20(2):194-206.
Castaneda LE,Sandrock C,Vorburger C.Variation and covariation of life history traits in aphids are related to infection with the facultative bacterial endosymbiontHamiltonella defensa [J]. Biological Journal of the Linnean Society,2010,100(1):237-247.
Chandler SM,Wilkinson TL,Douglas AE.Impact of plant nutrients on the relationship between a herbivorous insect and its symbiotic bacteria[J].Proceedings of the Royal Society B:Biological Sciences,2008,275(1634):565-570.
Chiel E,Gottlieb Y,Zchori-Fein E,et al.Biotype-dependent secondary symbiont communities in sympatric populations of Bemisia tabaci[J].Bulletin of Entomological Research,2007,97(4):407-413.
Chiel E,Zchori-Fein E,Inbar M,et al.Almost there:transmission routes of bacterial symbionts between trophic levels[J].PLoS ONE,2009,4(3):e4767.
Chu D,Gao C,De Barro P,et al.Further insights into the strange role of bacterial endosymbionts in whitefly,Bemisia tabaci:comparison of secondary symbionts from biotypes B and Q in China[J].Bulletin of Entomological Research,2011,101(4):477-486.
ClarkMA, Baumann L, Munson MA, etal. Theeubacterial endosymbionts of whiteflies(Homoptera:Aleyrodoidea)constitute a lineage distinct from the endosymbionts of aphids and mealybugs[J].Current Microbiology,1992,25(2):119-123.
Dale C,Plague GR,Wang B,et al.TypeⅢ secretion systems and the evolution of mutualistic endosymbiosis[J].Proceedings of the National Academy of Sciences of the United States of America,2002,99(19):12397-12402.
Darby AC,Birkle LM,Turner SL,et al.An aphid-borne bacterium allied to thesecondary symbiontsofwhitefly[J]. FEMS Microbiology Ecology,2001,36(1):43-50.
Darby AC,Douglas AE.Elucidation of the transmission patterns of an insect- borne bacterium [J].Applied and Environmental Microbiology,2003,69(8):4403-4407.
Degnan PH,Leonardo TE,Cass BN,et al.Dynamics of genome evolution in facultative symbionts of aphids[J].Environmental Microbiology,2010,12(8):2060-2069.
Degnan PH,Moran NA.Evolutionary genetics of a defensive facultative symbiont of insects:exchange of toxin-encoding bacteriophage[J].Molecular Ecology,2008,17(3):916-929.
Degnan PH,Yu Y,Sisneros N,et al.Hamiltonella defensa,genome evolution of protective bacterial endosymbiont from pathogenic ancestors[J].Proceedings of the National Academy of Sciences of the United States of America,2009,106(22):9063-9068.
Douglas AE.Nutritional interactions in insect-microbial symbioses:aphids and their symbiotic bacteria Buchnera[J].Annual Review of Entomology,1998,43:17-37.
Douglas AE,Francois CLMJ,Minto LB. Facultative ‘secondary’bacterialsymbionts and the nutrition of the pea aphid,Acyrthosiphon pisum [J].Physiological Entomology,2006,31(3):262-269.
Ferrari J,Darby AC,Daniell TJ,et al.Linking the bacterial community in pea aphids with host-plant use and natural enemy resistance[J].Ecological Entomology,2004,29(1):60-65.
Ferrari J,Muller CB,Kraaijeveld AR,et al.Clonal variation and covariation in aphid resistance to parasitoids and a pathogen [J].Evolution,2001,55(9):1805-1814.
Galán JE,Collmer A.TypeⅢ secretion machines:bacterial devices for protein delivery into host cells[J].Science,1999,284(5418):1322-1328.
Gehrer L,Vorburger C.Parasitoids as vectors of facultative bacterial endosymbionts in aphids[J].Biology Letters,2012.
Gottlieb Y,Ghanim M,Gueguen G,et al.Inherited intracellular ecosystem:symbiotic bacteria share bacteriocytes in whiteflies[J].FASEB Journal,2008,22(7):2591-2599.
Gottlieb Y,Zchori-Fein E,Mozes-Daube N,et al.The transmission efficiency of tomato yellow leaf curl virus by the whitefly Bemisia tabaci is correlated with the presence of a specific symbiotic bacterium species[J].Journal of Virology,2010,84(18):9310-9317.
Gueguen G, Vavre F, Gnankine O, et al. Endosymbiont metacommunities,mtDNA diversity and the evolution of the Bemisia tabaci(Hemiptera:Aleyrodidae)species complex[J].Molecular Ecology,2010,19(19):4365-4378.
Haynes S,Darby AC,Daniell TJ,et al.Diversity of bacteria associated with natural aphid populations[J].Applied and Environmental Microbiology,2003,69(12):7216-7223.
Hilgenboecker K,Hammerstein P,Schlattmann P,et al.How many species are infected with Wolbachia?-a statistical analysis of current data [J].FEMS Microbiology Letters,2008,281(2):215-220.
Li M,Hu JA,Xu FC,et al.Transmission of Tomato Yellow Leaf Curl Virus by two invasive biotypes and a Chinese indigenous biotype of the whitefly Bemisia tabaci[J].International Journal of Pest Management,2010,56(3):275-280.
Tukasik P, vanAschM, GuoH, etal. Unrelated facultative endosymbionts protect aphids against a fungal pathogen [J].Ecology Letters,2012,16(2):214-218.
McLean AHC,van Asch M,Ferrari J,et al.Effects of bacterial secondary symbionts on host plant use in pea aphids [J].Proceedings of the Royal Society B:Biological Sciences,2010.
Moran NA,Degnan PH,Santos SR,et al.The players in a mutualistic symbiosis:insects,bacteria,viruses,and virulence genes [J].Proceedings of the National Academy of Sciences of the United States of America,2005a,102(47):16919-16926.
Moran NA,Dunbar HE.Sexual acquisition of beneficial symbionts in aphids[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(34):12803-12806.
Moran NA,McCutcheon JP,Nakabachi A.Genomics and evolution of heritable bacterial symbionts [J].Annual Review of Genetics,2008,42:165-190.
Moran NA,Russell JA,Koga R,et al.Evolutionary relationships of three new species of Enterobacteriaceae living as symbionts of aphids and other insects[J].Applied and Environmental Microbiology,2005b,71(6):3302-3310.
Nyabuga FN,Outreman Y,Simon JC,et al.Effects of pea aphid secondary endosymbionts on aphid resistance and development of the aphid parasitoid Aphidius ervi:a correlative study[J].Entomologia Experimentalis et Applicata,2010,136(3):243-253.
Oliver K,Noge K,Huang E,et al.Parasitic wasp responses to symbiont-based defense in aphids [J].BMC Biology,2012,10(1):11.
Oliver KM,Campos J,Moran NA,et al. Population dynamics of defensive symbionts in aphids[J].Proceedings of the Royal Society B:Biological Sciences,2008,275(1632):293-299.
Oliver KM,Degnan PH,Burke GR,et al.Facultative symbionts in aphids and the horizontal transfer of ecologically important traits[J].Annual Review of Entomology,2010,55:247-266.
Oliver KM,Degnan PH,Hunter MS,et al.Bacteriophages encode factors required for protection in a symbiotic mutualism [J].Science,2009,325(5943):992-994.
Oliver KM, Moran NA, HunterMS. Costsand benefitsofa superinfection of facultative symbionts in aphids[J].Proceedings of the Royal Society B:Biological Sciences,2006,273(1591):1273-1280.
Oliver KM,Moran NA,Hunter MS.Variation in resistance to parasitism in aphids is due to symbionts not host genotype[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(36):12795-12800.
Oliver KM, Russell JA, Moran NA, et al. Facultative bacterial symbionts in aphids confer resistance to parasitic wasps[J].Proceedings of the National Academy of Sciences of the United States of America,2003,100(4):1803-1807.
Pan H,Li X,Ge D,et al.Factors affecting population dynamics of maternally transmitted endosymbionts in Bemisia tabaci[J].PLoS ONE,2012,7(2):e30760.
Rao Q,Wang S,Su YL,et al.Draft genome sequence of“Candidatus Hamiltonella defensa,”an endosymbiont of the whitefly Bemisia tabaci[J].Journal of Bacteriology,2012,194(13):3558.
Rosell RC,Blackmer JL,Czosnek H,et al.Mutualistic and dependent relationships with other organisms.In:Stansly PA,Naranjo SE eds.,Bemisia:Bionomics and Management of A Global Pest[M].NewYork:Springer Netherlands,2010,161-183.
Ruan YM,Xu J,Liu SS.Effects of antibiotics on fitness of the B biotype and a non-B biotype of the whitefly Bemisia tabaci[J].Entomologia Experimentalis et Applicata,2006,121(2):159-166.
Russell JA,Latorre A,Sabater-Muñoz B,et al.Side-stepping secondary symbionts:widespread horizontal transfer across and beyond the Aphidoidea[J].Molecular Ecology,2003,12(4):1061-1075.
Russell JA,Moran NA.Costs and benefits of symbiont infection in aphids:variation among symbionts and across temperatures[J].Proceedings of the Royal Society B:Biological Sciences,2006,273(1586):603-610.
Russell JA,Moran NA.Horizontal transfer of bacterial symbionts:heritability and fitness effects in a novel aphid host[J].Applied and Environmental Microbiology,2005,71(12):7987-7994.
Sandstrom J,Pettersson J.Amino-acid-composition of phloem sap and the relation to intraspecific variation in pea aphid(Acyrthosiphon pisum)performance[J].Journal of Insect Physiology,1994,40(11):947-955.
Sandstrom JP,Russell JA,White JP,et al.Independent origins and horizontal transfer of bacterial symbionts of aphids[J].Molecular Ecology,2001,10(1):217-228.
Simon J-C,Carré S,Boutin M,et al.Host-based divergence in populations of the pea aphid:insights from nuclear markers and the prevalence of facultative symbionts[J].Proceedings of the Royal Society of London. Series B:Biological Sciences,2003, 270(1525):1703-1712.
Skaljac M,Zanic K,Ban SG,et al.Co-infection and localization of secondary symbionts in two whitefly species [J]. BMC Microbiology,2010,10:142.
Su Q, Pan H, Liu B,et al. Insect symbiont facilitates vector acquisition,retention,and transmission of plant virus [J].Scientific Report,2013,3.
Szklarzewicz T,Moskal A.Ultrastructure,distribution,and transmission of endosymbiontsin the whitefly Aleurochiton acerisModeer(Insecta,Hemiptera,Aleyrodinea)[J].Protoplasma,2001,218(1-2):45-53.
Telesnicki MC,Ghersa CM,Martinez-Ghersa MA,et al.Molecular identification of the secondary endosymbiont Hamiltonella defensa in the rose-grain aphid Metopolophium dirhodum [J].Revista Argentina de Microbiologia,2012,44(4):255-258.
Tsuchida T,Koga R,Shibao H,et al.Diversity and geographic distribution of secondary endosymbiotic bacteria in natural populations of the pea aphid,Acyrthosiphon pisum[J].Molecular Ecology,2002,11(10):2123-2135.
Vorburger C,Gouskov A.Only helpful when required:a longevity cost of harbouring defensive symbionts[J].Journal of Evolutionary Biology,2011,24(7):1611-1617.
Vorburger C,Sandrock C,Gouskov A,et al.Genotypic variation and the role of defensive endosymbionts in an all-parthenogenetic host-parasitoid interaction [J].Evolution,2009,63(6):1439-1450.
Weldon SR,Strand MR,Oliver KM.Phage loss and the breakdown of a defensive symbiosis in aphids[J].Proceedings of the Royal Society B:Biological Sciences,2013,280(1751):237-243.

