经皮肝穿刺胆道内射频消融处理恶性胆道梗阻的应用
杨 超, 卢 伟
恶性胆道梗阻是由胆管癌、胰头癌、肝癌等恶性肿瘤所导致的胆汁引流不畅所致的恶性黄疸。解除胆道梗阻、通畅胆道引流、减轻黄疸是姑息性治疗恶性胆道梗阻的关键,由于肝胆胰区的解剖特点和肿瘤的生物学特性,手术根治性切除率极低。目前治疗恶性胆道梗阻主要的方法有外科手术、介入治疗和内镜下治疗。有效地解除胆道梗阻是消除黄疸并提高患者生活质量的重要治疗手段。目前解除恶性胆道梗阻的方法主要包括经外科引流术、经皮经肝胆管引流术及内镜下胆管引流术和介入治疗。外科引流术的手术风险大,手术病死率高,尤其是进展期疾病或肝门区病变,其手术难度大;成功率低,并发症发生率高[1]。
目前大量临床研究证实,经皮经肝穿刺途径或经内镜途径行支架植入术是处理恶性胆道梗阻的最佳治疗手段[2],自扩式金属支架(SEMS)植入已被证实是治疗不可切除恶性胆道梗阻的有效方法[3-4]。但是,由于肿瘤生长挤压支架、胆道上皮过度增生以及支架内沉积物的影响,支架内堵塞的发生率较高,使得 SEMS中位通畅时间仅为 120 d[5]。HabibTMEndoHPB是一种新型双极射频导管,它采用经皮经肝穿刺路径在胆道内消融部分肿瘤,也可以疏通已堵塞的胆道内金属支架,从而达到治疗恶性胆道梗阻的作用。
1 HabibTM EndoHPB胆道内射频消融(RFA)的适应证及术前准备
胆道内RFA不仅可以消融胆道内肿瘤,还可以疏通已经发生堵塞的金属胆道支架,从而重建胆汁引流通道,达到迅速退黄、改善肝功能、延长患者生存时间的作用。经内镜实施胆道内RFA已有较多报道,其安全性及可行性已得到了实验证实[4,6-7],但对于治疗高位胆道梗阻成功率低,且经内镜途径植入的是塑料支架,不利于支架再堵塞后的RFA治疗。所以,经内镜途径治疗失败的患者均可尝试经皮经肝穿刺途径胆道内RFA。
术前检查血常规、生化全套、肝功能、凝血功能、肿瘤标记物等,以明确患者肝功能、凝血功能及电解质情况。行腹部增强CT或MRI以及腹部超声检查,明确胆道梗阻部位及程度。Pai等[8]在消融手术前先经皮经肝穿刺胆道成功后置入内外引流管进行胆道减压,这对于改善术前患者肝功能、提高手术成功率有一定帮助。术前建立静脉输液通道、心电监护,术前和患者充分沟通交流,缓解患者紧张情绪。
2 HabibTM EndoHPB胆道内RFA的治疗设备及流程
2.1 治疗设备
经皮穿刺式双极射频导管:HabibTMEndoHPB(英国EMcisio公司),为双电极、直径8 F、工作长度90 cm的一次性使用的导管,导管头端拥有两个电极(电极均宽8mm,电极间距8mm,远端电极距导管头端5mm),其消融长度超过25mm(图1)。自扩式金属胆道支架 (SEMS),经皮经肝胆道穿刺引流(PTCD)套装,DSA等。
2.2 治疗过程
同PTCD操作,患者取平卧位,常规消毒右季肋区,2%利多卡因局麻后,常规经皮经肝穿刺胆道成功后,行胆道造影,在DSA透视下明确胆道梗阻或狭窄部位、范围及程度,利用超滑导丝通过胆道梗阻或狭窄段并进入十二指肠内,形成通路后引入经皮穿刺式双极射频导管,准确定位后,对狭窄部位组织进行加热和消融,功率5~10 W,消融时间60~120 s[6,8-13],消融完成后再次行胆道造影证实胆道恢复通畅。消融术后可以在梗阻段胆道内放置SEMS以提高通畅程度并延长胆道通畅时间[9]。对于胆道内金属支架植入后再梗阻或狭窄者,在消融完成后退出双极射频导管,然后用球囊扩张支架,再用半充气的球囊轻柔地来回抽送,将消融的组织碎片从金属支架上清除下来,最后再次行胆道造影证实支架通畅,并冲洗消融的组织碎片、评估胆道充盈情况[8]。
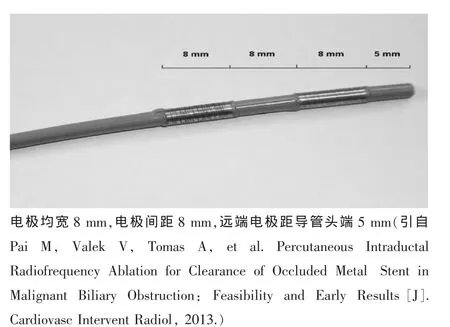
图1 电极实物图
3 HabibTM EndoHPB胆道内RFA的临床疗效评价
3.1 HabibTM EndoHPB胆道内RFA治疗胆道恶性梗阻的疗效评价
经皮经肝穿刺胆道内RFA对于改善由于恶性肿瘤所导致的胆道梗阻效果明显,能迅速改善黄疸症状、肝功能,延长患者生存时间,同时也提高了患者的生活质量,这已经被多项前瞻性临床研究所证实。Mizandari等[9]的研究中,39例恶性胆道梗阻患者手术前后各测量值:狭窄或梗阻段平均长度为(3.39±1.06)cm;狭窄或梗阻段直径中位数为1 mm(0~2mm);消融中位时间2min(2~20min);消融功率中位数为10W(8~15W);狭窄或梗阻段消融后直径中位数7mm(3~10 mm);术前胆红素平均值为(129±61)μmol/L;术后胆红素平均值为(52± 32)μmol/L;住院日中位数为5 d(3~7 d)[10]。
在上述39例患者中,经胆道内消融治疗后未发生院内死亡或30 d内死亡事件,观察到的并发症为术后疼痛 (15例,38.5%),但常规止痛药即可控制,未出现大出血、胆道穿孔、胆漏或胰腺炎等。在随访时间内,28例患者生存、10例死亡。10例死亡患者中,其中位生存时间为89.5 d,支架通畅中位时间为84.5 d;28例生存患者中,其支架通畅中位时间为92 d。国内也有报道,证实该技术安全可行,患者获益良多[12-13]。
3.2 HabibTM EndoHPB胆道内RFA治疗胆道金属支架梗阻的疗效评价
该技术亦可用于疏通发生再堵塞的胆道SEMS,Pai等[8]对此进行了前瞻性临床研究。9例胆道支架再堵塞的患者均在术前先行内外引流管引流胆汁,胆道减压后用Habib双极射频导管在支架内部进行肿瘤的RFA治疗。手术前后各测量值:狭窄或堵塞段平均长度为(5.2±1.6)cm;狭窄或堵塞段直径中位数为1.6mm(0~4mm);消融中位时间6 min(2~20 min);消融功率中位数为10W(10~ 20W);狭窄或梗阻段消融后直径中位数8mm(3~ 10mm);术前胆红素平均值为(109±43)μmol/L;术后胆红素平均值为(60±27)μmol/L;住院日中位数为4 d(2~6 d)[8]。
上述所有9例患者术后其胆道支架均疏通,胆汁引流良好。30 d内无死亡事件发生,未出现大出血、胆道穿孔、胆漏等并发症。在随访时间内,6例患者生存、3例患者死亡,平均随访时间为122 d(50~ 488 d),支架通畅中位时间为102.5 d(50~321 d)。其中6例患者在随访结束后去世时仍保持支架通畅,3例患者的支架分别在术后 321 d、290 d和65 d时出现再堵塞并在此进行了支架内RFA术治疗[8]。席玮等[12]和Lui等[14]也进行了该项研究,同样证实该方法安全有效和经济可行。
4 HabibTM EndoHPB胆道内RFA的并发症
该方法理论上可能导致的并发症包括疼痛、出血、胆道穿孔、胆漏、胆道感染、胰腺炎等。近期文献资料显示,仅疼痛、术后低热见诸于报道[9,13],其余可能的并发症均未提及。Mizandari等[9]报道,39例恶性胆道梗阻的患者实施了经皮经肝穿刺胆道内RFA,观察到的并发症为术后疼痛(15例,38.5%),但常规止痛药即可控制。成熟的经皮经肝穿胆道刺技术及双极射频导管的准确定位是提高手术成功率的关键保障,同时要熟练掌握相关射频发生仪器和设备的操作。
5 HabibTM EndoHPB胆道内RFA的总体评价及前景
RFA治疗实体肿瘤已经有较长时间,它通过射频产生的热能对肿瘤病灶进行消融。目前为止,因为考虑到胆漏、胆道狭窄等可能的并发症,胆道内RFA治疗并未受到关注[15]。胆道内RFA可以疏通狭窄或梗阻胆道、减轻肿瘤负荷并控制肿瘤快速进展,同时可以延长胆道内金属支架的通畅时间[6-7];大部分恶性胆道梗阻患者确诊后即为晚期,利用该法可以重建胆汁引流通道,延长患者生存时间、提高生存质量。有相关文献资料报道经内镜途径胆道内RFA已取得较好的疗效[4,6-7],经皮经肝穿刺胆道内RFA与经内镜胆道内RFA相比较,患者配合度高,可以处理高位胆道梗阻,并可以在超声引导下进行穿刺,相对于内镜下乳头肌切开较为安全。
SEMS是预期寿命超过3个月的不可切除恶性胆道梗阻治疗的标准方案,但由于肿瘤生长、支架内沉积物等因素,使得SEMS中位通畅时间仅为120 d。目前为了解决支架堵塞问题,提出了覆膜支架、光动力治疗等手段,但均不能明显延长支架通畅时间[16]。支架堵塞导致的胆道梗阻与患者病死率明显相关[17-19],所以,如何延长支架通畅时间是亟待解决的问题。近期的研究表明,使用覆膜SEMS可以获得较SEMS更长的通畅时间,但不能明显提高患者生存时间[20]。支架再堵塞后目前常用的处理方式为在第1枚支架内再次放置第2枚支架以疏通胆汁引流通道,但此方法效果不佳、费用较高。所以,使用经皮经肝穿刺胆道内RFA方法对于延长支架通畅时间以及患者生存时间有较高的医疗价值。胆道内RFA后可以立即放置SEMS,以防止热损伤后可能出现的胆道再狭窄[9];当SEMS发生再堵塞时亦可重复本术并联合球囊疏通堵塞支架进行治疗。
6 存在问题
作为新开展的治疗技术,经皮肝穿刺胆道内RFA治疗恶性胆道梗阻其医疗价值尚未被充分证实。国际上已有少数医疗机构进行了前瞻性的临床研究,国内此技术的相关报道则很少。在实体肿瘤的治疗中,RFA可产生100℃以上的高温使肿瘤组织坏死完全,这无论从动物实验及临床应用实际效果中均已得到充分的论证。而胆道消融导管在工作时,当导管周围阻抗比基线值升高50%时,RFA发生器会自动停止工作,使导管消融最高温度限制在60℃,这在一定程度上降低了胆道穿孔、出血等并发症的发生率。Zacharoulis等[21]在健康动物实验中证实了该技术的安全可靠性。但在5~10W功率的条件下,在短暂的数分钟内对于肿瘤组织、胆道内皮细胞及毛细胆管的异常增生能否消融完全而不损伤胆道造成穿孔、胆道或肝实质出血等严重并发症,仍需进一步研究论证。对于胆道支架植入术后再堵塞的疏通处理,临床只有数例报道,由于双极导管在支架内消融时,金属电极很容易碰到金属支架而产生“断电现象”,导致消融导管停止工作,所以在操作过程中很难控制这一现象,不能确保足够的消融时间从而达到完全疏通堵塞胆道的目的[22]。这是目前双极消融导管支架内消融的较大缺点,如能得到改进,则有望在临床上得以长期有效的使用。进行胆道内射频消融时,射频导管产生的热量会通过胆汁传递,因此消融产生的热量对正常胆管内皮细胞、毛细胆管及消融部位周围正常肝组织的损伤也有待研究。同时,消融后肿瘤组织坏死和凋亡的情况亦不明确。目前此技术的初步研究结果证实了其处理恶性胆道梗阻的安全、有效及可行性,但仍需大规模临床随机研究进行观察总结。
[1] Singhal D,van Gulik TM,Gouma DJ.Palliativemanagement of hilar cholangiocarcinoma[J].Surg Oncol,2005,14:59-74.
[2] Castano R,Lopes TL,Alvarez O,et al.Nitinol biliary stent versus surgery for palliation of distal malignant biliary obstruction[J].Surg Endosc,2010,24:2092-2098.
[3] Itoi T,Sofuni A,Itokawa F,et al.Current status and issues regarding biliary stenting in unresectable biliary obstruction[J].Dig Endosc,2013,25:63-70.
[4] Isayama H,Nakai Y,Kogure H,et al.Biliary self-expandable metallic stent for unresectable malignant distal biliary obstruction:which is better:covered or uncovered?[J].Dig Endosc,2013,25:71-74.
[5] Loew BJ, Howell DA, Sanders MK,et al.Comparative performance of uncoated,self-expanding metal biliary stents of different designs in 2 diameters:final results of an international multicenter, randomized, controlled trial [J].Gastrointest Endosc,2009,70:445-453.
[6] Dolak W,Schreiber F,Schwaighofer H,et al.Endoscopic radiofrequency ablation for malignant biliary obstruction:a nationwide retrospective study of 84 consecutive applications[J].Surg Endosc,2014,28:854-860.
[7] Steel AW,Postgate AJ,Khorsandi S,et al.Endoscopically applied radiofrequency ablation appears to be safe in the treatment of malignant biliary obstruction [J].Gastrointest Endosc,2011,73:149-153.
[8] Pai M,Valek V,Tomas A,et al.Percutaneous intraductal radiofrequency ablation for clearance of occluded metal stent in malignant biliary obstruction:feasibility and early results[J].Cardiovasc Intervent Radiol,2014,37:235-240.
[9] Mizandari M,Pai M,Xi F,et al.Percutaneous intraductal radiofrequency ablation is a safe treatment for malignant biliary obstruction:feasibility and early results[J].Cardiovasc Intervent Radiol,2013,36:814-819.
[10]Mao EJ,Watson JB,Soares G,et al.Successful Percutaneous Endobiliary Radiofrequency Ablation for Unresectable Malignant Biliary Obstruction:A Case Report and Review of the Literature[J].JGastrointest Cancer,2013,[Epub ahead of print].
[11]Mukund A,Arora A,Rajesh S,et al.Endobiliary radiofrequency ablation for reopening of occluded biliary stents:a promising technique[J].JVasc Interv Radiol,2013,24:142-144.
[12]席 玮,陈 骏,武 贝,等.经皮经肝双极射频导管处理恶性胆道梗阻及胆道内支架再堵塞的初步临床观察[J].中华医学杂志,2013,93:698-700.
[13]何国林,徐小平,周陈杰,等.一种恶性梗阻性黄疸介入治疗的新方法-经皮肝穿刺胆道内射频消融内支架置入术 [J].南方医科大学学报,2011,31:721-723.
[14]Lui KL,Li KK.Intraductal radiofrequency ablation of tumour ingrowth into an uncovered metal stent used for inoperable cholangiocarcinoma[J].Hong Kong Med J,2013,19:539-541.
[15]Livraghi T,Solbiati L,MeloniMF,etal.Treatment of focal liver tumors with percutaneous radio - frequency ablation:complications encountered in amulticenter study[J].Radiology,2003,226:441-451.
[16]Ballinger AB,Mchugh M,Catnach SM,et al.Symptom relief and quality of Life after stenting for malignant bile duct obstruction[J].Gut,1994,35:467-470.
[17]Siddiqui AA,Mehendiratta V,Loren D,et al.Fully covered self-expandablemetal stents are effective and safe to treat distal malignant biliary strictures,irrespective of surgical resectability status[J].JClin Gastroenterol,2011,45:824-827.
[18]Ridtitid W,Rerknimitr R,Janchai A,et al.Outcome of second interventions for occluded metallic stents in patients with malignant biliary obstruction[J].Surg Endosc,2010,24:2216-2220.
[19]Kitano M,Yamashita Y,Tanaka K,et al.Covered selfexpandable metal stents with an anti-migration system improve patency duration without increased complications compared with uncovered stents for distal biliary obstruction caused by pancreatic carcinoma:a randomized multicenter trial[J].Am J Gastroenterol,2013,108:1713-1722.
[20]Isayama H,Komatsu Y,Tsujino T,et al.A prospective randomised study of “covered”versus “uncovered”diamond stents for the management of distalmalignant biliary obstruction[J].Gut,2004,53:729-734.
[21]Zacharoulis D,Lazoura O,Sioka E,et al.Habib EndoHPB:a novel endobiliary radiofrequency ablation device. An experimental study[J].JInvest Surg,2013,26:6-10.
[22] 夏 宁,程永德,王忠敏.胆道支架再狭窄的介入治疗进展[J].介入放射学杂志,2014,23:82-85.

