温度、盐度和pH对小球藻生长率的联合效应
刘加慧 杨洪帅 王 辉(广东海洋大学水产学院, 湛江 524088)
温度、盐度和pH对小球藻生长率的联合效应
刘加慧 杨洪帅 王 辉(广东海洋大学水产学院, 湛江 524088)
采用中心复合设计(CCD)研究了温度(16—34 ℃)、盐度[(15—45)‰]和pH(6.0—9.0)对小球藻(Chlorella sp. CHX-1)生长的联合效应。结果表明, 温度、盐度与pH的一次、二次效应都对小球藻比生长速率有极显著影响(P<0.01); 温度与盐度间、温度与pH间的互作效应对小球藻比生长速率影响显著(P<0.05), 而盐度与pH间的互作效应影响不显著(P>0.05); 三因子影响度大小依次为: 温度>pH>盐度。采用响应曲面法建立了温度、盐度和pH对小球藻比生长速率影响的模型方程, 该模型的决定系数0.9759, 矫正决定系数0.9542, 说明模型的拟合度极高; 模型的预测决定系数0.8367, 表明可用于预测小球藻比生长速率的变化。通过模型优化和验证试验, 得出在温度、盐度和pH组合为26.7 ℃/25.5‰/7.3时, 小球藻比生长速率达到最大值0.69, 满意度为0.999。本试验结果可为小球藻生产提供理论指导。
小球藻; 温度; 盐度; pH; 生长; 响应曲面法
小球藻(Chlorella)是一种常见的单细胞绿藻,广泛分布于各种水体。小球藻富含藻多糖、脂肪酸、糖蛋白和维生素等营养成分, 可以作为全营养食品提供给人类, 有较好的药理和保健作用[1,2], 是培育轮虫和贝类等的重要饵料[3,4], 也是去除污水 N、P等物质效率最高的藻类之一[5,6]。此外小球藻还可用于生产生物柴油[7—9]。
为了更充分的利用小球藻, 首先要提高小球藻的生产力。藻类生长与藻本身的生理特点以及诸多环境因素有关, 其中水体温度、盐度和pH是影响藻类生长的重要环境因子。关于环境因子对小球藻生长的影响国内外已有许多报道, 如杨桂娟等[10]研究了温度对小球藻生长和溶氧量的影响, 表明在 25℃时, 小球藻生长速度与溶氧量的增长速度达到最大。杜宇等[11]报道了小球藻在低盐环境中有较快的生长速度。Rai, et al.[12]发现酸性pH会抑制营养物NO3+、NH4+的吸收和硝酸还原酶活性进而影响其生长。赵娜等[13]研究了不同pH条件下Cr6+对小球藻生长的毒性效应, 发现Cr6+在藻的最适生长pH条件下毒性最小。张桂艳等[14,15]研究了不同理化因子对小球藻生长速率、生物量和油脂产量的影响, 发现温度、盐度和 pH的影响表现为在适宜生长的条件下油脂含量提高。De-Bashan, et al.[16]研究发现氮的吸收取决于小球藻的生长情况。这些研究都说明研究适宜小球藻生长的环境因子是很有必要的。但以上研究仅局限于单因子的研究, 不能考察影响因子之间的互作或协同效应, 也没有建立起可用于预测的模型。本研究采用中心复合设计和响应曲面分析法,拟研究温度、盐度和 pH对小球藻生长的联合效应,考察温度、盐度和pH的一次、二次效应及互作效应,建立相应的回归模型, 并通过模型优化找到最优因子组合, 为其进一步的生产培养提供理论依据。
1 材料与方法
1.1 试验材料及培养方法
试验用小球藻: 采用广东海洋大学藻种室提供的小球藻(Chlorella sp. CHX-1)。小球藻保种于 f/2液体培养基, 4℃冰箱。
培养方法: 小球藻经长时间保存其活力会下降,故正式试验前应先进行活化培养。先将小球藻接种于f/2培养基培养4d进行活化。每天摇瓶5—6次, 防止藻细胞下沉或附壁。培养温度25 , ℃ 光照40 μmol/ (m2·s), 光暗比 12h∶12h。将进入对数期的藻种离心、洗净后接入装有50 mL f/2培养液[17]的100 mL锥形瓶, 使初始OD值在0.1—0.2。置于GZX-150C光照培养箱内在不同温度下进行一次性培养(控温精度0.1 ), ℃ 中间不更换培养液。用NaCl调节藻液盐度, 1 mol/L的NaOH和1 mol/L的HCl调节藻液pH, 并每隔4h监测一次水体pH变化, 用Tris-HCl缓冲液校正, 以保证试验过程中 pH变化不超过±0.2。每天摇动锥形瓶两次(09:00和17:00), 随机调换锥形瓶的位置使受光均匀。藻种接种及培养过程中, 均严格遵循无菌操作。
1.2 试验设计
采用中心复合法试验设计(Central composite design, CCD)研究温度、盐度和pH对小球藻生长的联合效应。根据预试验的结果, 本试验中温度范围为16—34 , ℃ 盐度范围为(15—45)‰, pH范围为6.0—9.0。温度(T)、盐度(S)和pH在上述范围内各取5个水平, 各因子水平的编码值分别是–1.68179、–1、0、1、1.68179。整个试验共计20个温度、盐度和pH三因子交叉组合(表1), 其中因子点数为8个, 轴点数6个, 星号臂α= ±1.68179, 中心点数为6。每个因子点和轴点组合重复3次(表1)。为消除系统误差, 所有因子组合均随机安排。
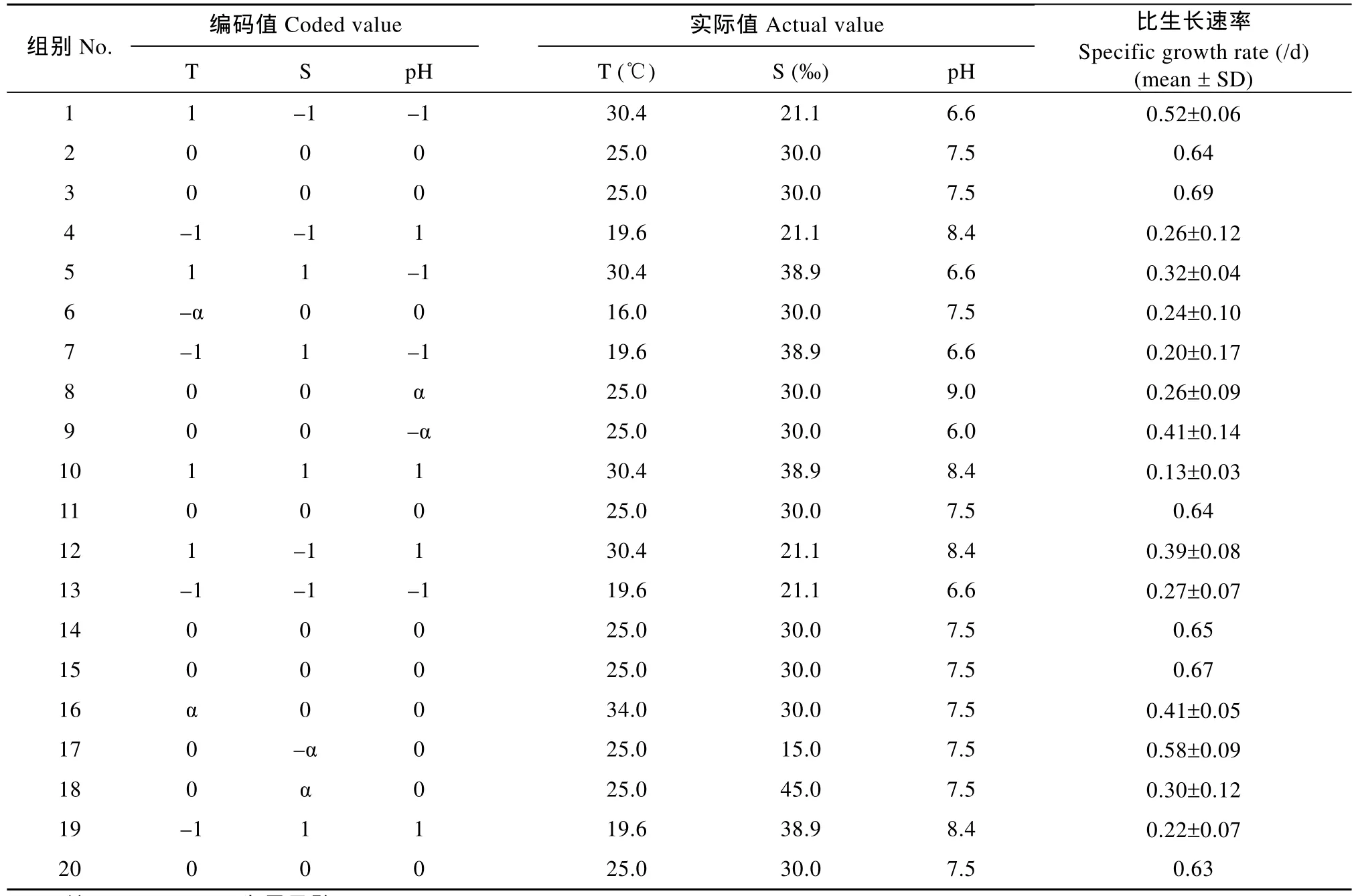
表1 试验设计与相应结果Tab. 1 Experimental design and results
1.3 生长测定
取小球藻藻液, 用分光光度计测其在680 nm下的光密度值(OD680)[18,19], 以光密度值代表藻的生长情况。每天定时取样测定, 每组设3个重复。接种后1—5d, 藻液OD值快速增长, 第6天, 增长速率明显减缓, 6d以后OD值变化很小。所以, 用培养前6d的平均生长速率表示各种培养条件下的小球藻的比生长速率。比生长速率(Specific growth rate, SGR)根据普通生物学通用的计算公式[14]计算得到:
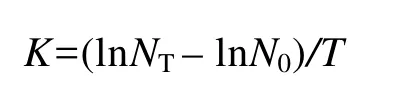
其中, K表示小球藻比生长速率; NT为时间T的OD值; N0是初始时的OD值; T为培养时间, 试验期T为6d。
1.4 数据处理
以温度、盐度和pH三因子为自变量, 小球藻比生长速率为因变量, 建立小球藻比生长速率和温度、盐度、pH之间的回归方程模型为:
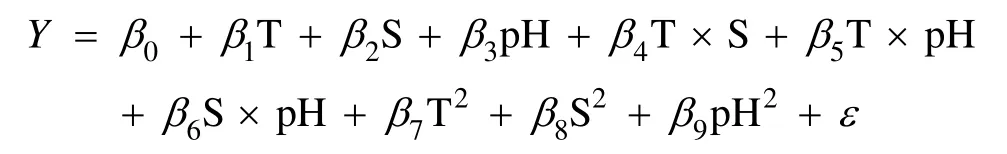
式中, Y为响应变量(小球藻比生长速率); β0为常数; β1、β2、β3分别代表温度、盐度和pH的一次效应; β3、β4、β5分别代表温度与盐度间、温度与pH间、盐度与pH间的互作效应; β6、β7、β8分别代表温度、盐度和pH的二次效应; ε为残差, 并假定其服从均值为0的正态分布。采用ANOVA方法检验模型的显著性, 并给出几种决定系数以辅助确定模型的拟合优度。采用SAS (v9.13)软件中的 RSM 模块对数据进行统计分析, 模型中的各项效应采用最小二乘法进行估计并采用F统计量进行显著性检验。各因子对生长的影响可通过等高线图展示。显著水平设定为0.05。
2 结果
对应于各个温度、盐度和pH组合的生长结果如表1所示。由于每个因子点与轴点重复了3次, 故给出了生长数据的标准差; 而为进行模型的失拟检验及估计、降低纯误差, 本研究设置中心点次数为6,无需再设重复组, 因此没有给出标准差。从结果看,由于试验中采取了严格控制因子波动范围的措施,数据的精度较高。
2.1 模型检验
通过对模型进行方差分析(表2)可见, 方程模型极显著(P<0.01), 失拟检验结果显著(P<0.05), 可能是极小的纯误差造成的, 而非模型不恰当。
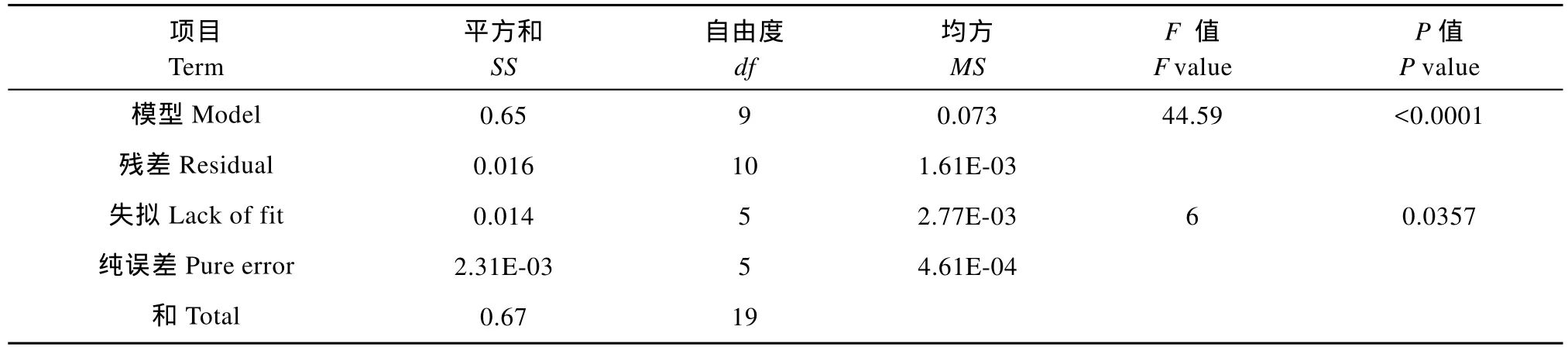
表2 模型充分性的方差分析Tab. 2 Analysis of variance for the adequacy of the model
2.2 模型建立
对系数进行显著性检验结果表明(表3), 温度、盐度与pH的一次效应、二次效应对小球藻比生长速率影响极显著(P<0.01), 温度与盐度、pH中任意一因子间的互作效应对小球藻比生长速率影响显著(P<0.05), 盐度与 pH间的互作效应对小球藻比生长速率影响不显著(P>0.05)。由于表3中的系数估计值都是以编码值的形式给出, 故可以直接比较各因子效应的大小。由表3可见, 温度、盐度与pH对小球藻比生长速率的影响度大小依次为: 温度>pH>盐度。
对试验数据进行二次多元回归拟合, 根据试验得出的小球藻比生长速率与温度、盐度和pH之间的(即非编码)回归方程为:

该模型决定系数 R2为 0.9759, 矫正决定系数Adj.R2为0.9542, 预测决定系数Pred.R2为0.8367。由于本研究采用的试验设计具有正交性, 因而上述模型方程中那些不显著的项可直接剔除而不必重新估计各项系数。
2.3 响应曲面分析
从图1、图2、图3可以看出, 当保持温度、盐度和 pH三个因子中的任何一个因子为最佳条件不变时, 随着其他两个因子的升高, 小球藻的比生长速率均呈先上升后下降的趋势。图1、图2和图3的等高线图清晰的显示了随着这三个因子变化, 小球藻的比生长速率存在最佳范围。
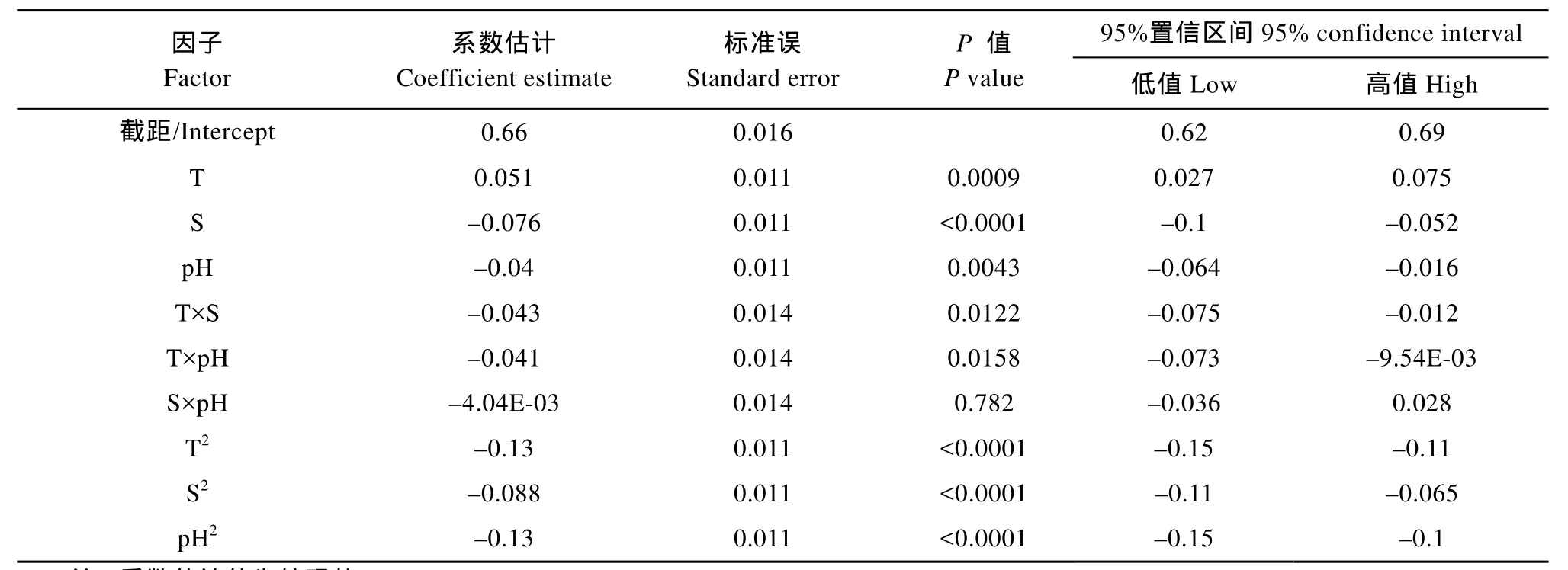
表3 回归方程系数及95%置信区间估计Tab. 3 Coefficient estimate and 95% confidence intervals
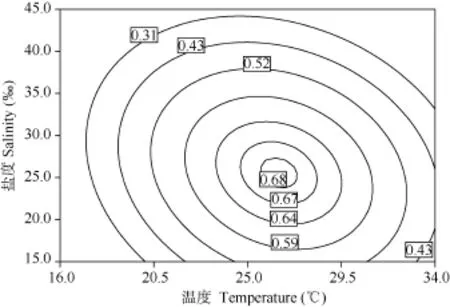
图1 温度和盐度对小球藻比生长速率影响的等高线图Fig. 1 Contour plot of the combination effects of temperature and salinity on the growth rate of Chlorella sp. CHX-1
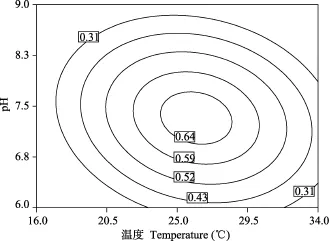
图2 温度和pH对小球藻比生长速率影响的等高线图Fig. 2 Contour plot of the combination effects of temperature and pH on the growth rate of Chlorella sp. CHX-1
2.4 优化
本研究中得到的模型方程有很高的拟合度和预测能力, 根据Montgomery, et al.[20]的方法对小球藻比生长速率的模型方程进行优化。结果显示, 温度、盐度和pH的最优组合为26.7 /25.5℃ ‰/7.3, 此时小球藻的比生长速率达到最大值 0.69, 满意度为0.999。为了进一步验证响应曲面优化条件的可靠性,按所得最优条件进行验证试验, 所得比生长速率为0.70, 与理论预测值基本相符, 说明模型优化条件合理有效。
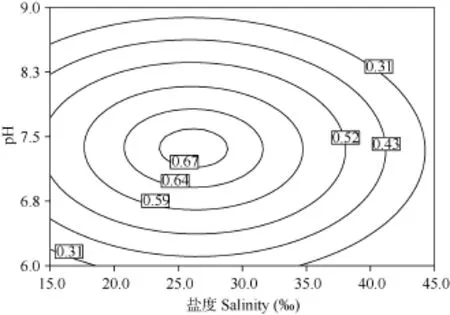
图3 盐度和pH对小球藻比生长速率影响的等高线图Fig. 3 Contour plot of the combination effects of salinity and pH on the growth rate of Chlorella sp. CHX-1
3 讨论
3.1 温度对小球藻生长的影响
温度通过影响藻类光合作用与呼吸作用强度来影响其生长发育, 对经济微藻的生长速率及生化组成造成显著影响[21—23], 是影响藻类生长发育的重要环境因素。本试验研究结果显示, 温度的一次效应对小球藻比生长速率影响极显著(P<0.01), 温度的效应大于盐度、pH的效应, 与一些学者的研究发现[24,25]相一致。等高线图(图1和图2)显示, 在16—25℃温度范围内小球藻比生长速率呈上升趋势, 在29.5—34℃内呈下降趋势。与杨桂娟等[10]和吴松[26]提出的适宜温度范围一致。在一定温度范围内, 温度较低时,细胞膜的运输和呼吸代谢功能会受到影响,致使延迟期增加。但随着温度升高, 酶活性增强, 生长速率加快[27]。只有在适宜温度范围内, 藻类才会生长最快。有学者[14]证实在 15—35℃温度范围内,小球藻的比生长速率呈先上升后下降的趋势。
3.2 盐度对小球藻生长的影响
盐度主要是调节微藻细胞胞内外的渗透压, 影响微藻光合速率、叶绿素含量和一些代谢活动[28]。本试验研究结果显示, 盐度的一次效应对小球藻比生长速率影响极显著(P<0.01), 与Cho, et al.[24]的研究结果相符。等高线图(图1和图3)显示, 在(15—30)‰的盐度范围内小球藻比生长速率呈上升趋势, 在(30—45)‰内呈下降趋势。金伟[29]指出盐度对单细胞藻生长的影响呈抛物线型, 盐度过高或过低都不利于藻的生长, 这与图1和图3中的趋势相似。江灵芝等[30]研究发现蛋白核小球藻(Chlorella pyrenoidosa)在(15—45)‰盐度范围均可以正常生长, 以及韩志国等[31]报道小球藻(Chlorella minutissima)在盐度15‰开始出现较典型的生长曲线, 在(20—50)‰盐度范围内均呈现典型的生长曲线, 与本试验得出的盐度范围一致。
3.3 pH对小球藻生长的影响
pH值能改变微藻体内相关酶的结构状态和活性、培养液中碳源的存在形式以及各种金属复合物的溶解度, 从而影响微藻生长及脂肪酸的含量[12—15]。本试验结果显示, pH的一次效应对小球藻比生长速率影响极显著(P<0.01), 等高线图(图2和图3)显示, pH为6.0—7.5时小球藻比生长速率呈上升趋势, 7.5—9.0时呈下降趋势, 与赵娜等[13]研究结果相符。在生长过程中, 小球藻会因自身生理代谢活动调节生活环境的pH[19,32], 小球藻喜欢弱碱性(pH7.2—8.2), 但在弱酸性(pH5.8—6.8)的水中也能生活和繁殖[33]。吴松[26]报道小球藻适宜生长的酸碱度为pH6—8左右, Matusiak, et al.[34]报道小球藻适宜生长的pH为7.0—8.0, 与本试验结果相似。
3.4 温度、盐度和pH对小球藻生长的互作效应
以往的研究多集中于单因子[13—15]对小球藻生长的独立影响, 因而这些研究不能考察多因子间的互作影响, 还有一些采用正交实验[24,25]。当因子之间存在互作效应时, 对该交互作用的分析比单独分析因素的主效应重要得多[20]。目前仅见Cho, et al.[24]采用双因素方差分析法, 得出温度和盐度的互作效应对小球藻比生长速率影响极显著。本试验采用复合设计, 对温度、盐度、pH的互作效应进行显著性检验。结果表明, 温度与盐度的互作效应以及温度与 pH的互作效应对小球藻比生长速率影响显著(P<0.05)。原因可能是温度升高或降低均会影响小球藻体内酶的活性, 而此变化会影响小球藻渗透压调节和酸碱平衡。但实验结果中盐度与 pH的互作效应对小球藻的比生长速率影响不显著(P>0.05), 造成此结果的原因可能是, 渗透压和酸碱平衡的调节是两个独立的过程, 不存在关联。
3.5 优化
本研究表明, 温度、盐度和pH的二次效应对小球藻的比生长速率影响均极显著(P<0.01), 温度、盐度、pH与小球藻比生长速率之间呈曲线关系。从图1、图2和图3可见, 小球藻的生长存在峰值, 即当温度、盐度和pH组合不恰当时, 小球藻生长量会降低。从实际生产看, 确定温度、盐度、pH的最优组合对提高小球藻产量具有现实意义。以上引用文献均未发现温度、盐度及 pH的二次效应。本试验是基于可靠模型, 根据Montgomery, et al.[20]的方法对模型方程进行优化, 结果显示, 当温度、盐度和 pH的组合为 26.7 /25.5℃ ‰/7.3时, 小球藻的比生长速率达到最大值0.69, 满意度高达0.999。本试验的研究结果是基于可靠的模型, 而以前的研究均未建立起可靠的模型, 故本试验结果更可靠, 且与杨桂娟等[10]、吴松[26]报道的最适温度, 韩志国[31]、Sultana, et al.[35]报道的最适盐度以及王子敬[36]等报道的最适pH接近。Mayo, et al.[37]使用混合培养基培育普通小球藻的最适温度值(32.4℃), Ertit, et al.[38]报道的 pH(8.0), 与本试验结果相差很大。有资料证实藻种[23]、培养基[14,21]、光照强度及光暗周期[18,25]等都会影响藻的生长。所以很可能是藻株、培养基等生长体系和培养环境的不同造成了最适温度、盐度和pH的不同。
3.6 模型的建立及其意义
响应曲面法是通过响应曲面分析得到拟合度较高的模型方程, 并通过模型对试验指标进行可靠的预测[20]。然而国内外关于环境因子对藻类生长影响的研究, 大多采用单因子[13—15,23]或正交实验设计方法[24,25]。只针对环境因子的几个孤立的水平点进行分析, 极少数地建立了单因子线性回归方程[24],但无法对小球藻比生长速率进行连续预测。本研究首次建立了二次多元曲线回归模型, 回归方程的决定系数R2高达0.9759, 表明模型的拟合度很高。Cho, et al.[24]建立的小球藻生长模型相关系数R2≤0.97,显然本模型拟合度更高。模型失拟检验结果显著(P<0.05), 可能是极小的纯误差造成的(表2), 而非模型不恰当。然上述研究者的模型方程都没有进行失拟检验, 无法判定其恰当性。更重要的是, 本研究中还给出了模型的预测能力, 预测R2为0.8367, 表明能可靠预测到不同温度、盐度和pH条件下小球藻的比生长速率。其他的模型方程均没有给出此值,因而无法确定其预测能力。
本试验建立了温度、盐度和 pH对小球藻比生长速率影响的模型, 得出了温度、盐度和pH最优组合, 为小球藻的培养生产提供了理论基础。藻的生长离不开光照和氮、磷等营养元素, 在一般情况下,光照强度和培养基中的不同营养盐及其浓度都对小球藻的生长有明显影响, 然本试验并未考虑, 优化小球藻生长条件还需要进一步探讨。
[1] Chen Y, Li W B, Sun Y R. Status and prospects of researches and applications of Chlorella spp. biotechnology [J]. Progress in Biotechnology, 1998, 18(6): 11—15 [陈颖,李文彬, 孙勇如. 小球藻生物技术研究应用现状及展望.生物工程进展, 1998, 18(6): 11—15]
[2] Wei W Z. The isolation, purification and screening of the tumor-prevention in vitro of glycoprotein from Chlorella pyrenoidosa [D]. Jiangnan University, 2008 [魏文志. 小球藻糖蛋白的分离纯化与体外预防肿瘤作用筛选的研究.江南大学, 2008]
[3] Dhert P, Lavens P, Duray M, et al. Improved larval survival at metamorphosis of Asian seabass (Lates calcarifer) using ω3-HUFA-enriched live food [J]. Aquaculture, 1990, 90(1): 63—74
[4] Li L B, Liu Z G, Wang H. Effects of autolyzed baker yeast as feed on growth and survival of Pinctada martensii (Dunker) D-larvae and juveniles [J]. Journal of Fishery Sciences of China, 2008, 15(6): 1034—1041 [李雷斌, 刘志刚, 王辉. 自溶面包酵母在马氏珠母贝育苗中的饵料效果.中国水产科学, 2008, 15(6): 1034—1041]
[5] Mallick N. Biotechnological potential of immobilized algae for wastewater N, P and metal removal: a review [J]. Biometals, 2002, 15(4): 377—390
[6] Jones A B, Dennison W C, Preston N P. Integrated treatment of shrimp effluent by sedimentation, oyster filtration and macroalgal absorption: a laboratory scale study [J]. Aquaculture, 2001, 193(1): 155—178
[7] Xu J, Xu X D, Fang X T, et al. Screening and lipid analyses of high oleaginous Chlorella species [J]. Acta Hydrobiologica Sinica, 2012, 36(3): 426—432 [徐进, 徐旭东, 方仙桃, 等. 高产油小球藻的筛选及其油脂分析. 水生生物学报, 2012, 36(3): 426—432]
[8] Schenk P M, Thomas-Hall S R, Stephens E, et al. Second generation biofuels: high-efficiency microalgae for biodiesel production [J]. Bioenergy Research, 2008, 1(1): 20—43
[9] Chisti Y. Biodiesel from microalgae [J]. Biotechnology Advances, 2007, 25(3): 294—306
[10] Yang G J, Luan Z Q, Zhou X H. Researching on the effect of temperature on Chlorella growth and dissolved oxygen content [J]. Journal of Agricultural Mechanization Research, 2009, 9: 157—158, 161 [杨桂娟, 栾忠奇, 周笑辉. 温度对小球藻生长量和溶氧量影响研究. 农机化研究, 2009, 9: 157—158, 161]
[11] Du Y, Sun X, Xu N J. Effects of different salinity and iron concentration on growth, nitrate reductase activity and its expression in Chlorella [J]. Ecological Science, 2012, 31(4): 441—445
[杜宇, 孙雪, 徐年军. 不同盐度和 Fe3+浓度对小球藻生长、硝酸还原酶活性及基因表达的影响. 生态科学, 2012, 31(4): 441—445]
[12] Rai P K, Mallick N, Rai L C. Effect of Cu and Ni on growth, mineral uptake, photosynthesis and enzyme activities of Chlorella vulgaris at different pH values [J]. Biomedical and Environmental Sciences, 1994. 7(1): 56—67
[13] Zhao N, Feng M F, Zhu L. Toxic effects of chromium (Cr6+) on Chlorella vulgaris and Scenedesmus obliquus at different pH [J]. Journal Southeast University (Medicine Science Edition), 2010, 29(4): 382—386 [赵娜, 冯鸣凤, 朱琳. 不同pH值条件下Cr6+对小球藻和斜生栅藻的毒性效应. 东南大学学报(医学版), 2010, 29(4): 382—386]
[14] Zhang G Y, Wen X B, Liang F, et al. The effect of physical and chemical factors on the growth and lipid production of Chlorella [J]. Acta Ecologica Sinica, 2011, 31(8): 2076—2085 [张桂艳, 温小斌, 梁芳, 等. 重要理化因子对小球藻生长和油脂产量的影响. 生态学报, 2011, 31(8): 2076—2085]
[15] Zhang G Y, Wen X B, Geng Y H, et al. The effect of pH on the growth and lipid production of Chlorella sp. [A]. Algology branch of Chinese for Society of Oceanology and Limnology. Chinese Algology branch Eighth Congress of the Sixteenth Symposium Abstract Book [C]. 2011 [张桂艳, 温小斌, 耿亚洪, 等. pH对小球藻(Chlorella sp.)生长和产油的影响. 中国海洋湖沼学会藻类学分会. 中国藻类学会第八次会员代表大会暨第十六次学术讨论会论文摘要集.2011]
[16] De-Bashan L E, Antoun H, Bashan Y. Cultivation factors and population size control the uptake of nitrogen by the microalgae Chlorella vulgaris when interacting with the microalgae growth ‐promoting bacterium Azospirillum brasilense [J]. FEMS Microbiology Ecology, 2005, 54(2): 197—203
[17] Guillard R R L, Ryther J H. Studies of marine planktonic diatoms. I. Cyclotella nana Hustedt and Detonula confervacea (Cleve) Gran [J]. Canadian Journal of Microbiology, 1962, 8(2): 229—239
[18] Hao J M , Zheng J, Li Z B, et al. Study on the relationships between optical density at certain wavelength and cell dry weight and cell concentration of three microalgae [J]. Journal of Anhui Agricultural Sciences, 2011, 39(28): 17399—17401 [郝聚敏, 郑江, 黎中宝, 等. 3种微藻在特定波长下的光密度与其单位干重·细胞浓度间的关系研究.安徽农业科学, 2011, 39(28): 17399—17401]
[19] Wang C, Li H, Wang Q Q, et al. Effect of pH on growth and lipid content of Chlorella vulgaris cultured in biogas slurry [J]. Chinese Journal of Biotechnology, 2010, 26(8): 1074—1079 [王翠, 李环, 王钦琪, 等. pH值对沼液培养的普通小球藻生长及油含量积累的影响. 生物工程学报, 2010, 26(8): 1074—1079]
[20] Montgomery, Douglas C. Design and analysis of experiments [M]. New York: Wiley. 1984, 384—418
[21] Ding Y C, Gao Q, Liu J Y, et al. Effect of environmental factors on growth of Chlorella sp. and optimization of culture conditions for high oil production [J]. Acta Ecologica Sinica, 2011, 31(18): 5307—5315 [丁彦聪, 高群, 刘家尧,等. 环境因子对小球藻生长的影响及高产油培养条件的优化. 生态学报, 2011, 31(18): 5307—5315]
[22] Converti A, Casazza A A, Ortiz E Y, et al. Effect of temperature and nitrogen concentration on the growth and lipid content of Nannochloropsis oculata and Chlorella vulgaris for biodiesel production [J]. Chemical Engineering and Processing: Process Intensification, 2009, 48(6): 1146—1151
[23] Ouyang Z R, Wen X B, Geng Y H, et al. The effect of light intensities, temperature, pH and salinities on photosynthesis of Chlorella [J]. Journal of Wuhan Botanical Research, 2010, 28(1): 49—55 [欧阳峥嵘, 温小斌, 耿亚红, 等. 光照强度、温度、pH、盐度对小球藻(Chlorella)光合作用的影响.武汉植物学研究, 2010, 28(1): 49—55]
[24] Cho S H, JI S C, Hur S B, et al. Optimum temperature and salinity conditions for growth of green algae Chlorella ellipsoidea and Nannochloris oculata [J]. Fisheries Science, 2007, 73(5): 1050-1056
[25] Wen G L, Liang W F, Li Z J, et al. Studies on the ecological factors of four microalgae population in mixed-culture [J]. Progress in Fishery Sciences, 2009, 30(6): 142—148 [文国樑, 梁伟峰, 李卓佳, 等. 共培养系统中 4种微藻生态因子的研究. 渔业科学进展, 2009, 30(6): 142—148]
[26] Wu S. On technique for industrial parent rearing of Chlorella spp. [J]. Ocean and Fisher, 2008, 8: 34—35 [吴松. 小球藻工厂化人工培育技术. 海洋与渔业, 2008, 8: 34—35]
[27] Zhang M, Zeng B, Wang M S, et al. The temperature elevation suppresses the light energy utilization and growth of Chlolorella pyrenoidosa under high light intensity conditions [J]. Acta Ecologica Sinica, 2007, 27(2): 662—667 [张曼, 曾波, 王明书, 等. 温度升高对高光强环境下蛋白核小球藻光能利用和生长的阻抑效应. 生态学报, 2007, 27(2): 62—667]
[28] Ahmad I, Hellebust J A. Osmoregulation in the extremely euryhaline marine micro-alga Chlorella autotrophica [J]. Plant Physiology, 1984, 74(4): 1010—1015
[29] Jin W. Effect of salt and Cr3+on physilolgy and biochemistry of signal-cell alage [J]. Journal of Hebei University (Natural Science Edition), 2002, 1: 44—50 [金伟. 盐和铬对单细胞藻生理生化的影响. 河北大学学报(自然科学版), 2002, 1: 44—50]
[30] Jiang L Z, Sun X, Wang W W, et al. Effect of Salinity on the growth, chlorophyll fluorescence characteristics and enzymes of Chlorella pyrenoidosa [J]. Journal of Ningbo University (NESS), 2013, 3: 6—10 [江灵芝, 孙雪, 王玮蔚,等. 盐度对蛋白核小球藻生长、叶绿素荧光参数及代谢酶的影响. 宁波大学学报(理工版), 2013, 3: 6—10]
[31] Han Z G. Effects of environmental stresses (salt-stresses, heat-stresses, osmotic-stresses) on two marine phytoplankton [D]. Jinan University, 2002 [韩志国. 环境胁迫(盐胁, 热胁,渗透胁迫)对两种海洋浮游植物的影响. 暨南大学, 2002]
[32] Lustigman B, Lee L H, Khalil A. Effects of nickel and pH on the growth of Chlorella vulgaris [J]. Bulletin of Environmental Contamination and Toxicology, 1995, 55(1): 73—80
[33] Hua R C. Culture and Utilize Unicellularalgae [M]. Beijing: Agricultural Publishing House. 1986, 23—32 [华汝成. 单细胞藻类的培养与利用. 北京: 农业出版社. 1986, 23—32]
[34] Matusiak K. Studies on the purification of wastewater from the nitrogen fertilizer industry by intensive algal cultures. I. Growth of Chlorella vulgaris in wastes [J]. Acta Microbiologica Polonica, 1975, 25(3): 233—242
[35] Sultana N, Hossain M A. Mass-scale mono-culture of marine unicellular algae Chlorella minutissima under different salinities [J]. Indian Journal of Fisheries, 1989, 36(3): 307—313
[36] Wang Z J, Jing J K, Xu Q Q, et al. Effects of different temperature and pH on the growth and quality of Chlorella USTB-01 [J]. Modern Chemical Industry, 2009, 29(2): 210—213 [王子敬, 景建克, 许倩倩, 等. 不同温度和 pH对小球藻 USTB-01生长和品质的效应. 现代化工, 2009, 29(2): 210—213]
[37] Mayo A W. Effects of temperature and pH on the kinetic growth of unialga Chlorella vulgaris cultures containingbacteria [J]. Water Environment Research, 1997, 69(1): 64—72
[38] Ertit Taştan B, Duygu E, Dönmez G. Boron bioremoval by a newly isolated Chlorella sp. and its stimulation by growth stimulators [J]. Water Research, 2012, 46(1): 167—175
COMBINED EFFECTS OF TEMPERATURE, SALINITY AND pH ON THE SPECIFIC GROWTH RATE OF CHLORELLA
LIU Jia-Hui, YANG Hong-Shuai and WANG Hui
(Fisheries College, Guangdong Ocean University, Zhanjiang 524088, China)
By using central composite design, the join effects of water temperature (16—34 ℃), salinity [(15—45)‰], and pH (6.0—9.0) on the growth of Chlorella sp. CHX-1 were examined in this study. The results showed that the linear and quadratic effects of temperature, salinity and pH on the specific growth rate (SGR) of Chlorella were significant (P<0.01). The interactive effect of temperature and salinity, interactive effect of temperature and pH were significant (P<0.05), but the interaction between salinity and pH was not significant (P>0.05). The effect of temperature on the SGR was greater than that of pH, which in turn was greater than that of salinity. Through response surface methodology, a model equation about the relationship of the growth rate to the three factors was established, with the R2, Adj.R2as highly as 0.9759 and 0.9542, suggesting that the fitting capability of the model was satisfactory. The Pred.R2reached to 0.8367, demonstrating that the model could be practicably applied for prediction. Through the optimization of the reliable model, the SGR reached its maximum (0.69) when the 3-factor combination was 26.7 ℃/ 25.5‰/7.3, with the desirability value being 0.999. These experimental results could offer theoretical reference for the production of the Chlorella.
Chlorella; Temperature; Salinity; pH; Specific growth rate; Response surface method
S968.41+9
A
1000-3207(2014)03-0446-08
10.7541/2014.63
2013-09-11;
2014-02-23
广东省教育厅工程中心建设项目(GCZX-A0909); 国家星火计划(2011GA780001)资助
刘加慧(1989—), 女, 河北邯郸人; 硕士研究生; 主要从事海洋经济动物发育生物学研究。E-mail: 13226267636@163.com
王辉(1966—), 男, 博士生导师; E-mail: whh524@sina.com

