饲料中铜浓度对异育银鲫和斑点叉尾的影响
种香玉周立志韩 冬,3朱晓鸣杨云霞金俊琰解绶启
(1. 安徽大学资源与环境工程学院, 合肥 230601; 2. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072; 3. 淡水水产健康养殖湖北省协同创新中心, 武汉 430070)
种香玉1,2周立志1韩 冬2,3朱晓鸣2杨云霞2金俊琰2解绶启2
(1. 安徽大学资源与环境工程学院, 合肥 230601; 2. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072; 3. 淡水水产健康养殖湖北省协同创新中心, 武汉 430070)
通过 4周的生长实验, 研究饲料中不同铜含量对异育银鲫(Carassius auratus gibelio) [初始体重(128.6±2.0) g]和斑点叉尾(Ictalurus punctatus)[初始体重(159.4±2.0) g]的生长、饲料利用、血液生化以及组织中铜积累量的影响。两种实验鱼的实验饲料均以CuSO4·5H2O为铜源, 铜含量分别为3.1(对照)、7.5、49.8、100.5、506.9、965.1和1491.1 mg/kg饲料。实验结果表明, 异育银鲫摄食量(FI)随饲料中铜含量的增加无显著影响(P>0.05), 特定生长率(SGR)随着饲料中铜含量的增加而显著下降, 在铜含量为 1491.1 mg/kg时出现最低值(P<0.05), 饲料效率(FE)表现出与特定生长率相似的变化趋势。肝体比(HSI)和脏体比(VSI)均随着饲料中铜含量的增加而显著下降(P<0.05),各处理组间的肥满度(CF)差异不显著(P>0.05)。血浆中谷草转氨酶(GOT)在铜含量为 7.5 mg/kg时达到最低值(P<0.05), 然而血浆中谷丙转氨酶(GPT)、铜锌超氧化物歧化酶(Cu-ZnSOD)活性及红细胞压积(Hct)、血红蛋白浓度(Hb)均不受饲料中铜含量的影响(P>0.05)。肝脏中铜积累量随着饲料中铜含量的增加而无显著影响(P>0.05), 而肌肉中铜含量没有显著差异(P>0.05)。斑点叉尾FI随饲料中铜含量的增加而显著上升(P<0.05), SGR随饲料中铜含量的增加表现出下降的趋势, 但是差异不显著(P>0.05), FE随饲料中铜含量的增加显著降低(P<0.05)。HSI和 CF随饲料中铜含量的变化而显著下降。Hct随铜含量的增加呈现出先上升后下降的趋势, 当铜含量为100.5 mg/kg时达到最大值(P<0.05), 然而饲料铜水平对血浆中GPT、GOT、Cu-Zn SOD活性及Hb、VSI均无显著影响(P>0.05)。铜在各组织中的积累表现出与异育银鲫相同的变化趋势。饲料中较高浓度铜可抑制斑点叉尾和异育银鲫的生长和饲料利用, 且异育银鲫对铜的耐受性高于斑点叉尾。
异育银鲫; 斑点叉尾; 铜; 生长; 血液免疫; 铜蓄积
铜是所有的生物体包括鱼类所必需的一种微量元素, 为血浆铜蓝蛋白、超氧化物歧化酶(SOD)、酪氨酸酶、细胞色素C氧化酶等的构成要素,对造血、神经系统的发育、骨骼及结缔组织的形成具有重要作用[1]。与其他微量元素一样, 鱼类自身无法合成铜,必须从外界获得, 因此, 饲料中添加适量的铜对鱼类是必需的。同时, 作为一种重金属, 铜具有抗菌、促进生长的作用, 多年来铜被作为一种抗菌剂和生长促进剂在动物饲料中过量添加[2]。同时作为一种重金属, 饲料中过量的铜含量还可能对水生动物造成潜在毒性[3]。目前检测的鱼类商品饲料中铜含量可达34 mg/kg, 该浓度超过多数鱼类对铜的适宜需求水平[4], 甚至可能已达到对有些鱼类造成毒性的阈值。现有研究表明, 摄入过量的铜会影响鱼类的免疫指标[5]、抗氧化水平[6]、鳃和肠的内稳态[7]。它还会影响鱼类的生长、生殖、行为、酶活性及血液参数[8]。因为摄入体内的铜和细胞内活性氧形成有关系, 而活性氧可以引起鱼类的氧化压力进而造成细胞损伤[9]。
饲料中不同浓度的铜对凡纳滨对虾(Litopenaeus vannamei)[10]、大西洋鲑(Salmo salar)[3]、罗非鱼(Oreochromis niloticus)[11]、许氏平 鲉(Sebastes schlegeli)[12]、虹鳟鱼(Oncorhynchus mykiss)[13]的影响已有研究, 这些实验是在不同的实验室和不相同的实验条件下进行的, 这些研究所采用的铜源、饲料配方以及水温、溶氧是不同的, 实验动物的种类和规格也不尽相同, 从而导致实验结果可比性差, 因此, 很有必要在相同的实验条件下对不同食性鱼类对铜的代谢情况展开研究。
异育银鲫“中科3 号” (Carassius auratus gibelio)是中国科学院水生生物研究所淡水生态与生物技术国家重点实验室科研人员利用银鲫双重生殖方式,从高体型异育银鲫(简称高背鲫)与平背型异育银鲫交配所产后代中选育, 再经雌核培育的异育银鲫的第三代新品种[14]。斑点叉尾属于鲶形目科, 原产美国, 是美国最主要的淡水养殖和食用鱼类, 肉质鲜美、生长快、易捕捞等特点, 深受养殖生产者、加工者和消费者欢迎。异育银鲫和斑点叉尾是重要的经济鱼类。近年来国内的一些学者已经展开了对它们营养学的研究[15,16]。但有关这两种鱼对饲料中铜的利用和安全耐受方面的差异仍不清楚。
本研究通过在饲料中添加不同浓度的铜, 研究其对异育银鲫“中科3号”和斑点叉尾的生长、体成分、血液指标及铜在组织中的积累的影响。通过比较研究不同种类的鱼对不同浓度铜的反应,对完善饲料营养构成,提高饲料效率和促进鱼虾等水产品的健康养殖具有积极的作用,也为饲料中铜营养和毒性影响提供信息。
1 材料与方法
1.1 养殖系统
实验在室外池塘网箱中进行, 实验地点为湖北省石首市老河长江“四大家鱼”原种场内, 鱼池面积为1960 m2, 池塘长×宽为70 m×28 m, 池塘水深1.7 m,网箱规格为2 m×2 m×2 m, 用鱼网加盖。实验期间每天上午(8:00)、中午(12:00)及下午(16: 00)检测水温,水温变化范围为27.6—31.2 , ℃ 自然光照(2012年8月31日—2012年9月27日), 定期测定水质, 实验期间溶氧高于 5 mg/L, 氨氮浓度低于 0.5 mg/L, pH为7.1—7.3, 水中铜浓度为 6—8 μg/L。为了加强水体交换和补充水分的蒸发, 每三天换1/4池塘水, 水源来自池塘外长江故道。
1.2 实验饲料及实验设计
以鱼粉为蛋白源, 以鱼油 ︰豆油=1︰1为脂肪源, 配制等氮(粗蛋白35.6%)等能(16.7 kJ/g)的7组饲料。添加CuSO4·5H2O到基础饲料中, 使饲料中铜含量形成7个水平, 分别为0、5、50、100、500、1000和1500 mg/kg。饲料中铜含量的实测值分别为: 3.04、7.55、49.81、100.48、506.85、965.05和1491.57 mg/kg。原料过40目筛混匀后用制粒机(SLR-150, 中国水产科学研究院渔业机械仪器研究所)制成直径为3 mm的沉性饲料,于70℃恒温烘箱烘干后置于–4℃冰箱备用。饲料配方见表1。
1.3 实验鱼及饲养管理
实验用异育银鲫“中科3号”来自中国科学院水生生物研究所官桥渔场的当年幼鱼, 斑点叉尾来自湖北宜昌长阳县渔场。实验鱼在进入实验养殖系统前,先用 2%食盐水浸泡 15min消毒, 然后将所有鱼暂养在池塘网箱中, 一天四次(8:00、12:00、16:00和19:00)使用基础饲料饲喂一个月。实验开始前, 将暂养鱼禁食24h后,分别随机选取体质健壮、规格均匀的异育银鲫[初始均重(128.6±2.0) g]或斑点叉尾[初始均重为(159.4±2.0) g]20尾放入网箱中, 每种实验鱼分别放置21个网箱, 实验设7个处理, 每个处理 3个重复, 各处理组之间鱼初始均重没有显著差异(P>0.05)。同时, 每种实验鱼分别随机选取3组鱼(每组 2尾)作初始鱼样, 每组带水称重后再抹干称重, 以折算体表水分换算每个网箱鱼的初始重量,鱼样保存在–20℃冰箱中, 以备分析鱼体成分。实验期间, 每天4次(8:00、12:00、16:00和19:00)手工投喂, 每次持续时间1h, 达到表观饱食。
1.4 取样及分析
生长实验持续 4周, 实验结束时, 所有实验鱼禁食 24h后, 对每个网箱的鱼进行计数, 带水称重,每网箱随机取 2尾鱼, 抹干后校正体表水分, 置于–20℃冰箱保存, 供终末鱼体生化成分分析。随机取三尾鱼称重, 测体长, 解剖取内脏和肝脏称重, 用于计算肝体比、脏体比和肥满度。然后将所取肝脏装袋, 取肌肉装袋, 置于–10℃冰箱保存, 用于组织中铜的测定。每网箱随机取3尾鱼, 用肝素钠(0.2%)润过的注射器尾静脉取血, 离心(3000 r/min, 15min)获得血浆, 同一缸的血浆样集中, 混合均匀, 分装于6个0.5 mL离心管, 保存于-80℃冰箱, 供血浆中酶的测定。

表1 实验基础饲料配方及化学组成(%干重)Tab. 1 Formulation and chemical composition of the basal diet (% dry matter)
实验饲料和鱼体干物质、粗蛋白、粗脂肪、灰分的测定参照 AOAC[17]方法测定, 干物质在 105℃烘干至恒重, 采用失重法测定; 粗蛋白采用 FOSS定氮仪(2300 Kjeltec Analyzer Unit)测定; 粗脂肪采用索氏抽提仪(Soxtec system HT6, Tecator, Hoganas, Sweden)进行测定; 灰分在马福炉中 550℃燃烧 3h,失重法测定; 能值采用 Phillipson微量能量计(Phillipson microbomb calorimeter, Gentry Instruments Inc., Aiken, South Carolina, USA)测定, 每个样品至少两个平行样。
铜的测定参照Handy, et al.[18]。肝脏、肌肉、鱼体先放入–10℃保存, 然后在冷冻干燥机(CHRIST. RLPHR 1-4LD)中冻干。取0.2 g干组织加入4 mL HNO3(65%)和 2 mL H2O2(30%),然后在微波消解仪(WX-400, 上海屹尧仪器科技发展有限公司)中进行消化17min(250 W, 1min; 0 W, 1min; 250 W, 5min; 400 W, 5min; 650 W, 1min), 然后用去离子水定容到25 mL, 原子吸收光谱进行测定(Atomic Absorption spectrometer Annalyst 800, Perkin Elmer, USA)(每个样品3个重复)。水样用HNO3(65%)预处理, 最后水中硝酸浓度达到5.2% (2 mL HNO3加到25 mL水样中), 然后保存到 4℃冰箱中保存, 直到水样中铜的测定。
Cu-Zn SOD酶的测定参照Özmen, et al.[19], 通过黄嘌呤及黄嘌呤氧化酶反应系统, 产生超氧阴离子自由基, 自由基氧化羟胺形成亚硝酸盐, 在显色剂的作用下呈现紫红色, 在550 nm处比色读取吸光度并计算酶活力。
血清谷丙转氨酶、谷草转氨酶用南京建成试剂盒测定。
红细胞压积的测定是参照Gatlin and Wilson[20],用注射器取血液注入玻璃微细管中, 然后在微红细胞压积离心机中离心(5min, 12000 r/min), 读取红细胞占的刻度及总的血液刻度, 然后它们所得的比值就是红细胞压积。
血红蛋白浓度用南京建成试剂盒采用高铁血红蛋白方法测定。
肝脏和肠道透射电镜切片观察, 电镜样品分析根据Dezfuli, et al.[21]的分析方法, 用TecnaiG20TWIN电子显微镜(FEI Company, Hillsboro, USA)在200 kV电压下, 放大2500和5000倍获得图像(中国科学院武汉病毒所分析测试中心)。
1.5 数据处理
实验数据采用SPSS 15.0 for Windows对所得的数据进行配对t检(Paired t Test)和双因素方差分析(Two-way ANOVA), 如果饲料处理与鱼的种类不存在显著交互作用(P>0.05), 两种鱼间分别进行Duncan’s多重比较,若差异显著(P<0.05), 斑点叉尾用小写字母标注, 异育银鲫用大写字母标注; 若存在显著交互作用(P<0.05), 则两种鱼合并进行Duncan’s多重比较, 若差异显著(P<0.05), 两种鱼均用小写字母标注。
2 结果
2.1 形体指数
由表 2可知, 饲料处理和鱼种类对形体指数不存在显著交互作用(P>0.05)。同一处理组的异育银鲫的肝体比、脏体比和肥满度均大于斑点叉尾(P<0.05)。
随着饲料中铜浓度的增加, 异育银鲫的肝体比、脏体比有显著下降的趋势(P<0.05), 当饲料中铜含量为3.1 mg/kg时均出现最大值(P<0.05)。而肥满度各处理组间无显著差异(P>0.05)。
2.2 生长和饲料利用
(1)针对桥面铺装的纵向分幅施工来说,此处可以不设置纵向施工缝隙,但是在横向位置需要设置施工缝隙,缝隙的宽度需要控制在3mm左右,深度控制在2.5cm范围。
异育银鲫的存活率随饲料中铜浓度的升高没有显著差异(P>0.05), 摄食量随饲料中铜含量的升高而无显著差异(P>0.05), 特定生长率表现出显著下降的趋势, 当饲料中的铜浓度≥100 mg/kg时, 特定生长率显著低于对照组(P<0.05)。饲料效率表现出与特定生长率相同的变化趋势。蛋白质效率随着饲料中铜浓度的升高而降低, 当铜浓度为1491.9 mg/kg时出现最低值(P<0.05)。
表2 饲料中不同铜水平对异育银鲫和斑点叉尾形体指数的影响Tab. 2 Effect of dietary copper levels on morphological parameters of gibel carp and channel catfish
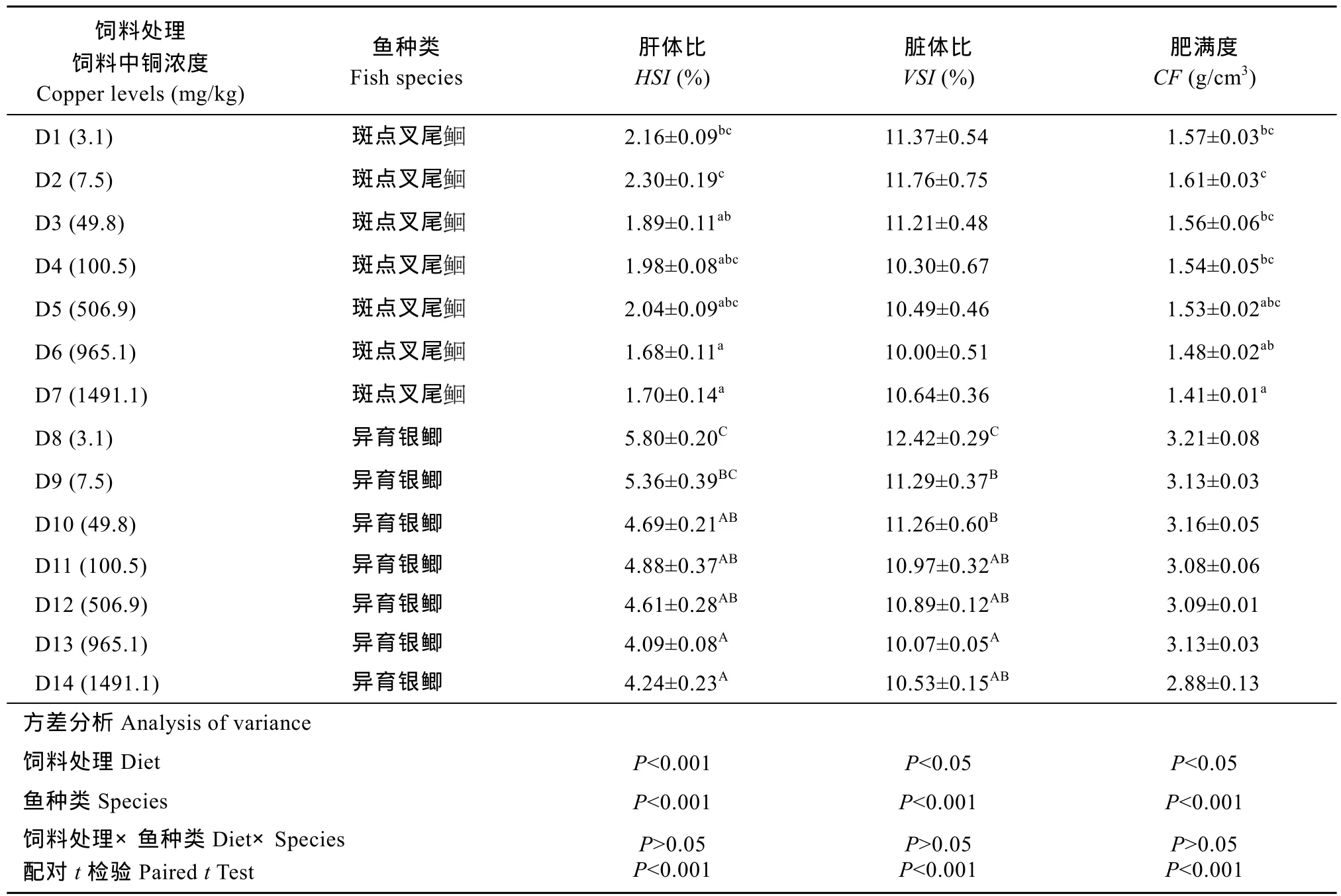
表2 饲料中不同铜水平对异育银鲫和斑点叉尾形体指数的影响Tab. 2 Effect of dietary copper levels on morphological parameters of gibel carp and channel catfish
注: 表中数据表示为平均值±标准误。同列数据后不同上标英文字母表示差异显著(P<0.05), 肥满度 = 100×体重/(体长)3; 肝体指数 = 100×肝重/体重; 脏体指数 = 100×内脏重/鱼体重Note: Data presented are Means ± SE, means with different superscripts in the same column are significantly different (P<0.05). CF (condition factor) = 100×live weight / (body length)3; HSI (hepatosomatic index) = liver weight × 100/ body weight; VSI(Viscera-somatic index) =100×viscera wet weigh/body weight
饲料处理饲料中铜浓度Copper levels (mg/kg)鱼种类Fish species肝体比HSI (%)脏体比VSI (%)肥满度CF (g/cm3) D1 (3.1) 斑点叉尾2.16±0.09bc11.37±0.54 1.57±0.03bc2.30±0.19c11.76±0.75 1.61±0.03cD3 (49.8) 斑点叉尾D2 (7.5) 斑点叉尾1.89±0.11ab11.21±0.48 1.56±0.06bcD4 (100.5) 斑点叉尾1.98±0.08abc10.30±0.67 1.54±0.05bcD5 (506.9) 斑点叉尾2.04±0.09abc10.49±0.46 1.53±0.02abcD6 (965.1) 斑点叉尾1.70±0.14a10.64±0.36 1.41±0.01aD8 (3.1) 异育银鲫 5.80±0.20C12.42±0.29C3.21±0.08 D9 (7.5) 异育银鲫 5.36±0.39BC11.29±0.37B3.13±0.03 D10 (49.8) 异育银鲫 4.69±0.21AB11.26±0.60B3.16±0.05 D11 (100.5) 异育银鲫 4.88±0.37AB10.97±0.32AB3.08±0.06 D12 (506.9) 异育银鲫 4.61±0.28AB10.89±0.12AB3.09±0.01 D13 (965.1) 异育银鲫 4.09±0.08A10.07±0.05A3.13±0.03 D14 (1491.1) 异育银鲫 4.24±0.23A10.53±0.15AB2.88±0.13方差分析Analysis of variance 1.68±0.11a10.00±0.51 1.48±0.02abD7 (1491.1) 斑点叉尾饲料处理Diet P<0.001 P<0.05 P<0.05鱼种类Species P<0.001 P<0.001 P<0.001饲料处理×鱼种类Diet×Species配对t检验Paired t Test P>0.05 P<0.001 P>0.05 P<0.001 P>0.05 P<0.001
表3 饲料中铜浓度对异育银鲫和斑点叉尾生长和饲料利用的影响Tab. 3 Effect of dietary copper levels on growth and feed utilization of gibel carp and channel catfish
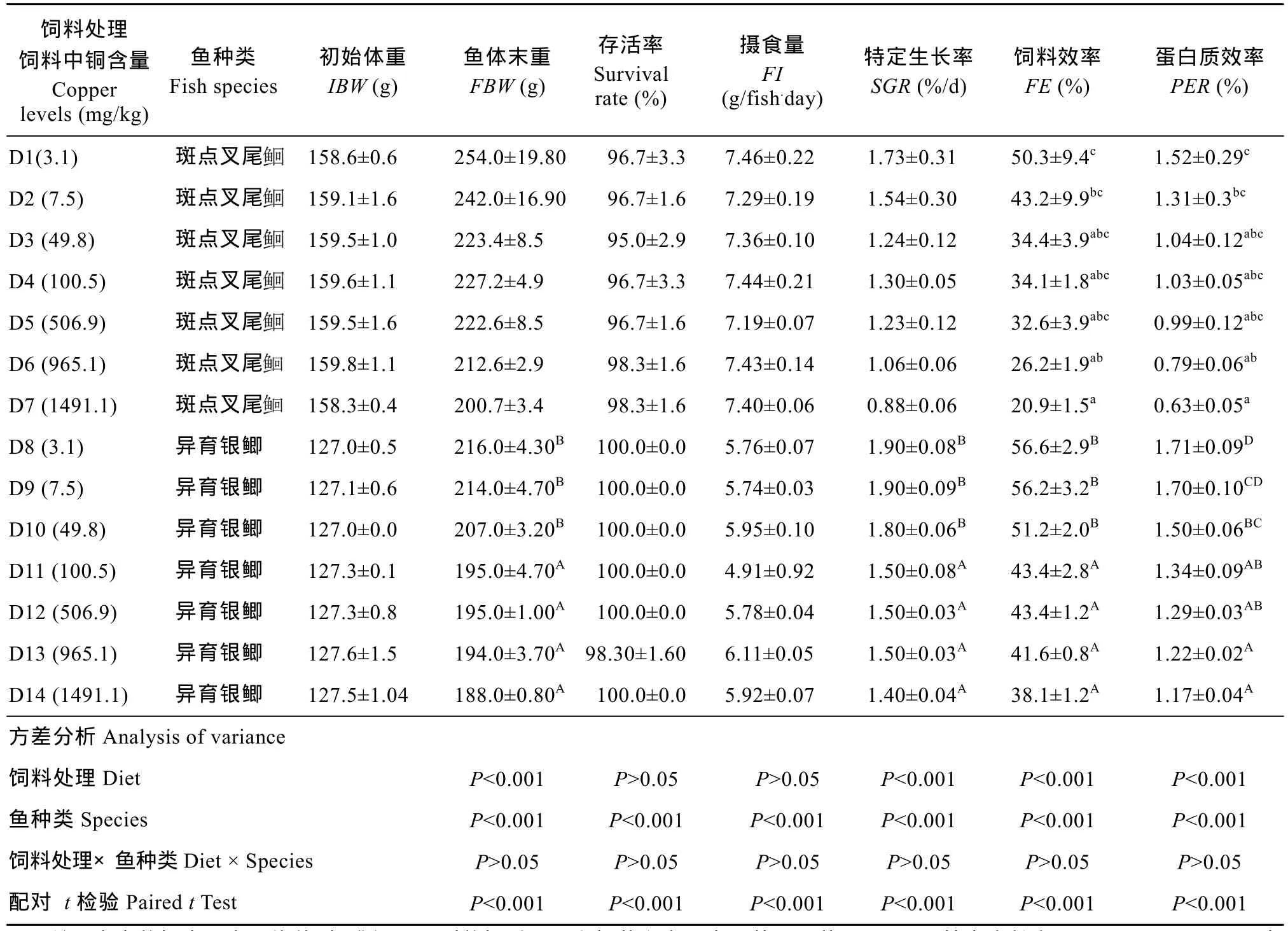
表3 饲料中铜浓度对异育银鲫和斑点叉尾生长和饲料利用的影响Tab. 3 Effect of dietary copper levels on growth and feed utilization of gibel carp and channel catfish
注: 表中数据表示为平均值±标准误。同列数据后不同上标英文字母表示差异显著(P<0.05)。特定生长率(SGR, %/d)=100×[(Ln鱼体末重)−(Ln鱼体初重)]/天数, 饲料效率(FE, %)=100×(鱼体末重−鱼体初重)/摄食饲料干重, 蛋白质效率(PER, %)=(鱼体末重−鱼体初重)/蛋白质摄取Note: Data presented are Means ± SE, means with different superscripts in the same column are significantly different (P< 0.05). IBW (g/fish), initial mean body weight; FBW (g/fish), final mean body weight; SGR (specific growth rate, %/ d) = 100× (Ln (FBW)-Ln (IBW)) / days; FE (Feed efficiency, %) = (FBW-IBW) /feed intake; protein efficiency ratio(PER, %)= (FBW-IBW)/ protein intake
饲料处理饲料中铜含量Copper levels (mg/kg)鱼种类Fish species初始体重IBW (g)鱼体末重FBW (g)存活率Survival rate (%)摄食量FI (g/fish.day)特定生长率SGR (%/d)饲料效率FE (%)蛋白质效率PER (%) D1(3.1) 斑点叉尾158.6±0.6 254.0±19.80 96.7±3.3 7.46±0.22 1.73±0.31 50.3±9.4c1.52±0.29c159.1±1.6 242.0±16.90 96.7±1.6 7.29±0.19 1.54±0.30 43.2±9.9bc1.31±0.3bcD3 (49.8) 斑点叉尾D2 (7.5) 斑点叉尾159.5±1.0 223.4±8.5 95.0±2.9 7.36±0.10 1.24±0.12 34.4±3.9abc1.04±0.12abcD4 (100.5) 斑点叉尾159.6±1.1 227.2±4.9 96.7±3.3 7.44±0.21 1.30±0.05 34.1±1.8abc1.03±0.05abcD5 (506.9) 斑点叉尾159.5±1.6 222.6±8.5 96.7±1.6 7.19±0.07 1.23±0.12 32.6±3.9abc0.99±0.12abcD6 (965.1) 斑点叉尾159.8±1.1 212.6±2.9 98.3±1.6 7.43±0.14 1.06±0.06 26.2±1.9ab0.79±0.06abD7 (1491.1) 斑点叉尾158.3±0.4 200.7±3.4 98.3±1.6 7.40±0.06 0.88±0.06 20.9±1.5a0.63±0.05aD8 (3.1) 异育银鲫 127.0±0.5 216.0±4.30B100.0±0.0 5.76±0.07 1.90±0.08B56.6±2.9B1.71±0.09DD9 (7.5) 异育银鲫 127.1±0.6 214.0±4.70B100.0±0.0 5.74±0.03 1.90±0.09B56.2±3.2B1.70±0.10CDD10 (49.8) 异育银鲫 127.0±0.0 207.0±3.20B100.0±0.0 5.95±0.10 1.80±0.06B51.2±2.0B1.50±0.06BCD11 (100.5) 异育银鲫 127.3±0.1 195.0±4.70A100.0±0.0 4.91±0.92 1.50±0.08A43.4±2.8A1.34±0.09ABD12 (506.9) 异育银鲫 127.3±0.8 195.0±1.00A100.0±0.0 5.78±0.04 1.50±0.03A43.4±1.2A1.29±0.03ABD13 (965.1) 异育银鲫 127.6±1.5 194.0±3.70A98.30±1.60 6.11±0.05 1.50±0.03A41.6±0.8A1.22±0.02AD14 (1491.1) 异育银鲫 127.5±1.04 188.0±0.80A100.0±0.0 5.92±0.07 1.40±0.04A38.1±1.2A1.17±0.04A方差分析Analysis of variance饲料处理Diet P<0.001 P>0.05 P>0.05 P<0.001 P<0.001 P<0.001鱼种类Species P<0.001 P<0.001 P<0.001 P<0.001 P<0.001 P<0.001饲料处理×鱼种类Diet × Species P>0.05 P>0.05 P>0.05 P>0.05 P>0.05 P>0.05配对 t检验Paired t Test P<0.001 P<0.001 P<0.001 P<0.001 P<0.001 P<0.001
2.3 鱼体组成
如表 4所示, 饲料处理和鱼种类对鱼体生化组成不存在交互作用(P>0.05)。异育银鲫鱼体的粗蛋白和灰分含量均高于斑点叉尾(P<0.05), 粗脂肪含量低于斑点叉尾(P<0.05), 而鱼体水分两种鱼不存在显著差异(P>0.05)。
随着饲料中铜浓度的变化, 异育银鲫鱼体粗蛋白、粗脂肪、灰分没有显著差异(P>0.05), 而各处理组间鱼体水分差异显著(P<0.05)。
2.4 血清免疫
表4 饲料中铜水平对异育银鲫和斑点叉尾鱼体组成的影响(湿重)Tab.4 Effect of dietary copper levels on body composition of gibel carp and channel catfish (in wet weight)

表4 饲料中铜水平对异育银鲫和斑点叉尾鱼体组成的影响(湿重)Tab.4 Effect of dietary copper levels on body composition of gibel carp and channel catfish (in wet weight)
注: 表中数据表示为平均值±标准误。同列数据后不同上标英文字母表示差异显著(P<0.05)Note: Data presented are Means ± SE, means with different superscripts in the same column are significantly different (P< 0.05)
饲料处理饲料中铜浓度Copper levels (mg/kg)鱼种类Fish species水分Moisture (%)粗蛋白Crude protein (%)粗脂肪Crude lipid (%)灰分Ash (%) D1(3.1) 斑点叉尾70.30±0.71 14.96±0.27 10.86±0.55 3.47±0.02abD2(7.5) 斑点叉尾69.88±0.59 15.06±0.26 11.77±0.60 3.37±0.05aD3(49.8) 斑点叉尾71.28±0.58 15.12±0.42 10.11±0.60 3.45±0.08abD4(100.5) 斑点叉尾70.87±0.36 15.01±0.02 10.35±0.41 3.67±0.07bD5(506.9) 斑点叉尾71.29±0.51 14.92±0.16 9.28±0.35 3.69±0.14bD6(965.1) 斑点叉尾71.49±0.74 14.74±0.31 9.77±0.62 3.67±0.01bD7(1491.1) 斑点叉尾71.25±1.27 14.00±0.42 10.49±0.95 3.70±0.12bD8(3.1) 异育银鲫 71.18±0.47ABC16.77±0.33 7.61±1.54 4.66±0.38 D9(7.5) 异育银鲫 70.49±0.45AB16.81±0.86 6.44±0.61 4.43±0.23 D10(49.8) 异育银鲫 70.00±0.52A16.62±0.25 7.58±0.87 4.33±0.21 D11(100.5) 异育银鲫 70.22±0.08AB17.15±0.43 5.81±0.35 4.66±0.26 D12(506.9) 异育银鲫 71.47±0.24BC17.27±0.36 5.48±0.53 4.75±0.35 D13(965.1) 异育银鲫 70.03±0.48A16.73±0.27 7.22±0.25 4.50±0.09 D14(1491.1) 异育银鲫 71.88±0.44C16.90±0.49 5.48±0.82 4.79±0.49方差分析Analysis of variance饲料处理Diet P>0.05 P>0.05 P>0.05 P<0.05鱼种类Species P>0.05 P<0.001 P<0.001 P<0.001饲料处理×鱼种类Diet×Species配对t检验Paired t Test P>0.05 P>0.05 P>0.05 P<0.001 P>0.05 P<0.001 P>0.05 P<0.001
表5 饲料中铜浓度对异育银鲫和斑点叉尾血液生理指标的影响Tab. 5 Effect of dietary copper levels on hematic physiological parameters of gibel carp and channel catfish

表5 饲料中铜浓度对异育银鲫和斑点叉尾血液生理指标的影响Tab. 5 Effect of dietary copper levels on hematic physiological parameters of gibel carp and channel catfish
饲料处理饲料中铜浓度Copper levels (mg/kg)鱼种类Fish species血红蛋白浓度HB (g/L)红细胞压积Hct (%)谷丙转氨酶GPT (U/L)谷草转氨酶GOT (U/L)铜锌超氧化物歧化酶Cu-Zn SOD (U/mL) D1(3.1) 斑点叉尾78.4±1.2 37.0±0.6a15.0±1.8 11.7±2.1 57.9±7.3 D2(7.5) 斑点叉尾62.5±2.1 42.2±0.5ab13.3±1.8 19.7±4.9 65.9±8.4 D3(49.8) 斑点叉尾72.3±11.6 45.7±2.6bc13.8±5.1 16.0±4.4 66.5±4.4 D4(100.5) 斑点叉尾66.1±15.3 57.0±2.9e15.0±3.8 15.0±3.3 67.5±7.1 D5(506.9) 斑点叉尾78.4±15.9 49.3±2.7cd16.1±5.1 12.8±1.7 67.5±5.2 D6(965.1) 斑点叉尾60.1±3.2 54.3±3.2de17.5±6.1 14.8±2.6 65.6±10.5 D7(1491.1) 斑点叉尾71.1±6.8 44.7±0.3bc16.2±1.2 14.4±3.1 65.3±3.7 D8(3.1) 异育银鲫 81.8±5.7 39.1±2.1 6.8±0.3 131.1±9.3 202.9±12.4 D9(7.5) 异育银鲫 82.1±3.2 36.4±2.8 6.1±0.5 65.1±7.4a186.5±19.6 D10(49.8) 异育银鲫 86.8±4.5 48.4±4.7 5.9±0.4 75.5±16.8ab187.1±21.9 D11(100.5) 异育银鲫 90.2±4.3 51.9±6.7 6.0±0.1 96.4±9.5abc195.5±8.9 D12(506.9) 异育银鲫 88.4±6.7 44.2±3.4 5.8±0.3 99.2±13.5abc243.7±34.6 D13(965.1) 异育银鲫 82.9±4.6 42.8±2.6 6.4±0.1 107.3±12.8bc211.4±23.9 D14(1491.1) 异育银鲫 84.0±1.4 37.4±2.3 7.2±0.5 93.0±11.3abc204.6±58.0方差分析Analysis of variance饲料处理Diet P>0.05 P<0.001 P>0.05 P>0.05 P>0.05鱼种类Species P<0.05 P<0.05 P<0.001 P<0.001 P<0.001饲料处理×鱼种类Diet×Species配对 t 检验Paired t Test P>0.05 P<0.05 P>0.05 P<0.05 P>0.05 P<0.001 P>0.05 P<0.001 P>0.05 P<0.001
异育银鲫血红蛋白浓度、红细胞压积及谷丙转氨酶、铜锌超氧化物歧化酶活性均未受到饲料中铜浓度的变化的显著影响(P>0.05)。而血清谷草转氨酶呈现出先降低后升高的趋势, 当铜浓度为7.5 mg/kg时出现最低值(P<0.05)。
2.5 组织学分析
饲料中铜浓度对异育银鲫肝脏的影响如图1所示, 饲料中铜浓度≥500 mg/kg时, 异育银鲫的肝脏与对照组相比内质网有扩张的现象。当饲料中铜浓度为1500 mg/kg时, 异育银鲫的肝脏与对照组相比线粒体有肿胀的现象。
饲料中铜浓度对异育银鲫肠道微绒毛超微结构的影响如图 3。其中饲料中铜浓度为 3.1 mg/kg时,微绒毛排列整齐、致密。7.5、49.8、100.5、506.9 和1000 mg/kg组与对照组相比柱状细胞空隙稍微变大, 1500 mg/kg组柱状细胞空隙与对照组相比明显变大,排列不整齐。

图1 不同铜浓度饲料对异育银鲫肝脏的影响Fig. 1 TEM image of hepatopancreas of gibel carp fed with different copper concentration diet

图2 不同铜浓度的饲料对斑点叉尾肝脏的影响Fig. 2 TEM image of hepatopancreas of channel catfish fed with different copper concentration diet
2.6 组织中铜的蓄积
如图 5所示, 鱼种类和处理对肌肉中的铜含量没有交互作用(P>0.05), 而对肝脏和鱼体中的铜含量有交互作用(P<0.05)。随着饲料中铜浓度的升高,异育银鲫和斑点叉尾肌肉中铜浓度没有显著差异(P>0.05), 但异育银鲫各处理组肌肉的铜浓度均高于斑点叉尾肌肉铜浓度(P<0.05)。当饲料中铜浓度≤506.9 mg/kg时, 异育银鲫肝脏中铜浓度显著高于斑点叉尾(P<0.05), 当饲料中铜浓度≥965.1 mg/kg时, 异育银鲫肝脏中铜浓度显著低于斑点叉尾(P<0.05)。当饲料中铜浓度≥506.9 mg/kg时, 两种鱼鱼体中铜浓度没有显著差异(P>0.05), 当饲料中铜浓度≥965.1 mg/kg时斑点叉尾鱼体中铜浓度显著高于异育银鲫(P<0.05)。
3 讨论
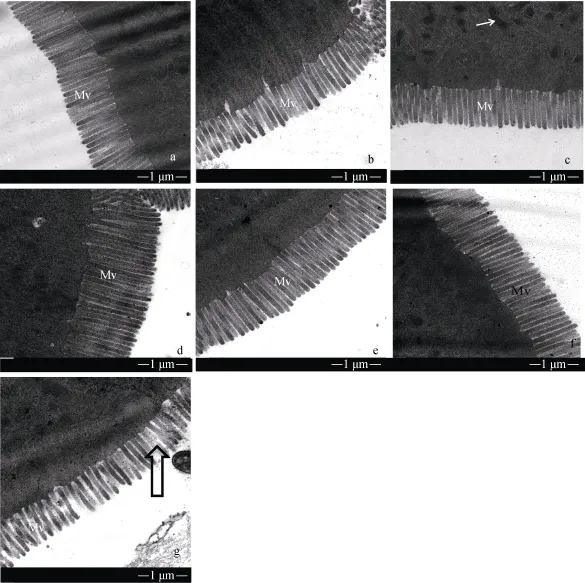
图3 不同铜浓度的饲料对异育银鲫中肠微绒毛影响Fig. 3 TEM image of midgut microvillus of gibel carp fed with different copper concentration diet
肝脏对铜的高蓄积能力, 是鱼类的某种防御机制, 当铜摄入不足时, 肝脏中储存的铜释放出来满足机体代谢需要, 当铜摄入过量时, 过多的铜可在肝脏中积累从而降低了机体整体的毒性, 肝脏发挥了解毒的功能[12]。本研究结果显示, 饲料中铜浓度对肝脏中铜的积累有直接影响, 相似的结果也有报道, Samanta, et al.[26]报道, 随着饲料中铜浓度的增加, 肝脏中铜的积累显著增加。Kim和Kang[12]报道,铜在许氏平 鲉肝脏中的积累在铜浓度为500、250、125 mg/kg时分别为对照组的51、18、11倍。这可能是因为肝脏通过诱导金属结合蛋白如金属硫蛋白(MT)的合成, 从而在重金属的代谢及重金属的解毒中起着主要的作用, 肝脏是重金属重要的储存、代谢及解毒器官[27]。很多研究者关注肝脏、肠道等器官中铜的积累, 很少有人研究铜在肌肉中的积累,重金属在肌肉中的积累浓度对鱼类消费者健康是非常有影响的[28]。本研究得出, 饲料中铜浓度对斑点叉尾和异育银鲫肌肉中铜蓄积没有显著影响。与此相似, Kim和Kang[12]研究得出, 饲养周期40d后,饲料中铜浓度对许氏平 鲉肌肉中铜积累也没显著影响。De Boeck, et al.[23]研究得出, 在实验周期28d,肌肉中的铜浓度各处理组没有显著差异。这也许是鱼体肌肉中的铜具有自我平衡调节功能, 可被机体有效地调节[13]。

图4 不同铜浓度的饲料对斑点叉尾中肠微绒毛影响Fig. 4 TEM image of midgut microvillus of channel catfish fed with different copper concentration diet
血液学指标通常是评价化学物对鱼类潜在污染最合适的指标之一[29]。Kim 和 Kang[12]对 许氏平鲉的研究发现, 饲料中的铜暴露对许氏平 鲉的血红蛋白浓度和红细胞压积没有显著性影响。Shaw和Handy[11]对罗非鱼的研究发现, 含铜饲料暴露 42d,各处理之间血红蛋白浓度和红细胞压积没有显著性差异。这意味着鱼体内渗透调节以及载氧能力没有受到影响[12]。在本实验中也得出了相似的结果, 饲料中铜浓度对异育银鲫的血红蛋白浓度和红细胞压积没有显著影响; 但斑点叉尾的红细胞压积先升高后降低, 血红蛋白浓度没有显著差异, 且异育银鲫各处理组的血红蛋白浓度和红细胞压积均高于斑点叉尾, 这也说明杂食性的异育银鲫比肉食性的斑点叉尾对铜的耐受性高。不同的结果也见于Mustafa, et al.[25]对鲤鱼(Cyprinus carpio)的研究, 在低氧状态下饲养鲤鱼30d, 血红蛋白浓度和红细胞压积均显著增加, 造成差异的原因可能是鱼的规格、饲养环境不同。鱼的生长阶段不同, 对铜的代谢能力不同[4]。首先鲤鱼大小为16.2 g左右, 本实验异育银鲫128.6 g左右,斑点叉尾159.4 g左右, 鱼的规格不同,对铜的耐受性不同; 其次鲤鱼的养殖环境是实验室水族箱,本实验是在池塘网箱中进行的,所以水温、溶氧等水化指标不同也是造成差异的原因。
SOD作为一种抗氧化酶在细胞免除自由基的损害中起着重要的作用[30]。在本实验中, 随着饲料中铜的浓度的增加, 斑点叉尾血清中 Cu-Zn SOD酶活性具有先升高后下降的趋势, 但没有受到显著影响, 异育银鲫血清中 Cu-Zn SOD酶活性也没有显著差异。相反的研究结果也见于之前的报道, Wang, et al.[31]对皱纹盘鲍(Haliotis discus hannai Ino)的研究得出, 随着饲料中铜浓度的增加, 血清 Cu-Zn SOD 酶先升高后下降, 且差异显著。造成结果的差异也许是因为饲养周期、体重、鱼的种类不同造成的。皱纹盘鲍饲养周期24周,本实验养殖周期为 4周, 这说明实验周期短不足以影响鱼类的血液生理; 皱纹盘鲍属于单壳软体动物,鱼的体重是0.6 g左右, 本实验异育银鲫(128.6 g左右)属于杂食性鱼类, 斑点叉尾(159.4 g)属于肉食性鱼类, 鱼的食性、体重不同对铜的耐受性不同,这也是造成结果差异的原因。

图5 实验结束时异育银鲫和斑点叉尾摄食不同铜水平饲料肌肉(A)、肝脏(B)和鱼体(C)中含量Fig. 5 Effect of dietary copper levels on muscle, liver and fish body Cu concentration of gibel carp and channel catfish at the end of the experiment
[1] Sun S, Qin J, Yu N, et al. Effect of dietary copper on the growth performance, non-specific immunity and resistance to aeromonas hydrophila of juvenile Chinese mitten crab, Eriocheir sinensis [J]. Fish and Shellfish Immunology, 2013, 34(5): 1195—1201
[2] Jenkins N K, Morris T R, Valamotis D. The effect of diet and copper supplementation on chick growth [J]. British Poultry Science, 1970, 11(2): 241—248
[3] Berntssen M H G, Lundebye A K, Maage A. Effects of elevated dietary copper concentrations on growth, feed utilisation and nutritional status of Atlantic salmon (Salmo salar) fry [J]. Aquaculture, 1999, 174(1—2): 167—181
[4] Clearwater S J, Farag A M, Meyer J S. Bioavailability and toxicity of dietborne copper and zinc to fish [J]. Comparative Biochemistry and Physiology Part C: Toxicology and Pharmacology, 2002, 132(3): 269—313
[5] Dethloff G M, Bailey H C, Maier K J. Effects of dissolved copper on select hematological, biochemical, and Immunological parameters of wild rainbow trout (Oncorhynchus mykiss) [J]. Archives of Environmental Contamination and Toxicology, 2001, 40(3): 371—380
[6] Dautremepuits C, Marcogliese D J, Gendron A D, et al. Gill and head kidney antioxidant processes and innate immune system responses of yellow perch (Perca flavescens) exposed to different contaminants in the St. Lawrence River, Canada [J]. Science of The Total Environment, 2009, 407(3): 1055—1064
[7] Carvalho C S, Fernandes M N. Effect of temperature on copper toxicity and hematological responses in the neotropical fish Prochilodus scrofa at low and high Ph [J]. Aquaculture, 2006, 251(1): 109—117
[8] Jarup L. Hazards of heavy metal contamination [J]. British Medical Bulletin, 2003, 68(1): 167—182
[9] Apel K, Hirt H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction [J]. Annual Review of Plant Biology, 2004, 55(1): 373—399
[10] Guo T F, Huang X S, Su M, et al. Effects of dietary copper levels on the immunity, vibrio-resistant ability, lysozyme mRNA and Toll receptor mRNA expressions in the white shrimp, Litopenaeus vannamei [J]. Acta Hydrobiologica Sinica, 2012, 36(5): 809—816 [郭腾飞, 黄旭雄, 苏明, 等.饲料中铜水平对凡纳滨对虾免疫相关基因表达和抗菌能力的影响. 水生生物学报, 2012, 36(5): 809—816]
[11] Shaw B J, Handy R D. Dietary copper exposure and recovery in Nile tilapia, Oreochromis niloticus [J]. Aquatic Toxicology, 2006, 76(2): 111—121
[12] Kim S G, Kang J C. Effect of dietary copper exposure on accumulation, growth and hematological parameters of the juvenile rockfish, Sebastes schlegeli [J]. Marine Environmental Research, 2004, 58(1): 65—82
[13] Kamunde C N, Grosell M, Lott J N A, et al. Copper metabolism and gut morphology in rainbow trout (Oncorhynchus mykiss) during chronic sublethal dietary copper exposure [J]. Canadian Journal of Fisheries and Aquatic Sciences, 2001, 58(2): 293—305
[14] Gui J F, Zhou L. Genetic basis and breeding application of clonal diversity and dual reproduction modes in polyploid Carassius auratus gibelio [J]. Science China Life Sciences, 2010, 53(4): 409—415
[15] Duan Y H, Zhu X M, Han D, et al. Dietary vitamin K requirement of juvenile gibel carp, Carassius auratus gibelio [J]. Acta Hydrobiologica Sinica, 2013, 37(1): 8—15 [段元慧,朱晓鸣, 韩冬, 等. 异育银鲫幼鱼对饲料中维生素 K 需求的研究. 水生生物学报, 2013, 37(1): 8—15]
[16] Wang K Y, Huang J L, Xiao D, et al. The immunoprotection effect of stenotrophomonas maltophilia lipopolysaccharide in channel catfish, Ictalurus punctatus [J]. Acta Hydrobiologica Sinica, 2012, 36(3): 433—440 [汪开毓, 黄锦炉, 肖丹, 等.嗜麦芽寡养单胞菌脂多糖对斑点叉尾免疫保护作用.水生生物学报, 2012, 36(3): 433—440]
[17] AOAC. Official Methods of Analysis [A]. 14th edn. Washington D C: Association of Official Analytical Chemists. 1984, 152—163
[18] Handy R D, Sims D W, Giles A, et al. Metabolic trade-off between locomotion and detoxification for maintenance of blood chemistry and growth parameters by rainbow trout (Oncorhynchus mykiss) during chronic dietary exposure to copper [J]. Aquatic Toxicology, 1999, 47(1): 23—41
[19] Özmen B, Özmen D, Erkin E, et al. Lens superoxide dismutase and catalase activities in diabetic cataract [J]. Clinical Biochemistry, 2002, 35(1): 69—72
[20] Gatlin D M, Wilson R P. Dietary copper requirement of fingerling channel catfish [J]. Aquaculture, 1986, 54(4): 277—285
[21] Dezfuli B, Giari L, Simoni E, et al. Histopathology, immunohistochemistry and ultrastructure of the intestine of leuciscus cephalus naturally infected with pomphorhynchus laevis (Acanthocephala) [J]. Journal of Fish Diseases, 2002, 25(1): 7—14
[22] Hoyle I, Shaw B J, Handy R D. Dietary copper exposure in the African walking catfish (Clarias gariepinus): transient osmoregulatory disturbances and oxidative stress [J]. Aquatic Toxicology, 2007, 83(1): 62—72
[23] De Boeck G, Vlaeminck A, Blust R. Effects of sublethal copper exposure on copper accumulation, food consumption, growth, energy stores, and nucleic acid content in common carp [J]. Archives Environmental Contamination and Toxicology, 1997, 33(4): 415—422
[24] Lundebye A K, Berntssen M H G, Bonga S E W, et al.Biochemical and physiological responses in atlantic salmon (Salmo salar) following dietary exposure to copper and cadmium [J]. Marine Pollution Bulletin, 1999, 39(1—12): 137—144
[25] Mustafa S A, Davies S J, Jha A N. Determination of hypoxia and dietary copper mediated sub-lethal toxicity in carp (Cyprinus carpio) at different levels of biological organisation [J]. Chemosphere, 2012, 87(4): 413—422
[26] Samanta B, Biswas A, Ghosh P R. Effects of dietary copper supplementation on production performance and plasma biochemical parameters in broiler chickens [J]. British Poultry Science, 2011, 52(5): 573—577
[27] Atli G, Canli M. Natural occurrence of metallothionein-like proteins in the liver of fish oreochromis niloticus and effects of cadmium, lead, copper, zinc, and Iron exposures on their profiles [J]. Bulletin of Environmental Contamination and Toxicology, 2003, 70(3): 619—627
[28] De C C, Petit-Ramel M, Faure R, et al. Kinetics of cadmium accumulation and elimination in carp (Cyprinus carpio) tissues [J]. Comparative Biochemistry and Physiology Part C: Pharmacology, Toxicology and Endocrinology, 1999, 122(3): 345—352
[29] Roche H, Bogé G. Fish blood parameters as a potential tool for identification of stress caused by environmental factors and chemical intoxication [J]. Marine Environmental Research, 1996, 41(1): 27—43
[30] Fang Y Z, Yang S, Wu G Y. Free radicals, antioxidants, and nutrition [J]. Nutrition, 2002, 18(10): 872—879
[31] Wang W F, Mai K S, Zhang W B, et al. Effects of dietary copper on survival, growth and immune response of juvenile abalone, Haliotis discus hannai Ino [J]. Aquaculture, 2009, 297(1—4): 122—127
EFFECTS OF DIETARY COPPER AT DIFFERENT CONCENTRATIONS ON GIBEL CARP AND CHANNEL CATFISH
CHONG Xiang-Yu1,2, ZHOU Li-Zhi1, HAN Dong2,3, ZHU Xiao-Ming2,YANG Yun-Xia2, JIN Jun-Yan2, and XIE Shou-Qi2
(1. School of Resources and Environmental Engineering, Anhui University, Hefei 230601, China; 2. State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 3. Freshwater Aquaculture Collaborative Innovation Center of Hubei Province, Wuhan 430070, China)
Experiments were conducted for 4 weeks to investigate the effect of dietary copper at different levels on the growth, feed utilization, hematological parameters and the copper accumulation in gibel carp (Carassius auratus gibelio) CAS III [initial body weight of (128.6±2.0) g] and channel catfish (Ictalurus punctatus)[initial body weight of (159.4±2.0) g]. Seven semipurified diets were supplemented with dietary copper (CuSO4·5H2O) at graded levels (3.1, 7.5, 49.8, 100.5, 506.9, 965.1 and 1491.1 mg/kg diet). The results showed that feeding rate (FI) of gibel carp was not aftected by the increase in the dietary copper concentration (P>0.05); in the contrast the specific growth rate (SGR) significantly decreased. The SGR reached the lowest value when dietary copper concentration was 1491.1 mg/kg (P<0.05). The feed efficiency (FE) showed a similar trend to the SGR. The viscerosomatic index (VSI) and the hepatosomatic index (HSI) also significantly decreased along with the increase in the dietary copper level (P<0.05), but the condition factor (CF) was not affected (P>0.05). The activity of the serum glutamie-oxalacetic transaminase (GOT) was the lowest when dietary copper concentration was 7.5 mg/kg (P<0.05). However, the concentration of the dietary copper did not affect hematocrit (Hct), hemoglobin (Hb), and the activities of serum glutamic-pyruvic transaminase (GPT) and copper-zinc superoxide dismutase (Cu-Zn SOD) (P>0.05). As the concentration of the dietary copper increased, the copper accumulation in the liver and the fish body was significantly elevated accordingly (P<0.05), but the accumulation in fish muscles was not affected (P>0.05). Similarly in channel catfish the FI was not aftected by the concentration of the dietary copper rose (P>0.05); the SGR showed an apparent but non-significant decrease (P>0.05); the FE dropped along with the increase in the dietary copper level (P<0.05); the HSI and the CF significantly decreased as well (P<0.05); but the VSI was not affected by the concentration of the dietary copper (P>0.05). In channel catfish, except for Hct (P<0.05) the dietary copper level did not affect the activities of serum GPT, GOT, Cu-Zn SOD and Hb. The copper accumulation in channel catfish showed a similar trend to gibel carp. In conclusion, dietary copper at high concentrations could decrease the growth and feed utilization in gibel carp and channel catfish, and channel catfish could be more sensitive than gibel carp.
Gibel carp; Channel catfish; Copper; Growth; Hematological immunity; Copper accumulation
S963.73
A
1000-3207(2014)04-0751-13
10.7541/2014.106
2014-03-04;
2014-05-01
“饲料高效低耗加工技术研究与示范” 公益性行业(农业)科研专项(201203015); 现代农业产业技术体系-大宗淡水鱼类产业技术体系–鲫鱼营养需求与饲料岗位(CARS-46-19); 水产养殖动物营养需求与高效配合饲料开发公益性行业(农业)科研专项(201003020)资助
种香玉(1986—), 女, 河南濮阳人; 硕士研究生; 研究方向为鱼类生理生态学。E-mail: chongxiangyu @126.com
解绶启, E-mail: sqxie@ihb.ac.cn

