邻苯二甲酸二乙基己酯对鲤非特异性免疫的影响及遗传毒性
张贵生
(菏泽学院生命科学系, 菏泽 274015)
邻苯二甲酸二乙基己酯对鲤非特异性免疫的影响及遗传毒性
张贵生
(菏泽学院生命科学系, 菏泽 274015)
以水和吐温–80为对照, 用5、20、80、160 mg/L的邻苯二甲酸二乙基己酯(DEHP)对鲤染毒20d, 研究了DEHP对鲤非特异性免疫功能的影响及遗传毒性。结果表明: 吐温–80组与水对照组相比除红细胞总核异常率显著升高外, 所测定的各项指标差异均不显著。80、160 mg/L组白细胞吞噬活力、吞噬指数, 血清抗菌活力, 溶菌酶活性均显著低于水对照组和吐温–80组(P<0.05或P<0.01), 且20 mg/L组白细胞吞噬活力、吞噬指数显著低于水对照组。与吐温–80组相比, 160 mg/L组血清C3含量显著降低, 5、20、80 mg/L组C3含量, 5、20、80、160 mg/L组C4含量则无显著性差异。20、80、160 mg/L组C3含量, 160 mg/L组C4含量显著低于水对照组(P<0.05或P<0.01)。160 mg/L组红细胞微核率显著高于吐温–80组, 80、160 mg/L组红细胞微核率显著高于水对照组。在DEHP实验浓度范围内, 红细胞核异常率、总核异常率, 肝细胞DPC系数均显著高于水对照组和吐温–80组。一定浓度的DEHP对鲤具有免疫毒性和遗传毒性。
邻苯二甲酸二乙基己酯; 鲤; 白细胞; 溶菌酶; 抗菌活力; 补体; 微核; DNA-蛋白质交联
邻苯二甲酸二乙基己酯(Di-(2-ethylhexyl) phthalate, DEHP )是应用量最大, 使用最广泛的一种钛酸酯类化合物(PAEs), 由于其易从塑料中转移出来,污染外界环境, 在大气、土壤、食品、饮用水、河流中均检测到了此类物质的存在, 因此DEHP对生物体的致毒效应也越来越被人们所重视。有研究表明, DEHP具神经毒性[1]、胚胎发育毒性[2]、生殖毒性[3, 4], 并引发哮喘[5]。据报道,DEHP 含量在不同水域中含量均最高, 但DEHP对水生生物的毒性效应研究相对较少, 有研究表明, DEHP可导致斑马鱼胚胎畸形, 孵化率降低[6]等。但DEHP对免疫系统及鱼类的遗传毒性效应少见报道, 因此, 本研究选用在我国分布最为广泛的鲤(Cyprinus carpio Linnaeus)作为受试动物, 研究DEHP对鲤白细胞吞噬能力、血清抗菌活力、溶菌酶活性、补体C3、C4含量的影响,研究DEHP对红细胞微核率及肝细胞DNA-蛋白质交联效应的影响, 目的是探讨DEHP对鱼类非特异性免疫的影响及遗传毒性, 这在国内外均未见报道,期望能为DEHP的科学应用, 探讨其对鱼类的毒性作用机理提供科学依据。
1 材料与方法
1.1 实验动物
鲤(Cyprinus carpio Linnaeus), 菏泽市牡丹区鱼苗养殖场提供, 体重(68.62±3.18) g, 体长(14.95± 0.62) cm, 在室温条件下驯养10d。
1.2 仪器及主要试剂
邻苯二甲酸二乙基己酯(DEHP)、吐温–80均为国产分析纯, 金葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)(菏泽市防疫站提供), 补体C3、C4试剂盒(浙江伊利康生物技术有限公司), 溶菌酶检测试剂盒(南京建成生物工程研究所), Hoechst33258荧光染料(BIOSHARP公司), 小牛胸腺 DNA(上海源叶生物科技有限公司), 蛋白酶K(SIGMA公司), 荧光分光光度计(日立 F-4500) ,低温冷冻离心机(Eppendorf-5417R), 紫外可见分光光度计(北京普析 TU-1810), 自制玻璃缸(120 cm× 80 cm×60 cm)等。
1.3 实验方法
实验动物的处理 实验共分6 组, 水对照组(不添加吐温–80及DEHP), 吐温–80对照组和5、20、80、160 mg/L 的DEHP组(DEHP先用吐温–80助溶,配制成120 g/L的母液, 各DEHP处理组均用DEHP母液配制, 吐温–80对照组及各DEHP组吐温–80含量均为80 mg/L, 符合中国药典(CP2005)添加标准),实验在玻璃缸内进行, 缸内处理液均为102 L, 每组设 3个平行组, 每组鲤 30尾, 实验用水为曝气 2d以上的自来水, 水质符合中国渔业水质标准(GB 11607—89), 水温(21±1)℃ , 溶氧量大于6 mg/L, pH 6.5—7.0, 充氧机不间断充氧, 自然光照, 每天 8: 00am饲喂一次(饲料购自江苏先驱饲料科技有限公司),投喂量以20min内摄食完毕, 无剩余为标准, 2d换水一次, 每次换去 1/3水量(在处理液 1/3的玻璃缸处做一标记, 换处理液时, 用小型水泵抽出致标记处, 同时把食物残渣和代谢废物吸出, 然后再加入与本组相同浓度的处理液致102 L处), 将鲤浸泡染毒20d。
样品的采集和制备 染毒20d, 随机从每组各取鲤12尾, 尾静脉处采血, 6尾取血液置于抗凝EP管中, 用于白细胞吞噬功能的检测, 一部分分别涂片用于红细胞微核率的检测。6尾取血液分别置于无菌EP管中, 于4℃冰箱中放置6h, 1000 r/min离心15min 取血清, 用于溶菌酶活力、补体C3、C4含量及血清抗菌活力的测定, 解剖鲤取肝脏用于DPC交联系数的测定。金黄色葡萄球菌的制备: 用5%的福尔马林对收集的金黄色葡萄球菌在37℃条件下灭活24h, 生理盐水洗涤3次, 再用生理盐水将其浓度调整至l×108个/mL, 用作检测白细胞吞噬功能的吞噬菌体。
1.4 非特异性免疫指标的测定
白细胞吞噬能力的测定 将 0.2 mL抗凝血及0.1 mL 灭活的金黄色葡萄球菌悬液加入到EP管中, 摇匀, 25℃孵育1h, 2000 r/min离心10min, 取血浆与红细胞交界面的白细胞做涂片, 自然晾干, 甲醇固定, Giermsa染色 30min, 水洗, 显微镜油镜下随机观察 100个多形核白细胞, 记下吞噬菌体的白细胞数及吞噬菌体的数量, 计算吞噬率(PP)和吞噬指数(PI)。
PP(%)=(100个白细胞中参与吞噬菌体的白细胞数/100)×100;
PI=被吞噬的细菌数/吞噬细菌的细胞数。
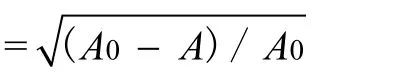
DEHP对鲤血清溶菌酶活性测定 以溶壁微球菌冻干粉为底物, 严格按照试剂盒提供的实验方法进行。

DEHP 对鲤血清补体C3、C4含量的测定 C3、
C4含量测定严格按照试剂盒提供的实验方法进行。
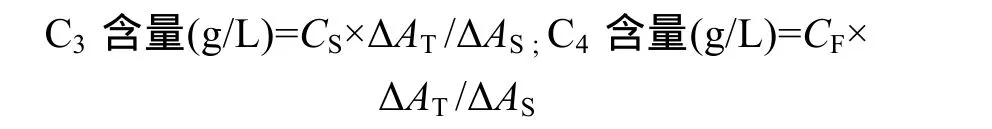
ΔAT以空白管吸光度作对照的样品管吸光度值; ΔAS以空白管吸光度作对照的校准管吸光度值; CS校准液中C3的浓度; CF校准液中C4的浓度。
1.5 遗传毒性指标的测定
DEHP对鲤红细胞微核率及核异常率的测定每组各取鱼6尾, 断尾取血, 涂片, 每组制备18 张血涂片, 自然晾干, 甲醇固定, 瑞氏染色, 油镜下观察、每个涂片至少观察3000个以上的红细胞, 记录观察的红细胞数, 具微核及核异常的红细胞数, 以千分率表示微核率、核异常率和总核异常率。
微核率=微核细胞总数/观察的红细胞总数× 1000‰; 核异常率=核异常的细胞总数(微核细胞数除外)/观察的红细胞总数×1000‰; 总核异常率=微核率+核异常率
DPC交联系数的测定 采用 KCl-SDS沉淀法, 参考徐钱等和潘鲁青等[8,9]方法, 每组随机取 6尾鲤, 解剖, 取肝脏, 用眼科剪剪成糜状(约 1 mm3的组织块), 3—4层擦镜纸过滤, 用PBS (pH=7.5)制成肝细胞悬液, 血球计数仪计数, 使细胞数达到1.5×106个/mL, 取0.5 mL该悬液于2 mL EP管内, 1800 r/min离心5min, 去掉上清液, 用0.5 mL PBS (pH=7.5)重悬浮细胞。细胞的裂解: 将0.5 mL 2%的SDS溶液加入具肝细胞悬液的 EP管中, 轻微振荡,于 65℃水浴中 10min, 裂解细胞。游离 DNA和交联DNA的分离: 向裂解细胞的EP管内加入100 µL 1.0 mol/L的KCl (用20 mmol/L、pH=7.5的Tris-HCl溶液配制)溶液。将混合液6次穿过1 mL聚丙烯枪头, 冰上放置 5min, 形成大量白色沉淀后, 12000 r/min离心10min, 收集沉淀, 上清液(游离态DNA)转入一干净离心管(5 mL)中.再加入 1 mL的清洗缓冲液(0.1 mol/L KCl, 0.1 mmol/L EDTA, 20 mmol/L Tris-HCl, pH=7.5), 重悬浮沉淀, 65℃水浴加热10min, 冰上骤冷 5min, 如前述离心, 如此清洗 3次, 每次都将上清转入上述 5 mL离心管中。最终的沉淀重悬浮于0.5 mL的清洗缓冲液中, 然后加入0.5 mL的蛋白酶K (0.4 mg/mL, 溶于清洗缓冲液中配制), 50℃消化3h, 从水浴中取出, 冰上骤冷 5min, 13000 r/min 4℃离心 10min收集上清液(其中包括 DPC中的DNA)。并加入1 mL新鲜配制的400 ng/mL的荧光染料Hoechst33258, 使终浓度为200 ng/mL, 置于暗处30min。
DPC系数的计算: 制作DNA浓度的标准曲线:用清洗缓冲液配制终浓度分别为0、100、300、500、750、1000、1500、2000、3000、5000 ng/mL的小牛胸腺DNA标准液, 紧接着加入1 mL新鲜配制的400 ng/mL的荧光染料 Hoechst33258, 使终浓度为200 ng/mL, 置于暗处30min。用F-4500型荧光分光光度仪在353 nm激发光和455 nm发射光下测得各浓度的荧光值, 制备标准曲线(图5)。将染色后的样品用F-4500型荧光分光光度计测定其荧光值, 根据标准曲线来定量交联 DNA和自由 DNA, 再计算DPC系数。DPC=交联DNA/(交联DNA+自由DNA)
1.6 实验数据的处理与统计分析
试验数据以平均值±标准差(n=6)表示。利用SPSS软件在对照组和吐温–80组间, 对照组、吐温–80组和各DEHP染毒组间进行单因素方差分析(ANOVA), 两两比较采用最小显著差数法(LSD), P<0.05表示差异显著, P<0.01表示差异极显著。
2 结果与分析
2.1DEHP对鲤非特异性免疫功能的影响
DEHP对鲤白细胞吞噬能力的影响 表1显示, 吐温–80组与对照组之间, 5 mg/L DEHP组与水对照组和吐温–80组之间吞噬百分率及吞噬指数差异均不显著。20、80 mg/L组与水对照组相比, 显著降低了吞噬百分率和吞噬指数, 但20 mg/L组与吐温–80组相比差异不显著, 80 mg/L组较吐温–80组表现为显著降低, 160 mg/L组较水对照组和吐温–80组表现为极显著降低(P<0.01)。这说明, 较低浓度的DEHP对血液白细胞吞噬能力影响不显著, 较高浓度的DEHP则能显著降低血液白细胞的吞噬能力。
DEHP对鲤血清抗菌活力的影响 图1显示,吐温–80组较水对照组血清抗菌活力略有增强, 但差异不显著。80、160 mg/L DEHP组血清抗菌活力与水对照组和吐温–80组相比均显著降低(P<0.05),但5、20 mg/L 组与水对照组和吐温–80组相比差异不显著(P>0.05)。这说明较高剂量的 DEHP能显著降低鲤的血清抗菌活力。
DEHP对鲤血清溶菌酶活力的影响 图2显示, 吐温–80组与水对照组之间, 血清溶菌酶活力无显著性差异。5、20 mg/L DEHP组与水对照组和吐温–80组相比, 血清溶菌酶活力无显著性变化,但80、160 mg/L组血清溶菌酶活力均显著低于水对照组和吐温–80组。这说明较低浓度的DEHP对鱼类血清溶菌酶活力影响不显著, 较高浓度的 DEHP则能显著降低鲤血清溶菌酶活力。
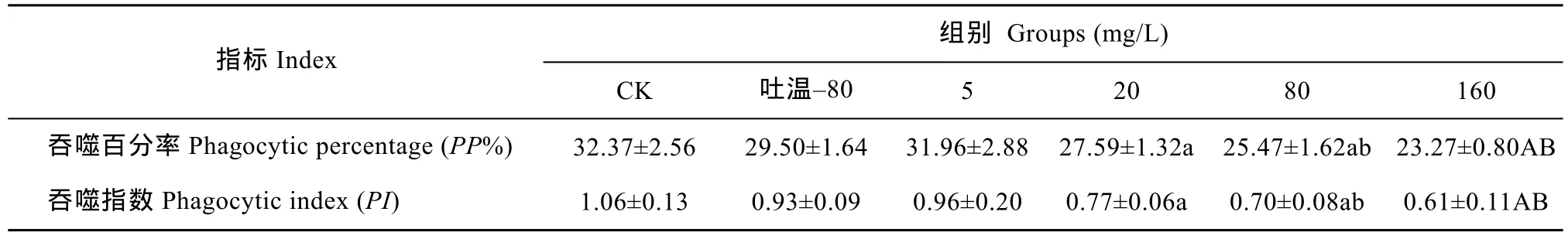
表1 DEHP对鲤白细胞吞噬能力的影响Tab. 1 Effects of DEHP on leucocyte phagocytic ability of carps
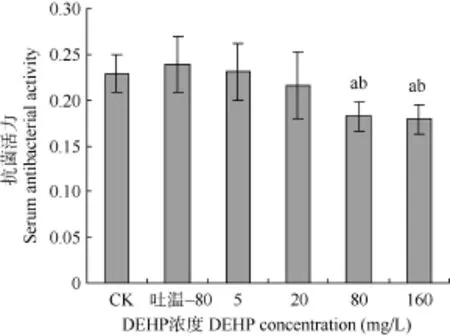
图 1 DEHP对鲤血清抗菌活力的影响Fig. 1 Effects of DEHP on serum antibacterial activity of carps

图2 DEHP对鲤血清溶菌酶活力的影响Fig. 2 Effect of DEHP on lysozyme activity of serum of carps
DEHP对鲤血清补体C3、C4含量的影响 图3、图4显示, 吐温–80组血清C3、C4含量均有所降低, 但与水对照组相比, 差异均不显著。图3可看出,与水对照组相比, 5 mg/L DEHP组补体C3含量略有上升, 但差异不显著, 20、80 mg/L组显著降低(P<0.05), 160 mg/L组极显著降低(P<0.01)。血清补体C4含量与水对照组相比, 5、20、80 mg/L组差异不显著, 但160 mg/L组显著降低(P<0.05)。与吐温–80组相比, 5、20、80 mg/L组血清C3含量变化不明显, 但160 mg/L组显著降低(P<0.05)。图4显示,在DEHP实验浓度范围内, 与吐温–80组相比, 血清C4含量均无显著性变化。这说明, 较高浓度的DEHP能显著降低血清 C3、C4含量, 其中助溶剂吐温–80对血清C3、C4含量的影响也可能起着一定的作用。
2.2DEHP对鲤遗传毒性的影响
DEHP对鲤红细胞微核及核异常的影响 表2显示, 与水对照组相比, 吐温–80并不能显著影响鲤红细胞微核率和核异常率, 但却显著降低了总核异常率。与水对照组相比, 5、20 mg/L组微核率无显著性变化, 80、160 mg/L组鲤红细胞微核率显著升高。但与吐温–80组相比只有160 mg/L组显著提高了红细胞微核率, 其他较低剂量的 DEHP组影响则不显著。表2还显示, 在DEHP实验剂量范围内,其红细胞核异常率和总核异常率与水对照组相比均极显著升高(P<0.01), 与吐温–80组相比, 除5 mg/L组显著升高外, 其他较高浓度的DEHP组也均极显著升高。这说明, 较高浓度的 DEHP对鲤具有较强的遗传毒性, 其中吐温–80 也可能具有一定的协同作用。
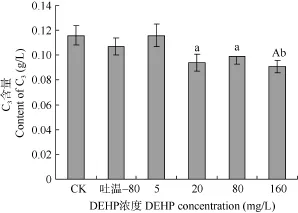
图3 DEHP对鲤血清补体C3含量的影响Fig. 3 Effect of DEHP on content of complement C3in serum of carps
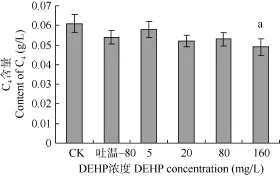
图 4 DEHP对鲤血清补体C4含量的影响Fig. 4 Effect of DEHP on content of complement C4in serum of carps
DEHP致鲤肝脏细胞DPC交联系数的影响图 5为小牛胸腺 DNA的标准曲线, y=0.1342x+ 48.803(R2=0.9958)。图6显示, 吐温–80组与水对照组相比, DNA-蛋白质交联系数虽略有上升, 但差异不显著。在 DEHP实验剂量范围内, 与水对照组和吐温–80组相比, DEHP均能极显著提高DNA-蛋白质的交联系数, 即 DEHP能显著诱导 DNA-蛋白质的交联。
3 讨论

表2 DEHP对鲤红细胞微核率及核异常率的影响Tab. 2 Effect of DEHP on micronucleus and nuclear abnormality of erythrocytes in carps
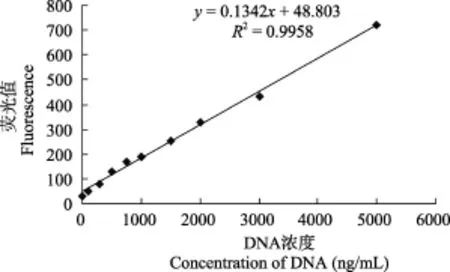
图 5 DNA浓度的标准曲线Fig. 5 Standard curve of DNA concentration
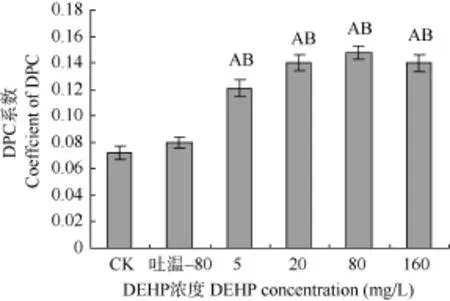
图 6 DEHP 对鲤肝脏细胞DPC的效应Fig. 6 DPC formation in hepatocyte of carps induced by DEHP
鱼类属于较低等的脊椎动物, 其特异性免疫机质还很不完善, 因此, 非特异性免疫在鱼类的免疫防御中发挥着重要作用[10]。在机体免疫防御中, 白细胞能吞噬进入机体的异物, 在非特异性免疫系统中发挥着重要作用[11,12]。血清中补体、溶菌酶、干扰素等也是构成非特异性免疫系统的重要组成部分,能抵抗外来病原菌的入侵, 具有抗菌杀菌能力, 反应了机体非特异性免疫应答能力[13]。溶菌酶是一种碱性蛋白, 广泛存在于鱼的体表黏液、血清及巨噬细胞中, 能破坏和消除入侵体内的异物, 其活性会因外界环境因子的影响而表现为应激或抑制[14], 一定程度上反映了病原菌及环境因素对鱼体健康状况的影响[15,16]。 本研究结果表明, 在DEHP对鲤染毒20d时, 与吐温–80组相比, 80、160 mg/L DEHP 组均能显著降低鲤白细胞的吞噬活力、吞噬指数及溶菌酶活性, 而5、20 mg/L DEHP 组则影响不显著。较高浓度的DEHP能通过降低白细胞的吞噬能力、血清溶菌酶活性而降低鱼类的非特异性免疫功能。这和李蕾等[17]报道的邻苯二甲酸二丁酯(DBP)能显著降低小鼠腹腔巨噬细胞的吞噬能力相一致, 其研究还表明, DBP降低巨噬细胞的吞噬能力是因为DBP显著降低了巨噬细胞清道夫受体CD36的表达所致。DEHP是DBP的同系物, 其降低白细胞的吞噬能力的机理可能和DBP的作用机理一致。溶菌酶来自于单核细胞、中性粒细胞, 较高剂量的DEHP能致溶菌酶活性降低, 也许是因为, DEHP对机体有损伤作用,随DEHP剂量的增高, 细胞受到破坏, 溶菌酶分泌不足, 或结构发生变化, 导致溶菌酶活性降低, 其作用机制还需进一步研究。
补体是非特异性免疫系统中的重要组成部分,具有中和毒素、清除病菌等重要生物学功能[18], 其中补体C3含量最高, 在补体激活旁路中起关键作用, 补体C4是参与经典途径和凝集素途径活化的重要因子, 血清补体C3、C4含量水平在一定程度上反映了机体免疫病理性损伤状况[19]。一般来说, 机体内补体分子约90%是由肝脏产生, 在正常生理状态下, 其C3、C4浓度保持相对稳定, 若其含量降低,主要有两个原因: 合成减少和消耗增加[20]。本实验结果表明, 在DEHP实验浓度范围内, C4含量, 5、20、80 mg/L组补体C3含量与吐温–80组相比差异均不显著, 但160 mg/L组补体C3含量却显著降低。这可能是因为, DEHP虽能引起C3、C4的大量消耗, 但肝脏产生补体的功能强大, 消耗的补体得以补偿, 所以差异不显著。但DEHP浓度较高时, 肝脏可能受到了损伤[21], 产生补体的能力减弱, 所以C3含量显著降低, 其机理还有待进一步深入研究。抗菌活力是细胞和体液免疫的综合体现, 反映了机体对病原微生物侵染的防御能力[22]。本实验表明, 较高浓度的DEHP(80、160 mg/L)组血清抗菌活力显著降低, 这可能与血清溶菌酶活力、补体含量降低等密切相关。
微核是除主核之外, 存在于胞质中独立的微小核物质, 是细胞分裂后期, 带着丝粒染色体向纺锤体两极移动时, 无着丝点的染色体和染色体断片落后而形成[23]。微核率是有毒物质(如重金属离子、农药等)对细胞遗传物质损伤的重要指标, 可用来评价水域污染物对鱼类的遗传毒性效应[24]。本实验表明,较高浓度的DEHP(160 mg/L)能显著诱导红细胞微核的产生, 且在DEHP实验浓度范围内, 显著提高了核异常率和总核异常率, 这和王蕊等[25]报道的DEHP能显著提高小鼠红细胞微核率的实验结果相一致。这说明一定浓度的DEHP可能会对染色体或纺锤丝的形成有毒害作用。
DNA和蛋白质的交联程度也是检测有毒物质是否具有遗传毒性的重要指标。一般认为, DNA和蛋白质一定程度的交联, 对维持细胞的正常活动是非常必要的, 如DNA和组蛋白的结合, 但是过量的DPC会引起DNA的构象和功能产生变化, 导致DNA损伤, 染色体断裂、基因突变, 从而导致严重的遗传毒性。此外, 它与癌症的发生也密切相关。本实验结果表明, 在DEHP实验浓度范围内, DEHP均能极显著诱导DNA和蛋白质的交联。这说明DEHP具有较强的遗传毒性, 这与DEHP能诱导赤子爱胜蚓体细胞[26]和小鼠肝细胞[27]DNA蛋白质交联的实验结果相一致。原因可能是DEHP在机体内降解能产生大量的羟自由基的结果, 羟自由基是诱发DPC的重要因素。微核实验和DPC交联实验的结果, 说明DEHP具有较强的遗传毒性。较低剂量的DEHP能引起DPC交联, 但不能显著提高微核率; 较高剂量的DEHP才诱导了微核率的显著升高, 说明DPC的交联发生在微核形成之前, 也说明DNA-蛋白质交联更能灵敏的反映毒物的遗传毒性。
在本实验研究结果中, 20 mg/L DEHP组白细胞吞噬率及吞噬指数、20、80 mg/L DEHP组补体C3含量, 160 mg/L组补体C4含量, 与吐温–80组相比差异不显著, 但均显著低于水对照组。160 mg/L 组补体C3含量显著低于吐温–80组, 却极显著低于水对照组。80 mg/L DEHP组红细胞微核率显著高于水对照组, 但与吐温–80组相比差异不显著, 吐温–80组总核异常率显著高于水对照组。这些实验结果均提示,吐温–80对鲤也可能具有一定的免疫毒性和遗传毒性, 而且在DEHP对鲤具有免疫和遗传毒性的实验结果中, 吐温–80也可能起到了一定的协同作用。吐温–80作为助溶剂对DEHP的致毒效应是否具有协同作用还有待进一步深入研究。
致谢:
实验期间, 菏泽学院生命科学系吴红松老师,朱道玉教授, 周长路、张红梅副教授给予了大量帮助, 谨致谢意。
[1] Chen L, Jiang L, Chen H S, et al. Influence of dibutyl phthalate on development of hippocampus nervous cells of rat's offspring [J]. Chinese Journal of Industrial Hygiene and Occupational Diseases, 2010, 28(7): 530—533 [陈龙, 蒋莉,陈恒胜, 等. 邻苯二甲酸二丁酯对子代大鼠海马神经细胞发育的影响. 中华劳动卫生职业病杂志, 2010, 28(7): 530—533]
[2] Faber W D, Deyo J A, Stump D G, et al. Developmental toxicity and uterotrophic studies with di-2-ethylhexyl terephthalate [J]. Birth Defects Research part BDevelopmental and Reproductive Toxicology, 2007, 80(5): 396—405
[3] Liu D Y, Wu S D, Hua Y, et al. Effect of di-2-(ethylhexy1) phthalate induced cryptorchidism on apoptosis of germ cells in infant SD rats [J]. Chinese Journal of Biologicals, 2013, 26(3): 368—371 [刘东尧, 吴盛德, 燚华 , 等. 邻苯二甲酸二(2-乙基) 己酯诱导隐睾对 SD 幼鼠睾丸生殖细胞凋亡的影响. 中国生物制品学杂志, 2013, 26(3): 368—371]
[4] Hayashi Y, Ito Y, Nakajima T. Relationship of maternal malnutrition caused by Di (2-ethylhexyl)phthalate exposure with lifestyle disease in offspring [J]. Nihon Eiseigaku Zasshi, 2012, 67(1): 22—25
[5] Qiao Y K, Wang K, Yan Y, et al. Effect of toxicity and asthma on di-(2-Ethythexyl) phthalate [J]. Chinese Journal of Public Health Engineering, 2006, 5(4): 236—238 [乔永康,王昆, 严彦, 等. 邻苯二甲酸二异辛酯的毒性和致哮喘作用. 中国卫生工程学, 2006, 5(4): 236—238]
[6] Li M M, Yu Z B, Han S P, et al. Oxic effect of di (2-ethylhexyl)-phthalate on zebrafish heart development [J]. Journal of Applied Clinical Pediatrics, 2013, 28(1): 48—51[李萌萌, 余章斌, 韩树萍, 等. 邻苯二甲酸二乙基己酯对斑马鱼胚胎心脏发育的毒性. 中华实用儿科临床杂志, 2013, 28(1): 48—51]
[7] Wang Y Y, Sun H S, Li G Y. The Effects of immuno drugson antibacterial and bacteriolytic activities in the haemolymph of Penaeus chinensis [J]. Advances in Marine Cience, 2004, 22(1): 69—72 [王宜艳, 孙虎山, 李光友. 复合免疫药物对中国对虾血淋巴抗菌溶菌活力的影响. 海洋科学进展, 2004, 22(1): 69—72]
[8] Xu Q, Yang X, Yang G T, et al. Study on DNA damage of the kidney cells of mice induced by formaldehyde at different doses [J]. Acta Scientiae Circumstantiae, 2007, 27(2): 276—281 [徐钱, 杨旭, 杨光涛, 等. 不同浓度甲醛致小鼠肾细胞DNA损伤效应研究. 环境科学学报, 2007, 27(2): 276—281]
[9] Pan L Q, Liu N, Wang J. Study of biomarkers selection of the scallop Chlamys farreri exposed to exposed to B[a]P [J]. Acta Hydrobiologica Sinica, 2012, 36(2): 299—306 [潘鲁青,刘娜, 王静. 栉孔扇贝在B[a]P胁迫下生物标志物筛选的研究. 水生生物学报, 2012, 36(2): 299—306]
[10] Ellis A E.Immunity to bacteria in fish [J].Fish & Shellfish Immunology, 1999, 9(4): 291—308
[11] Wang K Y, Huang J L, Xiao D, et al. The immunoprotection of Stenotrophomonas maltophilia lipopolysaccharide in channel catfish [J]. Acta Hydrobiologica Sinica, 2012, 36(3): 433—440 [汪开毓, 黄锦炉, 肖丹, 等. 嗜麦芽寡养单胞菌脂多糖对斑点叉尾 免疫保护作用. 水生生物学报, 2012, 36(3): 433—440]
[12] Yan Q P, Zhang J J, Zou W Z, et al. Effect of experimental infection with Vibrio alginolyticus on immune parameters of Pseudosciaena crocea [J]. Journal of Fisheries of China, 2007, 31(2): 250—256 [鄢庆枇, 张俊杰, 邹文政, 等. 人工感染溶藻弧菌对大黄鱼免疫功能的影响.水产学报, 2007, 31(2): 250—256]
[13] Tonk E C, Verhoef A, Gremmer E R, et al.Relative sensitivity of developmental and immune parameters in juvenile versus adult male rats after exposure to di(2-ethylhexyl)phthalate [J]. Toxicology and Applied Pharmacology, 2012, 260(1): 48—57
[14] Chen J Z, Zang X L, Meng S L, et al. Effect of nitrite nitrogen stress on the activities of nonspecific immune enzymes in serum of tilapia (GIFT Oreochromis niloticus) [J]. Ecology and Environment Sciences, 2012, 21(5): 897—901 [陈家长, 臧学磊, 孟顺龙, 等. 亚硝酸盐氮胁迫对罗非鱼(GIFT Oreochromis niloticus) 血清非特异性免疫酶活性的影响. 生态环境学报, 2012, 21(5): 897—901]
[15] Han Y, Zhang H, Wang K. Activity of SOD and GSH-Px in the blood of fingerling Cyprinus carpio under different nitrite concentration [J]. Freshwater Fisheries, 2007, 37(1): 66—68 [韩英, 张辉, 王琨. 亚硝态氮对鲤鱼种血液 SOD及GSH-Px的影响. 淡水渔业, 2007, 37(1): 66—68]
[16] Wang S R. Modern Animal Immunology [M]. Changchun: Jilin science and Technology Press. 1996, 116—117 [王世若.现代动物免疫学. 长春: 吉林科学技术出版社. 1996, 116—117]
[17] Li L, Li H S, Song N N, et al. Studies on the effect of dibutyl phthalate on the phagocytosis of macrophages [J]. Chinese Journal of Immunology , 2011, 27(9): 771—778 [李蕾, 李海山, 宋乃宁, 等. 邻苯二甲酸二丁酯对巨噬细胞吞噬能力的影响研究. 中国免疫学杂志, 2011, 27(9): 771—778]
[18] Wang Z P, Zhang S C, Wang G F. Advances on the complement components, characteristic and function of complement system in fish [J]. Acta Hydrobiologica Sinica, 2008, 32(5): 760—769 [王志平, 张士璀, 王光锋. 鱼类补体系统成分及补体特异性和功能的研究进展. 水生生物学报, 2008, 32(5): 760—769]
[19] Wang J Y, Fan H M, Liu Z M, et al. The clinical value of dynamic determination of serum complement C3and complement C4during perioperation of cardiopulmonary bypass surgery [J]. Journal of Tongji University (Medical Science), 2006, 27(4): 21—23 [汪进益, 范慧敏, 刘中民,等. 体外循环围术期患者血清补体C3, C4水平变化及临床意义. 同济大学学报(医学版), 2006, 27(4): 21—23]
[20] Zhu Q X, Xu H, Leng J, et al. Changes in humoral immunity in sensitized guinea pigs exposed to trichloroethylene [J]. Chinese Journal of Industrial Hygiene and Occupational Diseases, 2012, 30(9): 641—644 [朱启星, 徐辉, 冷静, 等.三氯乙烯致敏豚鼠体液免疫变化. 中华劳动卫生职业病杂志, 2012, 30(9): 641—644]
[21] Li S G, Zhao W H, Jin T Y. Effects of Di-2-ethylhexylphalate on viscera in mice [J]. Chinese Journal of Public Health, 2006, 22(5): 589—591[厉曙光, 赵文红, 金泰 . 邻苯二甲酸(2-乙基己基)酯对小鼠脏器损伤作用.中国公共卫生, 2006, 22(5): 589—591]廙
[22] Yang J Y, Guo L Y, Chen F S, et al. The effects of lipopolysaccharides from two strains of oligotrophic bacteria from antarctic ocean Alteromonas stellipolaris on non-specific immunity of the swimming crab Portunus trituberculatus [J]. Oceanologia et Limnologia Sinica, 2011, 42(2): 294—299 [杨季芳, 郭卢云, 陈福生, 等. 2株南极海洋寡营养细菌(Alteromonas stellipolaris)脂多糖对三疣梭子蟹(Portunus trituberculatus)非特异性免疫活性的影响.海洋与湖沼, 2011, 42(2): 294—299]
[23] Zhang G S, Zhu D Y. Study on micronuclei and nuclear abnormalities induced by Cu2+in Hemiculter leucisculus erythrocytes [J]. Journal of environment and Health, 2006, 23(6): 543—545 [张贵生, 朱道玉. 铜离子诱发 鲦鱼红细胞微核及核异常的研究. 环境与健康杂志, 2006, 23(6): 543—545]
[24] Ye J D, Han Y W, Yang Y H, et al. Effect of olaquindox on oxygen consumption, red blood cell number, hematocrit and dyskaryosis in erythrocytes in mirror carp Cyprinus carpio L. [J]. Journal of Dalian Fisheries University, 2003, 18(1): 14—18 [叶继丹, 韩友文, 杨雨辉, 等. 喹乙醇对鲤耗氧率、红细胞数、红细胞比积及红细胞微核率的影响. 大连水产学院学报, 2003, 18(1): 14—18]
[25] Wang R, Li H Q, Guo Q M, et al. Study on the mutagenicityand teratogenicity of DEHP [J]. Carcinogenesis, Teratogenesis and Mutagenesis, 2002, 14(2): 120—121 [王蕊, 李厚勇, 郭启明, 等. 邻苯二甲酸(2-乙基己基)酯致畸致突变实验研究. 癌变·畸变·突变, 2002, 14(2): 120—121]
[26] Zeng Q, Cheng W W, Cai F Y, et al. Oxidation Damage
Induced by Di-(2-ethylhexyl)phthlate on the cells of Esisenia foelide [J]. Asian Journal of Ecotoxicolog, 2010, 5(5): 718—723 [曾强, 程文文, 蔡凤云, 等. 邻苯二甲酸二异辛酯致赤子爱胜蚓体细胞氧化损伤的研究. 生态毒理学报, 2010, 5(5): 718—723]
[27] Wu K, Wang L M, Liu D D, et al. Study on DNA-protein crosslinks of mice liver induced by di-(2-ethylhexyl) phthalate [J]. Journal of Medical Research, 2006, 35(11): 13—16 [吴凯, 王黎明, 刘丹丹, 等. 邻苯二甲酸二异辛酯致小鼠肝DNA蛋白质交联效应研究. 医学研究杂志, 2006, 35(11): 13—16]
EFFECT OF DEHP ON NON-SPECIFIC IMMUNE FUNCTION AND GENETIC TOXICITY OF CYPRINUS CARPIO LINNAEUS
ZHANG Gui-Sheng
(Department of Life Sciences, Heze University, Heze 274015, China)
To study the effect of DEHP [Di-(2-ethylhexyl) phthalate] on the nonspecific immune function and genetic toxicity in Cyprinus carpio, four experimental concentrations of 5, 20, 80 and 160 mg/L of DEHP were treated to the C. Carpio for 20 days, H2O and Tween–80 were used as the controls respectively. The results showed that, when compared with the two controls, all indexes showed no significantly difference except the total nuclear abnormal rate in erythrocytes which significantly increased in the Tween–80 group. Phagocytic activity and index (PI) of leucocytes, antibacterial activity and lysozyme activity of serum in the 80, 160 mg/L of DEHP groups were significantly lower than those in the two controls, and also phagocytic activity and index (PI) of leucocytes in 20 mg/L group decreased remarkably (P<0.05 or P<0.01) when compared with the water control group. When compared with the tween–80 group, the C3content in serum of the 160 mg/L group decreased significantly. However, the C3content in the groups of 5, 20 and 80 mg/L, and the C4content in the groups of 5, 20, 80 and 160 mg/L showed no significantly differences. When compared with the water control group, the C3content in the groups of 20, 80 and 160 mg/L, and the C4content in the group of 160 mg/L decreased remarkably (P<0.05 or P<0.01). Micronuclei rate of erythrocytes in the group of 160 mg/L was significantly higher than that in the group of tween–80, and micronuclei rate of erythrocytes in the group of 80 and 160 mg/L was significantly higher than that in the water control group. In the range of the DEHP concentration, the rate of nuclear abnormalities and total nuclear abnormalities of erythrocytes and the DPC coefficient of hepatocyte all increased significantly when compared with the two control groups. The immune and genetic toxicity on carp can be caused by a certain concentration of DEHP.
Di-(2-ethylhexyl)phthalate(DEHP); Cyprinus carpio Linnaeus; Leucocyte; Lysozyme; Antibacterial activity; Complement; Micronucleus; DNA-protein cross-link
X171.5
A
1000-3207(2014)04-0729-08
10.7541/2014.103
2013-11-12;
2014-03-26
山东省自然科学基金(ZR2010CM046); 山东省动物生理生化与应用重点实验室项目(2011.06)资助
张贵生(1972—), 男, 山东定陶县人; 副教授, 硕士; 研究方向为鱼类生态毒理学。E-mail: zgz2007hzxy@126.com

