黑斑蛙变态过程中甲状腺发育及甲状腺激素分泌
葛雅楠李圆圆张银凤楼钦钦赵亚娴秦占芬
(1. 中国科学院生态环境研究中心, 北京 100085; 2. 福建农林大学, 福州 350002)
黑斑蛙变态过程中甲状腺发育及甲状腺激素分泌
葛雅楠1,2李圆圆1张银凤1楼钦钦1赵亚娴1秦占芬1
(1. 中国科学院生态环境研究中心, 北京 100085; 2. 福建农林大学, 福州 350002)
系统研究了我国本土两栖动物种黑斑蛙(Rana nigromaculata)变态发育过程中甲状腺组织学和甲状腺激素水平的变化, 为甲状腺生物学和甲状腺干扰研究提供基础数据。黑斑蛙蝌蚪发育的形态变化: 第26—40阶段, 后腿芽生长并逐渐分化出五趾结构; 42阶段, 开始进入变态高峰期, 前肢展开, 尾吸收, 蝌蚪身体发生巨大形变; 46阶段, 蝌蚪完全变态成小蛙。随着形态学的变化, 甲状腺的组织结构也发生明显的变化: 26—37阶段, 甲状腺体积较小, 增长缓慢; 38阶段甲状腺体积迅速膨大, 进入高峰期, 甲状腺的发育达到顶峰; 随着变态完成, 甲状腺又逐渐缩小。甲状腺组织学变化的同时, 甲状腺激素水平也相应发生变化: 在变态前期, 下颌中3,3’,5-三碘代-L-甲腺原氨酸(T3)水平增长缓慢, 进入变态期后, T3含量迅速升高, 在变态高峰期达到峰值, 随后下降。以上结果表明, 黑斑蛙发育过程中甲状腺组织学的变化与甲状腺激素水平的波动相吻合。对黑斑蛙甲状腺系统的研究, 可为日后使用黑斑蛙开展甲状腺干扰作用的研究提供基础。
黑斑蛙; 蝌蚪; 甲状腺; 甲状腺激素; 发育
两栖动物的变态发育过程受甲状腺激素调控,因此两栖动物一直被认为是研究甲状腺激素功能和信号通路的模式生物[1,2]。随着人们对环境污染物甲状腺干扰作用的日趋关注[3,4], 许多两栖动物种被用于甲状腺干扰的研究[5—8], 如国际通用种非洲爪蟾[9,10]、加拿大的牛蛙和豹蛙[11,12]、欧洲的林蛙[13,14]、日本的粗皮蛙[15,16]等。鉴于目前从国外进口非洲爪蟾存在一些问题, 开展我国本土两栖动物种的研究意义重大, 以期为甲状腺干扰及其他领域的研究提供更多基础数据。
黑斑蛙(Rana nigromaculata)是我国常见的一个两栖动物种, 部分学者对黑斑蛙的生物学[17—20]和毒理学[21,22]有过一定研究。然而目前还没有关于黑斑蛙变态发育过程中甲状腺发育和甲状腺激素分泌的报道, 也没有黑斑蛙变态发育过程中形态的描述。这些信息是开展黑斑蛙甲状腺干扰研究的生物学基础。本文系统研究了黑斑蛙变态发育过程中整体形态、甲状腺组织学以及甲状腺激素水平的变化,以推进黑斑蛙在甲状腺干扰研究中的应用。
1 材料与方法
1.1 黑斑蛙和蝌蚪的饲养
黑斑蛙成蛙饲养在动物房水陆两栖的玻璃缸中,每天清洗, 水温(23±2) , ℃ 明暗光周期为12h 12h∶ 。成蛙每天喂食添加胡萝卜的面包虫1次。成年雌蛙雄蛙各注射15 μg 促黄体素释放激素A3(LHRH-A3)和人绒毛膜促性腺激素[雌蛙 300国际单位(IU), 雄蛙 200 IU], 两种激素均用质量分数为 0.6%的生理盐水配制, 放入两栖动物诱导繁育设备中, 诱导其抱对产卵。
受精卵放入去氯水中孵化, 4d后孵化成蝌蚪。将蝌蚪转移至蝌蚪缸中(100 cm×60 cm×30 cm) 饲养, 水深15 cm, 每天喂食饲料(购自香港)两次。每缸的蝌蚪密度每升水中不多于 5只蝌蚪(Gosner 30阶段[23]之前), 30阶段之后每升水不多于1.5只蝌蚪。蝌蚪饲养缸每周换水两次, 水的条件控制如下: 无氯, pH 6.5—7.0, 溶解氧大于 5 mg/L, 硬度(CaCO3)约150 mg/L。在两栖动物房中, 温度 (23±2)℃、明暗光周期为 12h 12h∶ (蝌蚪缸水面光强在 600—1000 μmol/(m2·s), 成蛙缸光强在100—300 μmol/(m2·s),待蝌蚪发育至Gosner 26—46阶段[23]取样。
1.2 形态学观察和阶段识别
按照Gosner[23]对无尾目蝌蚪的阶段划分系统对黑斑蛙蝌蚪发育阶段进行划分。取26—46各阶段蝌蚪麻醉后固定于固定液[固定液配方为苦味酸︰甲醛︰冰醋酸(体积比)=75︰25︰5]中, 直接肉眼观察其形态, 其四肢置于体式显微镜下观察(放大倍数为 1—4倍)。每个阶段蝌蚪进行照相,并重点观察腿部变化。根据蝌蚪阶段, 对其形态学特征加以观察描述。
1.3 甲状腺组织学检查
将 26—46各阶段蝌蚪麻醉后, 取下颌放入固定液中,每个阶段至少取三只下颌。将组织从固定液内取出后, 冲水24h; 经过70%、80%、95%及100%酒精浓度梯度脱水后,放入85%、95%及100%二甲苯中透明。经过浸蜡、包埋后进行切片。切片厚度5 μm, 然后经过脱蜡、HE染色、封片后,在光学显微镜下观察、拍照,放大倍数为 10×目镜, 10×物镜。对最大截面进行分析, 观察滤泡、滤泡细胞及胶质形态、颜色、大小等。
1.4 甲状腺激素提取及测定
将黑斑蛙32/33—46各段蝌蚪下颌取出后, 放入1.5 mL无水乙醇内, 剪碎后加入1颗氧化锆珠子。在匀浆仪中研磨2min。置于超声仪中超声30s,然后离心15min, 吸取上清液。在沉淀中加入 0.3 mL冰无水乙醇, 超声30s后, 离心5min,合并上清。将两次上清液在37℃水浴中蒸干, 加入0.5 mL PBS缓冲液, 充分溶解后, 用全自动化学发光免疫分析法(CLIA)测定T3含量。

图 1 黑斑蛙蝌蚪各阶段形态学特征Fig. 1 Morphological features of tadpoles at stage 26—46
2 结果
2.1 黑斑蛙蝌蚪各阶段形态学变化
黑斑蛙蝌蚪 26—46各阶段的形态学变化如下(图1): 26—30阶段主要特征为后肢的生长, 称为后肢芽发育期: 26阶段为后肢芽刚刚出现, 长度不足宽度的一半; 27阶段的后腿芽长度超过宽度的一半但小于宽度; 28阶段时后腿芽长度略超过宽度; 29/30阶段, 后肢芽长度可达宽度的 1.5—2倍。31—36阶段, 为趾分化期: 31阶段时, 后肢芽呈桨状; 32/33阶段, 后肢出现两个缺凹; 34、35阶段, 缺凹增加为三个和四个; 到达36阶段时, 前三个缺凹加深, 分化出三趾; 37阶段时四个缺凹都加深, 分化出明显的五趾。38—40阶段出现蹼突和关节下瘤, 38阶段, 第一趾基出现蹼突; 到了40阶段, 五趾腹面均出现关节下瘤。40阶段后蝌蚪发育进入变态期,更加剧烈的形变开始。41阶段, 穿于前肢外的皮肤变透明, 泄殖腔褶消失或几近消失; 42阶段, 前肢展开, 从这一阶段开始, 口角开始逐渐变宽。43阶段口裂加深, 从侧面看口角超过鼻孔, 但未达到眼,同时鳃和尾开始吸收。44阶段口裂进一步加深, 口角达到眼中部水平, 鳃完全吸收。45阶段口角达到眼后水平, 尾萎缩吸收而趋于消失, 只余一个小突起。46阶段尾完全吸收, 四肢发达, 基本具备与成体相似的色斑, 意味着整个变态过程完成。

图 2 黑斑蛙26—46阶段甲状腺组织学切片Fig. 2 Histological features of thyroid gland at stage 26—46
2.2 黑斑蛙蝌蚪各阶段甲状腺组织学变化
如图2所示, 在蝌蚪的第一个阶段(26阶段), 甲状腺体积很小, 但已经有滤泡存在, 在最大截面处可以看到由单层上皮细胞组成的 1—2个滤泡结构,中间有胶质存在。在随后的变态发育过程中, 在27—37阶段时, 甲状腺体积缓慢增大, 滤泡个数逐渐增多, 滤泡体积也在不断增大, 与此同时, 滤泡内胶质含量也在缓慢增加。到38阶段, 甲状腺体积突然膨大, 滤泡数目也迅速增大, 滤泡内的胶质明显增多, 胶质面积相应增加。接下来的39—41阶段,甲状腺体积、滤泡数目、胶质面积继续增加。42阶段甲状腺体积、滤泡数目、胶质面积急剧增加, 至43阶段甲状腺发育达到顶峰, 表现为甲状腺体积最大、滤泡数目最多、胶质面积最大。之后的44—46阶段, 甲状腺逐渐缩小, 滤泡数目减少、胶质面积减少, 滤泡形状变得不规则。
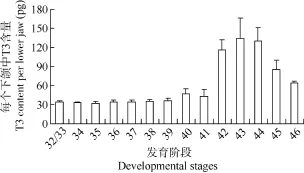
图3 32—46阶段黑斑蛙蝌蚪下颌中T3含量Fig. 3 T3 content in each lower jaw at stage of 32—46
2.3 黑斑蛙发育过程中T3激素水平变化
黑斑蛙发育过程下颌中T3的水平如图3所示,整体变化趋势是: 在变态前的发育阶段中, T3含量增长缓慢, 进入变态期后, T3含量迅速升高, 在变态高峰期达到峰值, 随后慢慢下降。具体而言, 在32/33阶段, 黑斑蛙的下颌中已经可以检测出 T3,每个下颌中含量大约是34 pg。在34—41阶段, 下颌中T3含量增长缓慢, 每只下颌中T3含量从34 pg增加到45 pg左右。从42阶段开始, 下颌中T3含量迅速上升, 每只下颌中T3含量超过110 pg。在43阶段, T3含量达到最高峰, 每只下颌中T3的峰值水平在130 pg左右。44阶段甲状腺激素合成开始减少,使甲状腺内T3激素水平逐渐回落。变态完成后(46阶段), 下颌中T3含量维持在一定水平。
3 讨论
Gosner建立的胚胎和蝌蚪发育阶段的划分系统被广泛用于无尾目动物发育阶段的识别。本文按照Gosner的系统, 对黑斑蛙发育过程中的形态变化进行了系统描述。整体来看, 黑斑蛙的形态变化与Gosner系统中的形态描述基本一致, 除了两处细微不同: Gosner将后腿芽长度为宽度的1.5倍至2倍定义为 29阶段; 当长度达到宽度的 2倍, 定义为 30阶段; 后腿芽出现桨状足, 定义为31阶段。但是我们观察黑斑蛙发现, 后腿芽的长一般到不了宽的 2倍时就会出现桨状足, 也就是30阶段不明显, 所以我们将黑斑蛙的29/30阶段合并。另外, Gosner定义32和33阶段分别为桨状足上出现1个和2个缺凹;而黑斑蛙中 2个缺凹几乎同时出现, 所以我们也将32/33合并。
两栖动物的变态发育主要依赖于甲状腺分泌的甲状腺激素。本文研究了黑斑蛙从蝌蚪第一个阶段到最后一个阶段期间甲状腺的发育。结果发现, 黑斑蛙在蝌蚪的第一个阶段即 26阶段就出现包含胶质的甲状腺滤泡。之前的文献显示, 非洲爪蟾的甲状腺滤泡在Nieuwkoop and Faber (NF)阶段划分系统的49—50阶段才开始出现, 到51阶段时包含胶质的滤泡真正形成[24]。由此看来, 黑斑蛙的甲状腺滤泡出现时间比非洲爪蟾要早。从激素分泌的时间来看, 我们在32/33阶段的黑斑蛙下颌中检出了T3的存在。而早期文献认为, 非洲爪蟾在NF 54阶段时甲状腺才开始合成分泌甲状腺激素[24]。但近期的研究认为, 早期非洲爪蟾蝌蚪的甲状腺也具有合成甲状腺激素的功能, 作者分析早期研究之所以报道非洲爪蟾甲状腺在 NF54才开始分泌激素, 可能是因为当时的检测方法不够灵敏所致[25]。与非洲爪蟾NF54阶段对应的黑斑蛙阶段为 34阶段, 但是这个阶段 T3水平与前一个阶段相比没有明显的升高趋势, 虽然34阶段的甲状腺明显比32/33阶段的甲状腺大, 甲状腺组织学结构也明显发达。到38阶段时黑斑蛙的甲状腺组织学结构又有一次较为明显的发育, 表现为体积增加和滤泡数目增加, 相应甲状腺组织的发育, T3的水平也呈现缓慢上升趋势。对应甲状腺的进一步发育, T3水平在40阶段和41阶段明显上升。42阶段时甲状腺滤泡迅速增至 20个左右, T3水平随之剧烈升高。到43阶段T3水平达到顶峰, 此时的甲状腺组织结构最为发达, 滤泡数目多达 30个以上。44阶段时甲状腺开始退化, 相应T3水平回落。之后45阶段和46阶段, 甲状腺继续退化, 相应T3水平迅速回落。从整个发育过程来看,黑斑蛙甲状腺激素水平的变化与甲状腺组织学的变化是一致的。
根据甲状腺激素的开始分泌、水平升高、回落以及对应的形态学变化, 一般将两栖动物的变态分为三个时期: 甲状腺激素不分泌或极少量分泌的预变态期(Pre-metamorphosis), 对应腿芽的发生和生长; 甲状腺激素分泌但仍保持一个低水平状态的前变态期(Pro-metamorphosis), 对应趾的分化和腿的快速发育; 甲状腺激素水平升高直至变态完成的变态高峰期(Metamorphic climax), 对应鳃和尾的吸收、肠的重塑等剧烈的变化。从激素水平的研究数据来看, 黑斑蛙发育过程中并没有一个T3从无到有的阶段, 在34阶段附近也没有一个甲状腺明显上升的拐点, 所以我们不能根据甲状腺激素的变化来确定预变态期和前变态期的界限。但为了研究过程中可与其他两栖物种尤其与非洲爪蟾比较, 我们参考非洲爪蟾54阶段作为前变态期的第一个阶段, 将与后腿发育与之对应的黑斑蛙的 34阶段作为前变态期的第一个阶段。在42阶段, 黑斑蛙的T3水平急剧升高, 相应的形态发生剧烈的变化, 如前腿展开、口角变宽、鳃开始吸收等, 可视作变态高峰期的开始。因此, 黑斑蛙变态的三个时期可作如下划分: 预变态期为26—33阶段, 前变态期为34—41阶段, 变态高峰期为42—46阶段。
综合以上工作, 本文较为系统地研究了黑斑蛙变态发育过程中整体形态变化, 绘制了甲状腺组织学发育图谱, 描述了甲状腺激素水平的变化, 为今后黑斑蛙甲状腺激素功能和甲状腺干扰研究奠定基础。
[1] Yen P M. Physiological and molecular basis of thyroid hormone action [J]. Physiological Reviews, 2001, 81(3):1097—1142
[2] Bernal J, Guadaño-Ferraz A, Morte B. Perspectives in the study of thyroid hormone action on brain development and function [J]. Thyroid, 2003, 13(11): 1005—1012
[3] Brucker-Davis F. Effects of environmental synthetic chemicals on thyroid function [J]. Thyroid, 1998, 8(9): 827—856
[4] Zoeller R T. Environmental chemicals impacting the thyroid: targets and consequences [J]. Thyroid, 2007, 17(9): 811—817
[5] Tata J R. Amphibian metamorphosis as a model for the developmental actions of thyroid hormone [J]. Molecular and Cellular Endocrinology, 2006, 246(1): 10—20
[6] Heimeier R A, Das B, Buchholz D R, et al. Studies on Xenopus laevis intestine reveal biological pathways underlying vertebrate gut adaptation from embryo to adult [J]. Genome Biology, 2010, 11(5): k55
[7] Das B, Matsuda H, Fujimoto K, et al. Molecular and genetic studies suggest that thyroid hormone receptor is both necessary and sufficient to mediate the developmental effects of thyroid hormone [J]. General and Comparative Endocrinology, 2010, 168(2): 174—180
[8] Organisation for Economic Co-operation and Development (OECD). Test No. 231: Amphibian Metamorphosis Assay, OECD Guidelines for the Testing of Chemicals, Section 2 [S]. Paris: OECD, 2009
[9] Degitz S J, Holcombe G W, Flynn K M, et al. Progress towards development of an amphibian-based thyroid screening assay using Xenopus laevis Organismal and thyroidal responses to the model compounds 6-propylthiouracil, methimazole, and thyroxine [J]. Toxicological Sciences, 2005, 87(2): 353—364
[10] Heimeier R A, Das B, Buchholz D R, et al. The xenoestrogen bisphenol A inhibits postembryonic vertebrate development by antagonizing gene regulation by thyroid hormone [J]. Endocrinology, 2009, 150(6): 2964—2973
[11] Helbing C C, Ovaska K, Ji L. Evaluation of the effect of acetochlor on thyroid hormone receptor gene expression in the brain and behavior of Rana catesbeiana tadpoles [J]. Aquatic Toxicology, 2006, 80(1): 42—51
[12] Croteau M C, Davidson M, Duarte-Guterman P, et al. Assessment of thyroid system disruption in Rana pipiens tadpoles chronically exposed to UVB radiation and 4-tert-octylphenol [J]. Aquatic Toxicology, 2009, 95(2): 81—92
[13] Arukwe A, Jenssen B M. Differential organ expression patterns of thyroid hormone receptor isoform genes in p, p′-DDE-treated adult male common frog, Rana temporaria [J]. Environmental Toxicology and Pharmacology, 2005, 20(3): 485—492
[14] Gutleb A C, Appelman J, Bronkhorst M, et al. Effects of oral exposure to polychlorinated biphenyls (PCBs) on the development and metamorphosis of two amphibian species (Xenopus laevis and Rana temporaria ) [J]. Science of the Total Environment, 2000, 262(1): 147—157
[15] Hanada H, Katsu K, Kanno T, et al. Cyclosporin A inhibits thyroid hormone-induced shortening of the tadpole tail through membrane permeability transition [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2003, 135(3): 473—483
[16] Oka T, Miyahara M, Yamamoto J, et al. Application of metamorphosis assay to a native Japanese amphibian species, Rana rugosa, for assessing effects of thyroid system affecting chemicals [J]. Ecotoxicology and Environmental Safety, 2009, 72(5): 1400—1405
[17] Park S, Park S H, Ahn H C, et al. Structural study of novel antimicrobial peptides, nigrocins, isolated from Rana nigromaculata [J]. FEBS Letters, 2001, 507(1): 95—100
[18] Sumida M, Kanamori Y, Kaneda H, et al. Complete nucleotide sequence and gene rearrangement of the mitochondrial genome of the Japanese pond frog Rana nigromaculata [J]. Genes & Genetic Systems, 2001, 76(5): 311—325
[19] Sumida M, Kato Y, Kurabayashi A. Sequencing and analysis of the internal transcribed spacers (ITSs) and coding regions in the EcoR I fragment of the ribosomal DNA of the Japanese pond frog Rana nigromaculata [J]. Genes & Genetic Systems, 2004, 79(2): 105—118
[20] Takase M, Ukena K, Tsutsui K. Expression and localization of cytochrome P45011β, aldo mRNA in the frog brain [J]. Brain Research, 2002, 950(1): 288—296
[21] Li X Y, Zhou J, Yu M, et al. Toxic effects of 1-methyl-3-octylimidazolium bromide on the early embryonic development of the frog Rana nigromaculata [J]. Ecotoxicology and Environmental Safety, 2009, 72(2): 552—556
[22] Wang M Z, Jia X Y. Low levels of lead exposure induce oxidative damage and DNA damage in the testes of the frog Rana nigromaculata [J]. Ecotoxicology, 2009, 18(1): 94—99
[23] Gosner K L. A simplified table for staging anuran embryos and larvae with notes on identification [J]. Herpetologica, 1960, 16(3): 183—190
[24] Nieuwkoop P D, Faber J. Normal Table of Xenopus laevis (Daudin). A Systematical and Chronological Survey of the Development from the Fertilized Egg till the End of Metamorphosis [M]. Garland Publishing Inc. 1956, 22
[25] Marsh-Armstrong N, Cai L, Brown D D. Thyroid hormone controls the development of connections between the spinal cord and limbs during Xenopus laevis metamorphosis [J]. Proceedings of the National Academy of Sciences, 2004, 101(1): 165—170
THE DEVELOPMENT AND HORMONE LEVELS OF THYROID GLAND DURING RANA NIGROMACULATA METAMORPHOSIS
GE Ya-Nan1,2, LI Yuan-Yuan1, ZHANG Yin-Feng1, LOU Qin-Qin1, ZHAO Ya-Xian1and QIN Zhan-Fen1
(1. Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China; 2. Fujian Agriculture and Forestry University, Fuzhou 350002, China)
The metamorphosis of amphibians is considered as a good model to study thyroid hormone (TH) disruption. In the present study, we used Rana nigromaculata, a domestic species, to investigate thyroid development and the changes in TH levels during metamorphosis.We first described the morphological change during the tadpole development (stage 26—46) that the hind limbs appeared and finally formed five toes from stage 26 to 40. At the climax of metamorphosis, the dramatic changes include the protruded forelimbs and start-to-resorb tail. Tail resorption completed at stage 46, indicating the completion of metamorphosis. Corresponding to the morphological changes, histological features of thyroid gland changed significantly. From stage 26 to 37, the thyroid gland was small and developed slowly. At stage 38, the thyroid gland enlarged dramatically. The climax of thyroid gland development happened at the climax of metamorphosis. The thyroid gland began to shrink at the completion of metamorphosis. The thyroid hormone (T3) levels were associated with thyroid gland development. T3 content in per lower jaw was very low before metamorphosis, while increased dramatically during metamorphosis; it reached the peak level at the climax of metamorphosis and then decreased. During Rana nigromaculata metamorphosis, thyroid hormone levels were correlated with thyroid gland histological features. The current study creates the foundation for the research of thyroid hormone disruption.
Rana nigromaculata; Tadpoles; Thyroid gland; Thyroid hormone; Development
Q959.5
A
1000-3207(2014)04-0714-06
10.7541/2014.101
2013-10-24;
2014-02-26
国家 “863”计划课题(2012AA06A302); 环保公益性行业科研专项(201109048)资助
葛雅楠(1985—), 女, 河北保定人; 硕士; 研究方向为毒理学。E-mail: nannan.smart@163.com
秦占芬, E-mail: qinzhanfen@rcees.ac.cn

