氧化豆油水溶物对离体草鱼肠道黏膜细胞的损伤作用
姚仕彬叶元土蔡春芳姚林杰许 凡刘 猛张宝彤萧培珍王丽宏
(1. 苏州大学基础医学与生物科学学院, 江苏省水产动物营养重点试验室, 苏州 215123; 2. 北京市营养源研究所, 系统营养工程技术研究中心, 北京100069)
氧化豆油水溶物对离体草鱼肠道黏膜细胞的损伤作用
姚仕彬1叶元土1蔡春芳1姚林杰1许 凡1刘 猛1张宝彤2萧培珍2王丽宏2
(1. 苏州大学基础医学与生物科学学院, 江苏省水产动物营养重点试验室, 苏州 215123; 2. 北京市营养源研究所, 系统营养工程技术研究中心, 北京100069)
以氧化豆油水溶物为试验材料, 在草鱼肠道黏膜细胞培养液中加入不同浓度氧化豆油水溶物, 研究不同剂量氧化豆油水溶物在不同作用时间下对肠道黏膜细胞生长、细胞形态结构的影响。结果显示: 添加111.06—888.48 g/L氧化豆油的水溶物作用6h显著降低细胞活性(P<0.05), 细胞集落面积减小、细胞形态改变, 其中在 444.24 g/L氧化豆油的水溶物作用下培养细胞空泡变性, 且脂肪滴沉积, 线粒体肿胀。在222.12—888.48 g/L氧化豆油的水溶物作用下, 3—9h内培养液中LDH活力显著增高(P<0.05); 各时间点培养液中GSH-PX、SOD、T-AOC均有显著变化。结果表明, 在培养液中添加111.06—888.48 g/L氧化豆油的水溶物作用 12h内, 对草鱼肠道黏膜细胞产生了损伤, 表现为抑制细胞生长, 改变细胞形态、结构, 可能引起细胞膜脂质过氧化, 导致膜结构破坏, 且作用程度与添加浓度、作用时间相关。研究认为氧化豆油水溶物对草鱼肠道黏膜细胞具有显著性的损伤作用。
草鱼; 肠道黏膜细胞; 氧化豆油; 细胞生长
饲料中油脂能为鱼类提供能量和必需脂肪酸,以维持其正常的生命活动和细胞膜正常结构与功能[1—3]。然而, 饲料中油脂在高温、有氧等条件下容易氧化酸败, 产生多种初级与次级氧化物[4—7],当这些氧化产物被鱼类摄食后, 会破坏鱼类的正常生理生化功能, 如降低生物膜流动性[8]、破坏膜结构完整性[9,10]、影响机体抗氧化酶及辅酶活性[11,12],导致鱼类生长缓慢[13—15]。肠道是营养吸收的主要器官及抵御细胞与毒素的屏障[16—18], 氧化油脂能造成动物肠道损伤[19,20]。然而, 目前关于氧化油脂对鱼类肠道损伤机理尚不清楚, 利用离体细胞研究氧化油脂或油脂氧化产物对肠道黏膜细胞(Intestinal epithelial cells, IECs)的损伤作用未见报道。氧化油脂需要经过乳化后才能加入到细胞培养液中, 而如何避免乳化剂对培养细胞所产生的损伤作用还需要研究。氧化油脂水洗后所得水溶物包含了油脂氧化后的水溶性产物, 这类水溶性物质则可以顺利加入到细胞培养液中进行试验研究。因此, 本试验利用分离、培养的草鱼肠道黏膜细胞为实验对象, 在细胞培养液中添加不同剂量的氧化豆油水溶物, 观察其对细胞的生长、形态结构、功能的影响, 探索氧化豆油水溶物对肠道黏膜细胞的损伤机制, 为研究氧化油脂对鱼类肠道的损伤机制提供基础。
1 材料与方法
1.1 实验草鱼与肠道黏膜细胞分离、培养
草鱼 获取肠道黏膜原代细胞的试验草鱼(Ctenopharyngodon idella)平均重量为(22.0±5.0) g,购自苏州相城新时代养殖场。饲养于苏州大学鱼类循环养殖系统中, 使用自制的强化饲料(中国发明专利“一种强化鱼类肠道黏膜和肝胰脏细胞生理功能的配合饲料”, 专利号ZL 201010585756.9)强化饲养2周后用于肠道黏膜细胞的采集。养殖期间投喂的配合饲料含蛋白质28%、油脂4%。每天投喂饲料2次, 水温为(24±4.0)℃、溶解氧>6 mg/L。
肠道黏膜原代细胞的获取与培养方法 草鱼肠道黏膜细胞(细胞团)获取及其培养方法参照本实验室建立的方法(中国发明专利“一种鱼类肠道黏膜细胞分离与原代培养方法”, 专利号 ZL 20101 0620104.4)进行。主要方法为: 试验草鱼用超纯水冲洗体表 2次, 捣碎脑部处死, 迅速置 75%乙醇中浸5—10 s。超净工作台上解剖鱼体, 取出肠道中段,去除肠系膜脂肪, 用注射器(10 mL)吸取D-Hanks清洗液冲洗肠段内腔3—4次; 采用机械刮取获得肠道黏膜组织, 加入胶原酶Ⅰ、Ⅳ联合消化液(为: 含有胶原酶Ⅰ、Ⅳ各0.1 mg/mL的D-Hanks液, 0.22 μm过滤, –20℃贮存), 28℃震荡消化30min后, 立即加入终止液(按 消化液 ︰胎牛血清=19︰1的比例配制而成)终止消化, 玻璃吸管反复吹打 5min后, 静止1min, 吸取上层细胞悬液为原代黏膜细胞(细胞团)液。原代黏膜细胞(细胞团)液经过 400 r/min离心7min, 加入完全培养液(为: 使用前添加 15% 胎牛血清的 M199液)悬浮沉淀, 重复离心(400 r/min、7min) 2次, 取细胞(细胞团)悬浮液接种于96孔细胞培养板(鼠尾胶原Ⅰ型包被)。
细胞(细胞团)接种数量保持在2×103(个/孔); 使用添加 15%胎牛血清的 M199为培养液; 在 27℃, 6% CO2条件下培养36h后加入氧化豆油的水溶物进行相关试验。
1.2 氧化豆油和氧化豆油水溶物
氧化豆油的制备 豆油购自东海粮油工业(张家港)有限公司, 普通浸出工艺, 未添加抗氧化剂。采用殷永风等[21]方法进行油脂氧化, 制备氧化豆油, 具体条件为: 氧化温度(80±2)℃, 充入泵充入空气进行氧化, 氧化时间为30d。氧化豆油氧化指标:碘价Ⅳ(GB/T5532-1995)(48.89±4.28) g(I2)/kg、酸价AV(GB/T5530-2005)(7.68±0.14) mg(KOH)/g、过氧化值POV(GB/T5538-2005)(532.35±22.03) meq/kg、丙二醛MDA(GB/T5009-2003)(325.58±4.15) μmol/L。
氧化豆油水溶物的制备 称取264.32 g氧化豆油, 加入1000 mL双蒸水充分混合后, 转入分液漏斗中, 静置 15min, 收集下层水溶液, –80℃过夜冷冻, 于真空干燥器中冷冻干燥 5d, 获得氧化豆油水溶物固体结晶。为了对氧化豆油水溶物进行定量,使用双蒸水将经过冷冻干燥氧化豆油水溶物固体结晶溶解并定容至 35 mL, 在超净台中 0.2 μm过滤,制备得到无菌氧化豆油的水溶物, –80℃冷冻保存备用。采用试剂盒(南京建成生物工程研究所生产)测得其中含有 MDA (84.24±1.57) μmol/L、H2O2(1864.63±142.14) μmol/L。
氧化豆油水溶物的表示方法 在细胞培养液中加入定量(mL)的氧化豆油水溶物, 以“每个实验处理中添加的氧化豆油所含有的水溶物的量”表示添加的水溶物量, 计算公式为: 对应氧化豆油量(g/L)=(m氧化豆油/v氧化豆油水溶物定容)×(v添加氧化豆油水溶物量/v培养液最终体积) ×1000, 其中 m为用于制备水溶物的氧化豆油质量,单位为g, v氧化豆油水溶物定容为m质量的氧化豆油得到的水溶物定容体积, v添加氧化豆油水溶物量为每个实验处理中所添加的水溶物体积, v培养液最终体积为对应的细胞培养液体积, 单位均为mL。
1.3 试验方案
采用单因子试验设计, 设对照组及 4个氧化豆油水溶物处理组, 各组均为128个重复(孔), 此外另增设处理组3及对照组96个重复, 用于电镜取样。
当细胞生长 36h时, 分别添加含不同浓度氧化豆油水溶物的完全培养液至原代草鱼IECs中, 计算每升培养液中添加对应的氧化豆油量, 4个处理组添加对应氧化豆油量分别为 111.06、222.12、444.24和888.48 g/L, 见表1。同时计算得到每个实验处理对应的丙二醛和H2O2的量。
1.4 主要试验方法
细胞观察 分别在实验开始后3h、6h、9h、12h时取出培养板进行观察。培养的活体细胞直接用IX70荧光倒置显微镜(奥林巴斯公司)进行观察和照相, 或经过Giemsa染色[22], 观察细胞集落的生长状态。而细胞形态、内部结构的观察则是经过常规制片、染色后用透射电子显微镜(Hitachi H600)观察。操作方法为实验开始后3、6h时于对照组与处理组3选取 48孔, 进行电镜取样, 常规电镜方法制样,醋酸铀–柠檬酸铅双染色, 透射电镜观察。
活细胞数量测定 随机选取8个培养孔培养的细胞, 测定细胞活性[23], 计算细胞抑制率, 公式为: 细胞抑制率(%)=(A对照组–A处理组)/A对照组。MTT (Sigmaaldrich产品)浓度5 mg/mL, 0.22 μm过滤, –20℃贮存。
培养液中主要生化指标的测定 在不同培养时间, 每个处理组随机选取32个孔培养细胞, 吸取培养液保存于5只1.5 mL EP管中, 选取其中4支在–80℃冷冻保存, 用于测定培养液中谷胱甘肽过氧化物酶(GSH-PX)、超氧化物歧化酶(SOD)、总抗氧化能力(T-AOC)活力、微量丙二醛(MDA)含量, 剩下1支2000 r/min离心5min, 取上清液10000 r/min离心5min, 留取上清液, –80℃冷冻保存, 用于测定碱性磷酸酶(AKP)、乳酸脱氢酶(LDH)、谷丙转氨酶(GPT)活力。均使用试剂盒(南京建成生物工程研究所生产)并按照试剂盒方法测定。
1.5 数据处理
数据以平均值±标准差(Mean ± SD)表示, 结果用SPSS 17.0软件进行统计分析, 用Duncan 氏法进行多重比较, 差异显著水平为P<0.05。
2 结果
2.1 对培养细胞生长与抑制率的影响
分离的草鱼肠道黏膜细胞经过36h培养后, 加入氧化豆油水溶物进行培养, 分别于3h、6h、9h、 12h时, 采用MTT方法对培养的黏膜细胞进行细胞活性测定。结果见表2。与对照组相较, 在加入氧化豆油水溶物后12h内, 添加444.24—888.48 g/L氧化豆油的水溶物均显著降低细胞活性(P<0.05), 222.12 g/L 浓度组在添加后3h、6h、12h较对照组显著降低(P<0.05), 111.06 g/L 浓度组在添加后6h、12h较对照组显著降低(P<0.05), 其余差异不显著(P>0.05)。计算氧化豆油水溶物对培养的肠道黏膜细胞活性抑制率(图1), 在添加氧化豆油的水溶物后,细胞抑制率在12h为最高, 其次为6h时, 细胞抑制率与氧化豆油水溶物的添加量呈正相关。
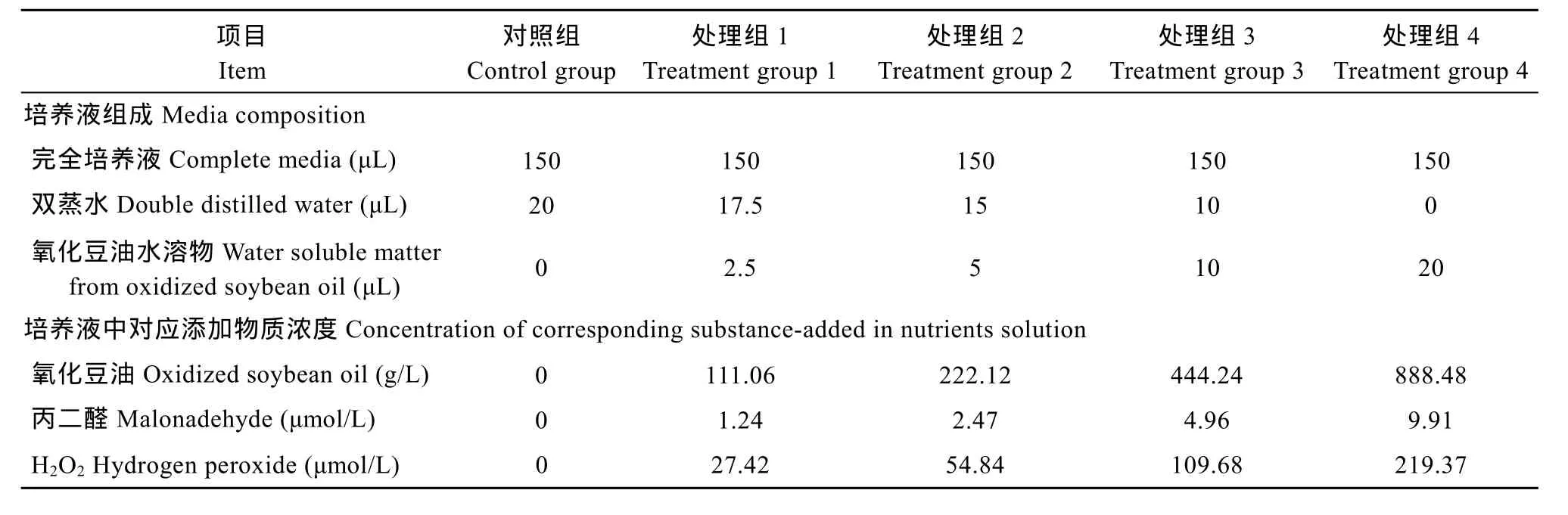
表1 试验设计Tab. 1 The experimental design

表2 细胞活性变化(MTT OD值)Tab. 2 Changes of activity of cells (MTT OD value)
上述结果显示, 加入氧化豆油水溶物后, 草鱼肠道黏膜细胞活性下降; 细胞活性降低程度、抑制率与氧化豆油水溶物的添加量、作用时间相关。
2.2 对细胞生长状态、细胞形态及其内部结构的影响
在加入不同浓度的氧化豆油水溶物后的不同时间里, 通过荧光倒置显微镜、Giemsa染色后显微镜观察培养的实验细胞的生长状态, 并用电子显微镜观察实验细胞的形态及内部结构变化过程。结果发现, 对照组细胞生长分化正常, 胞质丰富(图版Ⅰ-a);3h时, 处理组出现游离细胞及折光性较差的圆球状细胞, 其中以处理组4较为明显(图版Ⅰ-b、c); 至12h时,处理组中细胞脱落, 贴壁细胞数量减少(图版Ⅰ-d、e)。

图1 不同时间点处理组细胞抑制率变化Fig. 1 Cell inhibitory rate of treatment groups in different time
培养细胞经Giemsa染色后可知, 对照组细胞集落面积较大, 细胞生长分化正常, 细胞界限与细胞核清晰(图版Ⅰ-f、g); 3h时, 处理组中细胞核清晰度下降, 细胞界限模糊, 其中以处理组3、4较为明显(图版Ⅰ-h、i); 12h时, 各处理组中细胞集落面积减小,局部仅呈现细胞脱落后残留的细胞团(图版Ⅰ-j、k)。
从对照组与处理组3电镜观察结果可知, 对照组细胞线粒体正常, 内嵴清晰,黏膜细胞紧密连接清晰(图版Ⅰ-l), 添加氧化豆油水溶物3h时, 细胞核膜皱折程度严重, 线粒体肿胀, 部分黏膜细胞的细胞膜破裂(图版Ⅰ-m、n); 6h时, 氧化豆油水溶物导致细胞空泡变性严重, 细胞内脂肪滴沉积, 线粒体肿胀
(图版Ⅰ-o)。
上述结果显示细胞死亡或凋亡程度随着氧化豆油水溶物的添加浓度及作用时间增加而加强, 氧化豆油水溶物作用细胞后细胞折光性减弱, 细胞呈圆球状, 染色后发现细胞轮廓不清晰, 细胞界限模糊。添加对应888.48 g/L氧化豆油的水溶物在3h内即对细胞形态造成影响, 添加对应111.06 g/L和222.12 g/L氧化豆油水溶物在6h开始损伤细胞, 其损伤程度较444.24 g/L和888.48 g/L浓度下轻。此外, 电镜结果显示添加对应444.24 g/L氧化豆油的水溶物对细胞内部结构有明显影响。
2.3 对培养细胞的细胞膜通透性的影响
LDH和GPT是细胞内酶, 只有在细胞膜损伤导致细胞膜通透性增加的情况下才会在培养液中大量检出, 因此可作为培养细胞细胞膜损伤程度判定的指标之一。在加入氧化豆油水溶物不同时间后, 测定培养液中的LDH和GPT活力(表3)。相较于对照组,3—9 h添加222.12—888.48 g/L氧化豆油的水溶物显著增加培养液中LDH活力(P<0.05), 其余差异不显著(P>0.05)。3—12 h时添加444.24—888.48 g/L氧化豆油的水溶物显著增高培养液中 GPT活力(P<0.05), 添加 222.12 g/L氧化豆油的水溶物在6—12 h显著增高(P<0.05), 添加111.06 g/L氧化豆油的水溶物在6、12 h显著增高(P<0.05), 其余差异不显著(P>0.05)。
因此, 添加 444.24—888.48 g/L氧化豆油的水溶物培养细胞 3—9 h能显著增大细胞膜的通透性,导致细胞内酶逸出。

表3 培养液中LDH和GPT活力变化Tab. 3 Changes of LDH and GPT activity in culture medium (U/L)
2.4 培养液中AKP酶活力变化
AKP是肠道黏膜细胞的标志酶, 代表了细胞的成熟分化程度[24]; AKP活力上升, 表明细胞分化程度越高, 细胞的消化、吸收和防御能力越强[25]。由表4知, 与对照组比较, 6—12h, 各处理组显著降低培养液中AKP活力(P<0.05), 3h时处理组2—4培养液中 AKP活力均显著升高(P<0.05), 其余差异不显著(P>0.05)。
上述结果表明, 添加 111.06—888.48 g/L氧化豆油的水溶物在6—12h能显著抑制细胞的分化成熟。
2.5 培养液MDA含量变化
从表 5可知, 培养液中添加不同含量氧化豆油的水溶物后, 3h时处理组培养液MDA含量随着氧化豆油的水溶物添加量的增高而增大; 与对照组相较, 随着时间的延长, 处理组中培养液MDA含量呈逐渐降低的趋势, 其中相较于 3h, 6h时添加222.12—888.48 g/L氧化豆油的水溶物组培养液中MDA含量下降幅度均大于 46.95%; 12h时, 添加111.06—222.12 g/L氧化豆油的水溶物培养液MDA含量与对照组差异不显著(P>0.05)。
2.6 培养液中GSH-PX、SOD、T-AOC变化
从表6可知, 相较于对照组, 各处理组氧化豆油的水溶物仅在3—6 h对培养液中GSH-PX活力显著降低(P<0.05), 其余差异不显著(P>0.05); 添加111.06—444.24 g/L氧化豆油的水溶物在9—12 h培养液中SOD活力极显著降低(P<0.05), 888.48 g/L氧化豆油水溶物组在3—9 h培养液中SOD活力极显著降低(P<0.05); 添加888.48 g/L氧化豆油的水溶物其培养液中T-AOC能力在12h内均显著降低(P<0.05), 444.24 g/L浓度组仅在6 h—12 h显著降低(P<0.05)。
3 讨论

表4 培养液中AKP活力变化(U/L)Tab. 4 Changes of AKP activity in culture medium (U/L)

表5 培养液中MDA含量变化Tab. 5 Changes of concentration of MDA in culture medium (μmol/L)
氧化油脂对养殖动物的生理健康有严重的不良影响, 而油脂氧化产物的组成非常复杂, 且随着油脂种类不同、氧化条件不同所得的氧化产物也有很大的差异, 这是研究氧化油脂对养殖动物生理健康影响的最大难点。从溶解性来区分, 可以将油脂氧化产物分为水溶性和脂溶性二大类物质。利用水洗氧化豆油所得的水溶物中, 主要为豆油氧化所产生的低碳链数的游离脂肪酸、丙二醛、酮等水溶性物质。因此, 本文的研究结果反映了豆油氧化后所产生的水溶性物质作为一个整体对草鱼肠道黏膜细胞生长、细胞结构的影响, 从一个侧面反应了豆油氧化产物对离体细胞的损伤作用, 但不能全面反应氧化豆油对离体草鱼肠道黏膜细胞所产生的损伤作用。
3.1 氧化豆油水溶物抑制黏膜细胞生长、破坏黏膜细胞正常形态和结构
细胞活性测定是基于线粒体内含有琥珀酸脱氢酶, 其能将MTT从黄色转化为蓝色, 广泛用于细胞增殖及线粒体活力指标, 亦能间接反映细胞代谢程度, 通过其值的大小, 间接表示添加物质对细胞生长的促进与抑制作用[23,26]。在本试验结果中, 添加111.06—888.48 g/L氧化豆油的水溶物后, 12h细胞活性均极显著降低(P<0.01), 说明此浓度范围及作用时间下氧化豆油水溶物中存在的有害物质对细胞生长有较强抑制作用。
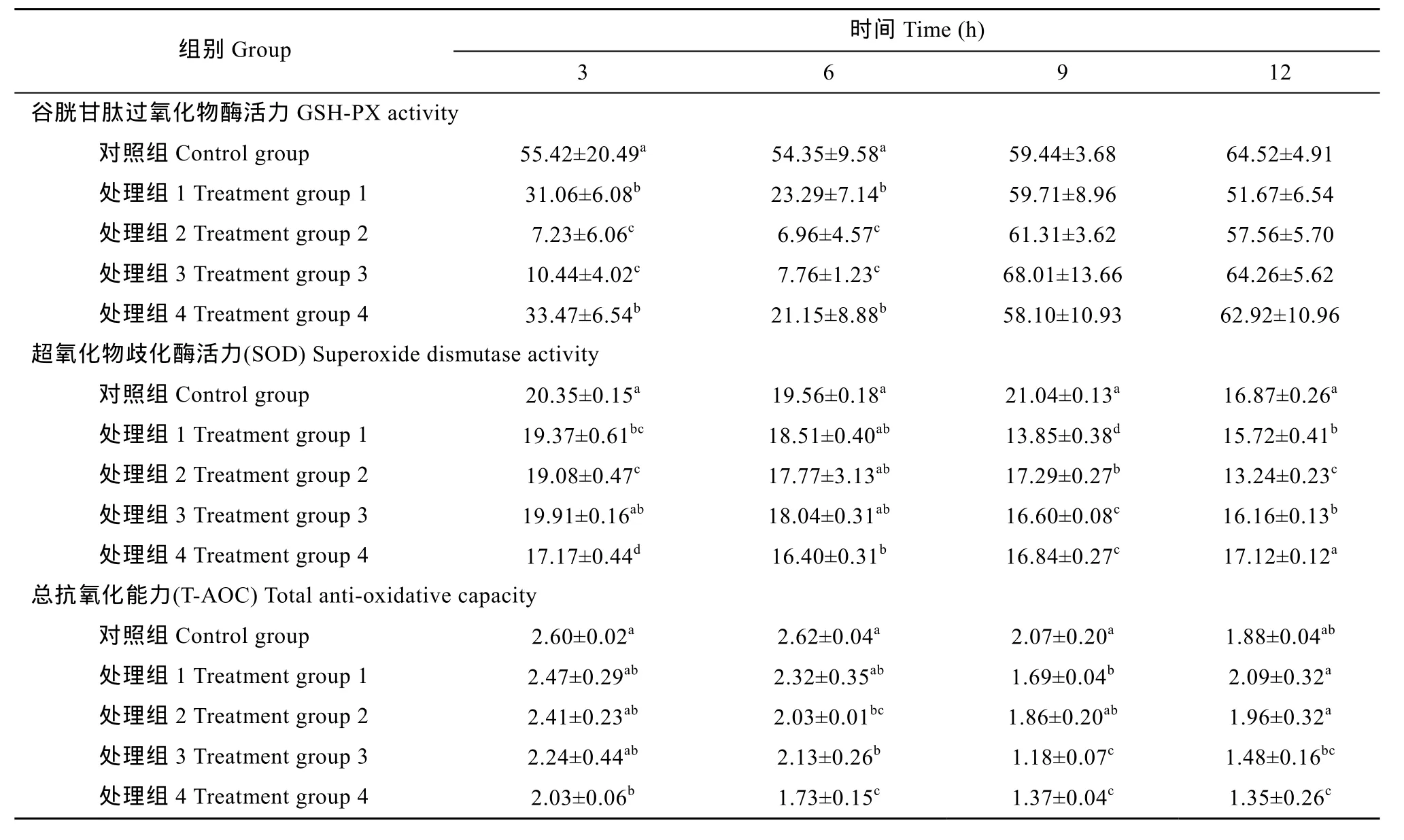
表6 培养液中GSH-PX和SOD活力与T-AOC的变化(U/mL)Tab. 6 Changes of GSH-PX, SOD activity and total anti-oxidative capacity in culture medium (U/mL)
通过对细胞形态及结构的观察可以发现, 氧化豆油水溶物能导致细胞集落边缘不断产生游离细胞,集落面积减小, 最终仅残留活力较低的细胞团, 可能原因是氧化豆油水溶物中的有害氧化产物降低了细胞膜的流动性或是影响了细胞黏附因子的表达,导致细胞贴壁能力与迁移受阻, 从而使得细胞集落面积减小。添加444.24 g/L氧化豆油的水溶物后细胞核皱折程度较严重, 细胞空泡变性, 细胞内脂肪滴沉积, 可能是氧化豆油水溶物中有害氧化产物致使细胞生物膜脂质过氧化, 同时破坏线粒体的正常功能, 造成细胞内部结构的变化。
综上所述, 添加111.06—888.48 g/L氧化豆油的水溶物均能不同程度的降低细胞活性, 抑制黏膜细胞的生长; 氧化豆油水溶物对培养的黏膜细胞形态、细胞内部结构造成损伤; 氧化豆油水溶物对黏膜细胞的损伤作用表现为全面性的损伤。
3.2 氧化豆油水溶物损伤细胞膜完整性
细胞通透性变化是细胞损伤的标志之一, 损伤引起胞浆酶释放, 酶活力的变化反映细胞损伤程度的变化。胞浆酶释放量可以反映出细胞膜的完整性和胞浆酶的渗漏性[27—29]。细胞具有正常结构是其具有正常生理功能的前提, LDH、GPT存在于胞浆内,若其正常结构受到破坏, 胞内酶则逸出膜外, 在培养液中被检测出来。研究发现, 在低浓度H2O2(50—200 μmol/L)的作用下, 细胞线粒体功能未见明显改变, 在高浓度(400 μmol/L)时可导致线粒体功能不可逆的进行性下降, 致使线粒体内嵴减少、肿胀, 同时线粒体参与了 H2O2诱导肠上皮细胞的早期程序性死亡及随后的细胞死亡[30], 同时MDA能与细胞膜上蛋白质交联, 形成 MDA-蛋白质的加合产物,导致细胞膜发生改变[20]。本试验处理组添加氧化豆油的水溶物后, 处理组培养液中H2O2与MDA含量分别为达到27.42—219.37 μmol/L、1.24—9.91 μmol/L,且对细胞活性、膜结构、细胞通透性产生了显著影响, 可能是氧化豆油中H2O2及MDA分别对细胞线粒体及细胞膜的影响促进细胞凋亡, 致使细胞内酶的漏出; 此外, 本试验中添加氧化豆油水溶物后,处理组培养液丙二醛各时间点含量相应较高, 但随着时间的延长, 培养液丙二醛含量逐渐降低, 可能是培养液中的丙二醛与细胞膜蛋白结合后, 导致培养液丙二醛含量下降。根据本试验结果, 推测氧化豆油水溶物对细胞产生损伤的有害物质中除 H2O2外, MDA可能为对细胞产生损伤的重要物质之一。
3.3 氧化豆油水溶物对黏膜细胞正常抗氧化功能、分化程度具有重大影响
氧化豆油水溶物对细胞造成了不同程度的损伤,引起细胞产生脂质过氧化, 导致细胞结构破坏。谷胱甘肽过氧化物酶(GSH-PX)是广泛存在的一种重要的过氧化物分解酶, 主要分解 H2O2, 专一作用超氧阴离子(O2•-)的 SOD能够清除多余的活性氧物种,维持机体氧化-抗氧化平衡[31—33]; T-AOC是用来衡量机体抗氧化系统功能状况的综合指标。本试验中,氧化豆油水溶物作用草鱼 IECs细胞后培养液中GSH-PX、SOD活力及T-AOC均降低, 说明细胞抗氧化能力已经受到损伤。从3种抗氧化酶活力降低程度看, 氧化豆油水溶物损伤细胞时对 GSH-PX、SOD 影响较大, 说明了氧化豆油水溶物中大量的H2O2、自由基等直接攻击细胞后使细胞产生应激反应, 导致细胞产生大量氧自由基等活性物质, 促使细胞抗氧化酶活力的降低, 导致细胞膜结构发生脂质过氧化作用。从时间进程看, 各实验组在 3—6 h内 GSH-PX活力下降, 显示出氧化豆油水溶物对肠道黏膜细胞的直接损伤作用; 9h后, 各实验组GSH-PX活力增加, 基本达到对照组的水平, 应该是培养细胞受到氧化豆油水溶物损伤后, 刺激了细胞分泌GSH-PX或激活GSH-PX活力, 同时细胞功能也得到一定程度恢复, 是培养细胞中清除H2O2的GSH-PX抗应激能力特异性强化的结果; 3h与6h氧化豆油水溶物浓度增加 GSH-PX先下降后上升, 也呈现出此种情况。
本试验在测定AKP活力之前, 样品均离心, 以有效消除细胞 AKP活力的影响。本试验中测定的AKP活力代表了培养细胞外溢到细胞外的 AKP活力, 在添加氧化豆油水溶物后3h内, AKP活力显著升高, 是否是氧化豆油水溶物对细胞膜的直接损伤作用, 导致细胞通透性增加, 细胞外溢的AKP酶含量增加的结果还值得研究。而在6—12h, AKP活力呈降低趋势, 表明氧化豆油的水溶物抑制了细胞的分化成熟, 产生明显抑制浓度为222.12—888.48 g/L, 作用时间点主要集中在添加后6—12h。
4 结论
在本试验条件下, 对应氧化豆油 111.06—888.48 g/L氧化豆油的水溶物在作用12h内对原代草鱼IECs细胞生长、细胞形态及细胞分化成熟产生了抑制, 其作用程度与添加浓度和作用时间相关。氧化豆油水溶物能引起原代草鱼 IECs损伤的作用位点可能在细胞膜结构, 作用途径可能是直接导致细胞膜脂质过氧化或是细胞抗氧化能力下降间接导致细胞膜脂质过氧化。
[1] Bell M V, Henderson R J, Sargent J R. The role of polyunsaturated fatty acids in fish [J]. Comparative Biochemistry and Physiology Comparative Biochemistry and Physiology, 1986, 83(4): 711—719
[2] John E H, Ronald W H. Fish nutrition [A]. In: Sargent J R, Tocher D R, Bell J G (Eds.), The lipids [C]. New York: Academic Press. 2002, 182—257
[3] Chen J L, Han D, Zhu X M, et al. Dietary lipid sources for gibel carp Carassius auratus gibelio: growth performance, tissue composition and muscle fatty acid profiles [J]. Acta Hydrobiologica Sinica, 2011, 35(6): 988—997 [陈家林, 韩冬, 朱晓鸣, 等. 不同脂肪源对异育银鲫的生长、体组成和肌肉脂肪酸的影响. 水生生物学报, 2011, 35(6): 988—997]
[4] Catalá A. An overview of lipid peroxidation with emphasis in outer segments of photoreceptors and the chemiluminescence assay [J]. The International Journal of Biochemistry & Cell Biology, 2006, 38(9): 1482—1495
[5] Sherwin E R. Oxidation and antioxidants in fat and oil processing [J]. Journal of the American Oil Chemists’Society, 1978, 55(11): 809—814
[6] Eunok C, David B M. Mechanisms and factors for edible oil oxidation [J]. Comprehensive Reviews in Food Science and Food Safety, 2006, 5(4): 169—186
[7] Mlakar A, Spiteller G. Previously unknown aldehydic lipid peroxidation compounds of arachidonic acid [J]. Chemistry and Physics of Lipids, 1996, 79(1): 47—53
[8] Catalá A. Lipid peroxidation of membrane phospholipids generates hydroxy-alkenals and oxidized phospholipids active in physiological and/or pathological conditions [J]. Chemistry and Physics of Lipids, 2009, 157(1): 1—11
[9] Monahan F J, Gray J I, Asghar A, et al. Effect of dietary lipid and vitamin E supplementation on free radical production and lipid oxidation in porcine muscle miscrosomal fractions [J]. Food Chemistry, 1993, 46(1): 1—6
[10] Schreier S M, Muellner M K, Steinkellner H, et al. Hydrogen sulfide scavenges the cytotoxic lipid oxidation product 4-HNE [J]. Neurotoxicity Research, 2010, 17(3): 249—256
[11] Kanazawa K, Ashida H, Minamoto S, et al. The effect of orally administered secondary autoxidation products of linoleic acid on the activity of detoxifying enzymes in the rat liver [J]. Biochimica et Biophysica Acta, 1986, 879(1): 36—43
[12] Sakai T, Murata H, Yamauchi K, et al. Effects of dietary lipids peroxides contents on in vivo lipid peroxidation, alphatocopherol contents, and superoxide dismutase and glutat hione peroxidase activities in the liver of yellowtail [J]. Bulletin of the Japanese Society for the Science of Fish, 1992, 58(8): 1483—1486
[13] Gao J, Koshio S, Ishikawa M, et al. Effects of dietary oxidized fish oil with vitamin E supplementation on growth performance and reduction of lipid peroxidation in tissues and blood of red sea bream Pagrus major [J]. Aquaculture, 2012, 356(1): 73—79
[14] Baker R T M, Davies S J. Muscle and hepatic fatty acid profiles and Α-tocopherol status in African catfish (Clarias gariepinus) given diets varying in oxidative state and vitamin E inclusion level [J]. Animal Science, 1997, 64(1): 187—195.
[15] Tocher D R, Mourente G, Anne V D E, et al. Comparative study of antioxidant defence mechanisms in marine fish fed variable levels of oxidised oil and vitamin E [J]. Aquaculture Journal Articles, 2003, 11(1—2): 195—216
[16] Ferraris R P, Ahearn G A. Sugar and amino acid transport in fish intestine [J]. Comparative Biochemistry and Physiololgy, 1984, 77(3): 397—413
[17] Bai Y, Ye Y T, Wang G X. The studies on protein and fat synthesized from L-tyrosine and L-proline by the intestines of C. auratus and grass carp in vitro [J]. Acta Hydrobiologica Sinica, 2008, 32(4): 501—507 [白燕, 叶元土, 王高学. 鲫鱼、草鱼离体肠道利用酪氨酸和脯氨酸合成蛋白质与脂肪的研究. 水生生物学报, 2008, 32(4): 501—507]
[18] Aw T Y. Intestinal glutathione: determinant of mucosal peroxide transport, metabolism, and oxidative susceptibility [J]. Toxicology and Applied Pharmacology, 2005, 204(3): 320—328
[19] Kimura T, Lida K, Takei Y. Mechanisms of adverse effect of air-oxidized soybean oil-feeding in rats [J]. Journal of Nutritional Science and Vitaminology, 1984, 30(2): 125—133
[20] Requena J R, Fu M X, Ahmed M U, et al. Quantification of malondialdehyde and 4-hydroxynonenal adducts to lysine residues in native and oxidized human low-density lipoprotein [J]. Biochemical Journal, 1997, 322(Pt 1): 317—325
[21] Yin Y F, Ye Y T, Cai C F, et al. Variation of the oxidation index of soybean oil in home-made oxidation device at different time [J]. Journal of Anhui Agriculture Science, 2011, 39(7): 4052—4054 [殷永风, 叶元土, 蔡春芳, 等.在自制氧化装置中氧化时间对豆油氧化指标的影响. 安徽农业科学, 2011, 39(7): 4052—4054]
[22] Quaroni A, Wands J, Trelstad R L, et al. Epithelioid cell cultures from rat small intestine. Characterization by morphologic and immunologic criteria [J]. The Journal of Cell Biology, 1979, 80(2): 248—265
[23] Shappell N W. Ergovaline toxicity on Caco-2 cells as assessed by MTT, alamar Blue, and DNA assays [J]. In Vitro Cellular & Developmental Biology-Animal, 2003, 39(7): 329—335
[24] Sanderson I R, Youping H E. Nucleotide uptake and metabolism by intestinal epithelial cells [J]. The Journal of Nutrition, 1994, 124(1): S131—S137
[25] Wu F, Jin X Q, Wu S X, et al. Direct influence of intestinal nutrients over the differentiation of mucosal epithelium of small intestine in primary culture [J]. Parenteral & Enteral Nutrition, 1998, 5(2): 96—98 [伍烽, 金先庆, 吴仕孝, 等.肠营养素对小肠黏膜上皮细胞分化的影响. 肠外与肠内营养, 1998, 5(2): 96—98]
[26] Denizot F, Lang R. Rapid colorimetric assay for cell growth and survival: modifications to the tetrazolium dye procedure giving improved sensitivity and reliability [J]. Journal of Immunological Methods, 1986, 89(2): 271—277
[27] Diesing A K, Nossol C, Panther P, et al. Mycotoxin deoxynivalenol (DON) mediates biphasic cellular response in intestinal porcine epithelial cell lines IPEC-1 and IPEC-J2 [J]. Toxicology Letters, 2011, 200(1): 8—18
[28] De Walle J V, Sergent T, Piront N, et al. Deoxynivalenol affects in vitro intestinal epithelial cell barrier integrity through inhibition of protein synthesis [J]. Toxicology and Applied Pharmacology, 2010, 245(3): 291—298
[29] Brown K I, Crabo B G, Graham E F, et al. Some factors affecting loss of intracellular enzymes from spermatozoa [J]. Cryobiology, 1971, 8(2): 220—224
[30] Cai Q, Zhou H, Xiao G X, et al. Influence of mitochondrial membrane potential (∆ψmt) and apoptosis in intestinal epithelia induced by hydrogen peroxide [J]. Medical Journal of National Defending Forces in Northwest China, 2004, 25(4): 241—244 [蔡黔, 周红, 肖光夏, 等. 过氧化氢对肠上皮细胞线粒体膜电位及细胞凋亡的影响. 西北国防医学杂志, 2004, 25(4): 241—244]
[31] Wang C, Ma H, Zhang S, et al. Safflor yellow B suppresses pheochromocytoma cell (PC12) injury induced by oxidative stress via antioxidant systemand Bcl-2/Bax pathway [J]. Naunyn-Schmiedeberg’s Archives of Pharmacology, 2009, 380(2): 135—142
[32] Baluchamy S, Ravichandran P, Periyakaruppan A, et al. Induction of cell death through alteration of oxidants and antioxidants in lung epithelial cells exposed to high energyprotons [J]. Journal of Biological Chemistry, 2010, 285(32): 24769—24774
[33] Ozden M, Demirel U, Kahraman A. Effects of proline on antioxidant system in leaves of grapevine (Vitis vinifera L.) exposed to oxidative stress by H2O2[J]. Scientia Horticulturae, 2009, 119(2): 163—168
THE WATER SOLUBLE MATTER FROM OXIDIZED SOYBEAN OIL DAMAGES DISSOCIATED INTESTINAL EPITHELIAL CELLS OF GRASS CARP (CTENOPHARYNGODON IDELLA)
YAO Shi-Bin1, YE Yuan-Tu1, CAI Chun-Fang1, YAO Lin-Jie1, XU Fan1, LIU Meng1, ZHANG Bao-Tong2,
XIAO Pei-Zhen2and WANG Li-Hong2
(1. Key Laboratory of Aquatic Nutrition of Jiangsu Province, Suzhou University, Suzhou 215123, China; 2. Open Laboratory for Aquatic Animal Nutrition, Beijing Nutrition Resources Institute, Beijing 100069, China)
The present study investigated the effects of water soluble matter from oxidized soybean oil on the growth, morphology and structure of intestinal epithelial cells (in vitro) from Ctenopharyngodon idella. The water soluble matter was applied at different concentrations for various periods of time. The activity and survival of cells were significant reduced after 6h incubation with culture medium supplemented with water soluble matter in the concentration range of 111.06—888.48 g/L. Furthermore there was an associated decrease in the size of cell colonies as well as a change in cell morphology. When the water soluble matter from oxidized soybean oil reached the concentration of 444.24 g/L, the formation of fat droplets and vesicles in cells could be observed under transmission electron microscope, as well as swelling mitochondria in cells. During 3—9h incubation, LDH activity significantly increased; there was also significant change in GSH-PX, SOD activity and T-AOC. In conclusion, during 12 hours the dissociated IECs from Ctenopharyngodon idella could be damaged by the water soluble matter from oxidized soybean oil in the concentration range of 111.06—888.48 g/L. The damage occurs primarily in the manifestation of altered growth-inhibitory, morphology, and cell structure, probably involving the lipid peroxidation in cell membrane and the subsequent destruction in cell structure. The extent of damage is correlated with the concentration and incubation time. Overall, there was significant damage of water soluble matter from oxidized soybean oil on IECs in vitro.
Ctenopharyngodon idella; Intestinal epithelial cells; Oxidized soybean oil; Cellular growth
S963.7
A
1000-3207(2014)04-0689-10

图版Ⅰ 氧化豆油水溶物对草鱼肠道黏膜细胞生长、形态、结构的影响
PlateⅠ Effect of water soluble matter of oxidized soybean oil on growth, morphology and structure of IECs
a.对照组, 3h, 细胞集落(↑); b. 处理组3, 3h, 游离细胞(↑); c. 处理组4, 3h, 折光性差的细胞(↑); d.处理组2, 12h, 大部分细胞脱落; e.处理组3, 12h; f. 对照组, 3h, 细胞集落(↑); g. 对照组, 12h, 分化成熟的细胞(↑); h.处理组3, 3h, 细胞界限模糊(↑); i.处理组4, 3h, 细胞界限模糊(↑); j. 处理组2, 12h, 细胞脱落严重(↑); k.处理组3, 12h, 细胞脱落后残留的贴壁细胞团(↑); l.对照组, 9h, 细胞生长正常, 可见细胞间紧密连接(↑); m.处理组3, 3h, 核膜皱折程度严重(↑A), 线粒体肿胀(↑B); n.处理组3, 3h, 部分细胞裂解死亡, 线粒体肿胀(↑); o.处理组3, 6h, 胞浆空泡变性严重(↑A), 线粒体肿胀(↑B), 脂肪滴沉积(↑C)
a. Control group, 3h, cell colonies (↑); b. Treatment group 3, 3h, inadherent cell (↑); c. Treatment group 4, 3h, weak refraction cells (↑); d. Treatment group 2, 12h, anoikis of most cells; e. Treatment group 3, 12h; f. Control group, 3h, cell colonies (↑); g. Control group, 12h, differentiation and maturation of cells (↑); h. Treatment group 3, 3h, cell boundaries were not clearly defined (↑); i. Treatment group 4, 3h, cell boundaries were not clearly defined (↑); j. Treatment group 2, 12h, serious anoikis of most cells (↑); k. Treatment group 3, 12h, adherent blastocyte after anoikis of cells (↑); l. Control group, 9h, normal cell growth, cell tight junction observed (↑); m. Treatment group 3, 3h, the nuclear membrane folded seriously (↑A), swelling mitochondrial (↑B); n. Treatment group 3, 3h, pyrolysis of apoptosis in some cells, swelling mitochondrial (↑); o. Treatment group 3, 6h, the formation of fat droplets (↑C) and vesicles (↑A) in cells, swelling mitochondrial (↑B)
a—e: 倒置荧光显微镜观察, ×200; f—k: Giemsa染色观察, ×200; l—o: 透射电镜观察, ×6000
a—e In flulrescence microscope, ×200; f—k Staining a monolayer cell sulture with Giemsa,×200 ; l—o In transmission electron microscope, ×6000
10.7541/2014.98
2013-05-22;
2013-11-20
国家自然科学基金项目(31172417); 苏州市应用基础(农业)项目(N313401210)资助
姚仕彬(1986—), 男, 硕士; 研究方向为水产动物营养与饲料。E-mail: yaoshibin2006@163.com
叶元土, 教授; Tel: 0512-65880179; E-mail: yeyt@suda.edu.cn

