慢性胃炎模型建立方法及其检测指标概述
杨金娜,李欣欣(综述),马晓慧,张予阳(审校)
(1.沈阳药科大学生命科学与生物制药学院,沈阳 110016; 2.天津天士力研究院,天津 300410)
慢性胃炎是多种因素引起的胃黏膜慢性炎性病变,其首要致病因素是幽门螺杆菌感染,其他致病因素包括细菌在胃内过度增殖、自身免疫、药物(如长时间服用非甾体类消炎药)、胆汁反流、吸烟、饮酒等[1-3]。2011年,由中华医学会消化内镜学分会调查结果显示,在各型慢性胃炎中,慢性非萎缩性胃炎(chronic non-atrophy gastritis,CNAG)最为常见(59.3%),其次为慢性非萎缩性或萎缩性胃炎伴糜烂(49.4%),慢性萎缩性胃炎(chronic atrophic gastritis,CAG)比例高达23.2%(但多为轻度)[4]。慢性胃炎对人们的生活质量产生了重要影响,慢性胃炎的研究是胃病研究的重要课题之一。稳定、可靠的动物模型的复制及其相关检查指标的检测是慢性胃炎相关基础与临床研究的重要基础。之前有对慢性胃炎动物模型的综述文章,但是何种模型最接近人类慢性胃炎的发生机制,并没有推荐[5]。且慢性胃炎模型造模时间较长,一般为10~24周,找到一种更快速、稳定、可靠的理想模型,成为广大实验者的迫切需求。
1 慢性胃炎动物模型的复制
1.1CNAG CNAG是指胃黏膜不伴有萎缩性改变,胃黏膜层、淋巴细胞和浆细胞为主的慢性炎性细胞浸润的慢性胃炎。临床检验时表现为内镜下可见黏膜红斑、黏膜出血点或斑块、黏膜粗糙伴或不伴水肿、充血渗出等。CNAG是一种临床常见病,非萎缩性胃炎迁延不愈将转化为萎缩性胃炎,另外CNAG患者中约10%在20年观察中发展为胃癌。因此建立人类类似的CNAG动物模型,对非萎缩性胃炎的深入研究,预防萎缩性胃炎和胃癌具有重要意义。
应用大鼠造模,分为灌胃、自由饮用和饥饱失常3个步骤[6]:①灌胃,包括乙醇和脱氧胆酸钠两种。乙醇每周2次灌胃;脱氧胆酸钠每日灌胃。②自由饮用,氨水配成两个浓度,在不同时间段分别给予。即在第1~6周给予0.05%的氨水,第7~12周给予0.1%氨水。③饥饱失常,单日禁食,双日足量喂食。三个步骤共同操作,12周后可成功建立SD大鼠慢性浅表性胃炎模型,且稳定性良好。也可采用自由饮用合并饥饱失常法,即步骤2和步骤3联用,16周后也可以成功建立大鼠慢性浅表性胃炎模型[7-8]。
1.2CAG CAG是指已经出现胃固有腺体减少的慢性胃炎,常常伴有肠上皮化生。可以分为多灶萎缩性胃炎、自身免疫性胃炎。内镜表现为苍白或灰白、红白相间(以白为主),黏液糊缩小或干枯,黏膜薄可见血管。CAG是中老年人多发疾病,目前该病的发生率有逐年上升的趋势。CAG是一个慢性过程,其发生、发展与多种因素有关,如酒精刺激、饮食过咸过烫,饥饱失常、胆汁反流等。建立类似人类慢性萎缩性胃炎动物模型对探讨该病发生机制及其预防治疗药物研究具有重要意义,目前主要有生物造模法、化学损伤法及主动免疫法3种。
1.2.1生物造模法 幽门螺杆菌感染患者中,CAG的发生率较非萎缩性胃炎高[9]。在CAG患者中,幽门螺杆菌感染阳性患者高于感染阴性患者。Meta分析结果显示,幽门螺杆菌感染和CAG发生率之间的比率为5(95%CI3.1~8.3),说明幽门螺杆菌感染者发生CAG的可能性是未感染者的5倍[10]。由于幽门螺杆菌在胃部长期定植困难,现阶段尚缺乏成功的动物感染模型。大鼠是目前常用的实验动物,但在无胃黏膜损伤情况下,大鼠很难被幽门螺杆菌感染,故很多实验须首先造成大鼠胃黏膜轻微损伤,然后再使之感染幽门螺杆菌。
选用Wistar大鼠,采取N-甲基-N-硝基-N-亚硝基胍(MNNG)+幽门螺杆菌综合方法制作CAG模型,分3个程序[11]:①自由饮用,供大鼠自由饮用MNNG,24 h更换一次,持续8周。②感染幽门螺杆菌,以消炎痛一次性皮下注射,隔日灌胃给予培养好的幽门螺杆菌菌株,共5次10 d。灌胃前后分别禁食12 h。③自由饮用,间隔2周后,再次自由饮用MNNG溶液。三个程序依次进行,12周后成功建立CAG动物模型。
1.2.2化学损伤法 乙醇联合脱氧胆酸钠法能够成功建立大鼠慢性胃炎模型,此模型病变特点与人类的慢性胃炎甚为相似,而且方法简便可靠、经济、重复性好,是一种进行慢性胃炎病因学、发病学及实验治疗学研究的较为理想模型。其造模机制为乙醇可以被胃直接吸收,在细胞醇脱氢酶的催化下产生乙醛;乙醛是一种强氧化剂,刺激胃黏膜可以导致慢性胃炎病理变化,同时灌胃脱氧胆酸钠来模拟人体胆汁酸反流,也能加速产生慢性胃炎病变。用65%乙醇+脱氧胆酸钠溶(自由饮用),经12周成功建立大鼠慢性胃炎模型[12]。或者用60%酒精(灌胃)+脱氧胆酸钠(灌胃)+氨水(自由饮用)+吲哚美辛+饥饱失常综合法,经16周也可成功复制慢性萎缩性胃炎大鼠模型[13]。
其他实验研究发现,可以单独用55 ℃盐水灌胃10周后建立大鼠模型[14];或者单独用55 ℃蒸馏水灌胃(2.5 mL/d) 24周后建立大鼠萎缩性胃炎动物模型[15];还可以单独用氨水自由饮用,连续12周造模完成[16];也可以将MNNG+水杨酸钠+热盐水+饥饱失常4个因素合并制作萎缩性胃炎大鼠模型[17]。
Rodrígue等[18]采用BALb/c雄性小鼠,单笼喂养,每日自由饮用乙酰水杨酸溶液,10 d后也可成功造成慢性胃炎模型,这是目前报道中成模时间最短的一种造模方法,但其可重复性和模型稳定性需要更多数据进行支持。
1.2.3主动免疫法 CAG患者血中常可以检测到两种抗体,即壁细胞抗体和内因子抗体。壁细胞抗体是针对壁细胞微管膜上H+-K+-ATP酶的抗体,与壁细胞抗原结合形成抗原抗体复合物,在补体的参与下,破坏壁细胞,形成慢性胃炎。细胞免疫在CAG特别是伴恶性贫血患者的发病机制中也起到重要作用。目前研究者采用主动免疫法建立CAG模型,实验采用 Wistar大鼠,皮下注射佐剂抗原,3周后重复注射1次,饥饱失常,6周模型复制成功[19]。
2 检测指标
目前慢性胃炎模型复制成功与否的判断主要根据病理组织学检查,胃组织形态的观察结果作为辅助。新的可视化技术还可对胃黏膜损伤面积进行评价,进而清晰地显示出胃黏膜受损情况。此外,胃蛋白酶、胃泌素、胃酸、表皮生长因子(epidermal growth factor,EGF)、一氧化氮等机制相关检测指标也被大量研究者监测,为慢性胃炎的发病机制研究提供帮助。下面将介绍慢性胃炎实验研究中常用的检测指标。
2.1模型成功判断性指标
2.1.1胃组织形态直接观察 观察指标包括胃部大小、胃壁厚度、皱襞数量、黏膜色泽及出血等大体情况。正常组大鼠胃黏膜呈浅红色,表面光滑,附着许多黏液,全层胃壁较厚,皱襞规则,富有弹性。模型组大鼠黏膜色苍白,胃壁弹性较差,皱襞平坦或走向紊乱,黏膜层变薄,附着少量黏液,部分大鼠胃黏膜会出现出血点。
2.1.2病理组织学检测 2013中国慢性胃炎共识意见指出,慢性胃炎观察内容包括5项组织学变化和4个分级(图1)[4]。5项组织学变化包括幽门螺杆菌感染、慢性炎症(单个核细胞浸润)、活动性(中性粒细胞浸润)、萎缩(固有腺体减少)、肠化生(肠上皮化生)。4级包括0:无炎症;+:在胃黏膜上皮内(胃小凹区) 或固有腺底部可见多个慢性炎细胞;++:在胃黏膜小凹区至黏膜肌层均有较多炎性细胞浸润;+++:胃黏膜内可见成堆炎细胞聚集灶。并用测微器测量胃窦固有腺厚度和固有腺层切面面积[1,12,20]。
慢性萎缩性胃炎造模成功判断标准为光学显微镜显示,胃黏膜全层明显变薄,局灶上脱落糜烂,黏膜固有腺体数量明显减少,排列稀疏紊乱,腺体体积缩小,个别呈囊状扩张,黏膜固有层淋巴细胞浸润,部分有淋巴滤泡形成[21]。
2.2胃黏膜损伤评价 幽门下结扎,由食管向胃腔注入缓冲盐溶液,食管结扎,取胃固定。15 min后沿胃大弯剪开暴露胃腔,用Image-Pro Plus软件分析胃内表面损伤面积,计算黏膜损伤率[7]。
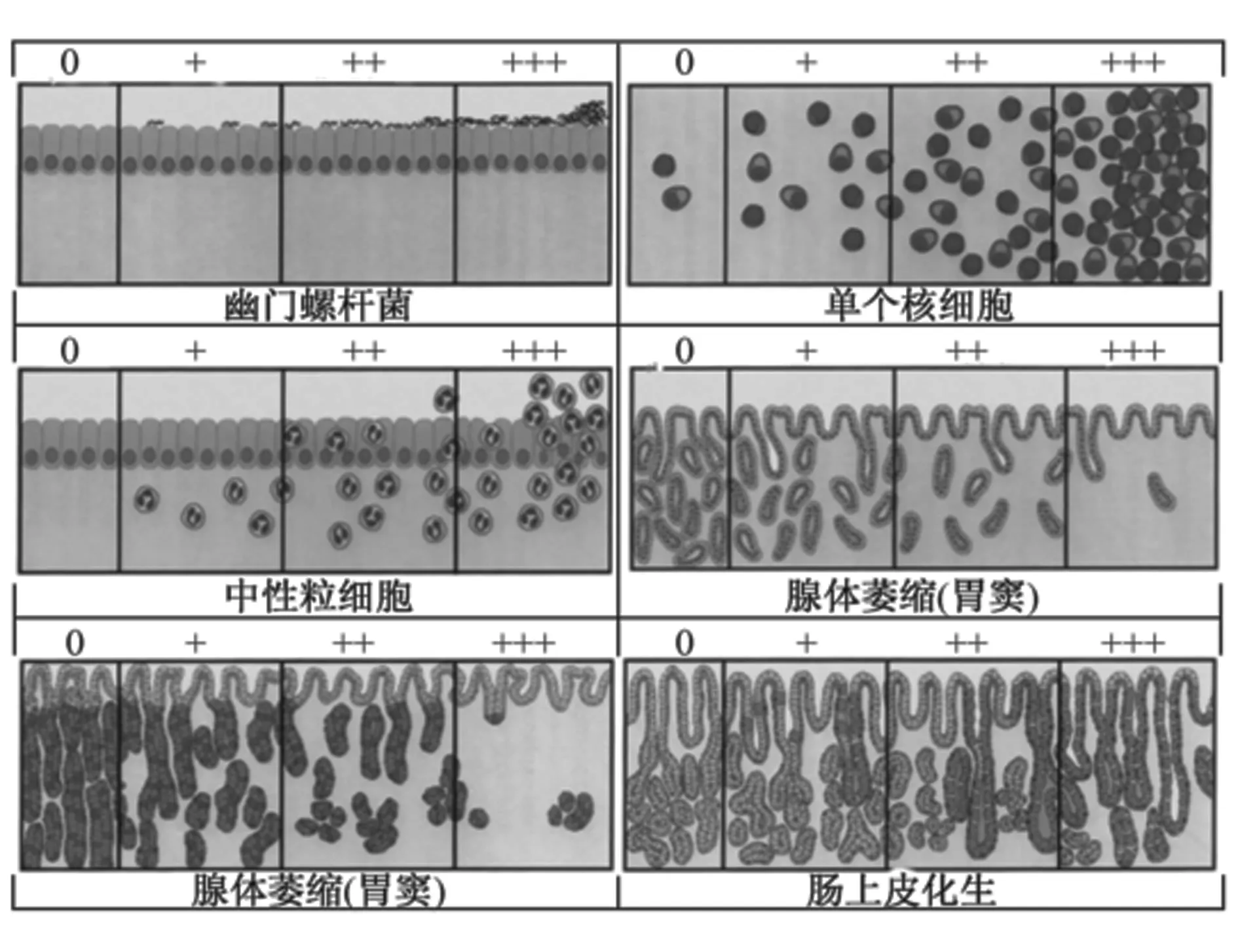
图1 慢性胃炎的病理诊断标准(直观模拟评分法)
2.3慢性胃炎其他调控因子
2.3.1炎性因子 Toll样受体4是介导天然免疫与炎性反应的模式识别受体,可识别外源性、内源性配体,经髓样分化因子88依赖和非髓样分化因子88依赖信号转导途径,激活核因子κB,引起各种炎性因子释放,诱发炎性反应[22]。还可以通过测定白细胞介素2、白细胞介素10、干扰素γ、肿瘤坏死因子α、白细胞介素1β等炎性相关因子来研究胃炎炎症的发生、发展。
2.3.2胃部分泌物 游离酸、总酸、胃蛋白酶、胃泌素与胃酸分泌息息相关,因此用来研究胃酸分泌相关机制。而通过测定游离黏液量来研究黏液HCO3-盐相关机制。
2.3.3其他调控因子 一氧化氮是由精氨酸转化而来,可调节淋巴细胞机制,通过炎性反应,可刺激内皮型一氧化氮合酶,合成释放一氧化氮,使毛细血管扩张,通透性增强,可使组织受到损伤。通过测定一氧化氮及一氧化氮合酶的水平可以研究胃黏膜损伤情况,同时可以测定血流量的变化。
超氧化物歧化酶是一种重要的抗氧化酶,可以清除自由基,从而保护生物体免受自由基的攻击,是胃黏膜的保护因子之一;丙二醛是胃黏膜的攻击因子之一。因而丙二醛的测定常常与超氧化物歧化酶的测定相互配合,在胃黏膜损伤过程中,超氧化物歧化酶的活性降低,丙二醛的水平升高。因此,可以通过测定超氧化物歧化酶和MDA来研究胃黏膜细胞损伤情况。
Bcl-xL是Bcl-2家族蛋白,可以与其他促凋亡蛋白形成异源二聚体而抑制细胞凋亡,亦可与凋亡蛋白酶活化因子作用或抑制线粒体胱天蛋白酶激活物细胞色素C的释放而发挥抗凋亡作用。Bax是Bcl-2R的同源基因,由p53直接激活,可提高凋亡敏感性,促进p53介导的细胞凋亡。Bcl-xL和Bcl的表达状况可反映细胞的凋亡状态。因此,通过检测Bcl-xL和Bax的表达来研究细胞凋亡相关机制[12]。
慢性胃炎中通过检测EGF及其受体来研究胃黏膜损伤后的修复情况[23]。慢性炎症刺激破坏胃黏膜后,出现反应性EGF升高,进而促进黏膜细胞增殖与修复。EGF受体具有酪氨酸激酶活性,对EGF具有高亲和力,并具有特异性。而受体酪氨酸激酶的活性大小主要受EGF水平的影响,因此检测EGF及其受体的变化能够研究胃黏膜损伤修复相关机制。
3 小 结
慢性胃炎模型采用了许多与人类近似的病因、发病机制以及病证结合的方法进行复制,但与人类的实际发病因素比较还是有一定的差距,每一种模型都具有各自的特点,反映了不同致病因子的作用特点,因此如何选择合适的模型复制方法,应根据研究的具体内容进行设计。但是目前慢性胃炎实验研究还处于探索阶段,造模时间长,耗费大量人力、物力和时间,在机制研究上也未见重大突破,病理检测是其目前唯一的金标准。该文希望能够从模型建立和指标检测两个方面为实验工作者提供文献参考方面的帮助,选择合适的动物模型,尽量缩减实验时间,并进行较为全面的指标检测。
[1] Redéen S,Petersson F,Kechagias S,etal.Natural history of chronic gastritis in a population-based cohort[J].Scand J Gastroenterol,2010,45(5):540-549.
[2] Lillehoj EP,Guang W,Ding H,etal.Helicobacter pylori and gastric inflammation:Role of MUC1 mucin[J].J Pediatr Biochem,2012,2(3):125-132.
[3] Oluwasola AO,Otegbayo JA,Ola SO,etal.Correlation of cag-A serological status with histological parameters of chronic gastritis among dyspeptic patients in south western Nigeria[J].Afr J Med Med Sci,2012,41(3):289-295.
[4] 房静远,刘文忠,李兆申,等.中国慢性胃炎共识意见[J].胃肠病学,2013,18(1):24-36.
[5] 姚春,李娜.慢性胃炎动物模型复制的实验研究进展[J].辽宁中医药大学学报,2010,12(1):14-16.
[6] 任守忠,马志健,王继浩,等.大鼠慢性浅表性胃炎模型的建立[J].中国实验方剂学杂志,2011,17(17):191-194.
[7] 林晓春,陈育尧,白殊同,等.安胃疡抗炎镇痛作用及对慢性浅表性胃炎大鼠胃粘膜损伤的抑制[J].中药药理与临床,2013,29(2):74-77.
[8] 林晓春,陈育尧,白殊同,等.甘草总黄酮对慢性浅表性胃炎大鼠胃粘膜损伤的保护作用[J].南方医科大学学报,2013,33(2):299-304.
[9] de Vries AC,Meijer GA,Looman CW,etal.Epidemiological trends of pre-malignant gastric lesions:a long-term nationwide study in the Netherlands[J].Gut,2007,56(12):1665-1670.
[10] Vannella L,Lahner E,Annibale B.Risk for gastric neoplasias in patients with chronic atrophic gastritis:a critical reappraisal[J].World J Gastroenterol,2012,18(12):1279-1285.
[11] 张琳,姚冬梅,姚希贤,等.大鼠Hp相关性慢性胃炎模型的制做[J].中国比较医学杂志,2004,14(3):161-165.
[12] 陈贺,张慧颖,刘禾,等.联合化学刺激法所致大鼠慢性胃炎模型[J].实验动物科学,2010,27(1):22-24.
[13] 王常松,杨敏,俞杰,等.人参丹参对萎缩性胃炎鼠模型胃黏膜保护及对Bcl-xL、Bax、TLR4和NF-κB p65表达影响随机平行对照研究[J].实用中医内科杂志,2012,26(2):19-20.
[14] 张沥,张玲霞,徐俊荣,等.热盐水致大鼠萎缩性胃炎动物模型建立[J].世界华人消化杂志,2002,10(5):571-574.
[15] 张沥,张玲霞,陶梅,等.热水致大鼠萎缩性胃炎胃黏膜超微结构变化[J].世界肿瘤杂志,2007,6(1):7-10.
[16] 耿增岩,黄悦,陈金铭.太白米正丁醇萃取物对大鼠慢性胃炎作用的实验研究[J].吉林中医药,2009,29(6):527-528.
[17] 张彩.“解毒活血方”对萎缩性胃炎大鼠血浆内皮素-1、血栓素B-2和6-酮-前列腺素F-1含量的影响[D].石家庄:河北医科大学,2009.
[18] Rodríguez C,Medici M,Mozzi F,etal.Therapeutic effect of Streptococcus thermophilus CRL 1190-fermented milk on chronic gastritis[J].World J Gastroenterol,2010,16(13):1622-1630.
[19] 张淑芹,赵林山,郑继奎,等.慢性萎缩性胃炎动物模型的复制[J].哈尔滨师范大学自然科学学报,2001,17(6):81-83.
[20] 翦林宏,彭志辉,陈立峰,等.大鼠慢性萎缩性胃炎模型的建立[J].中国比较医学杂志,2007,17(3):161-163.
[21] 韦维,林寿宁,朱永苹.安胃汤对慢性萎缩性胃炎模型大鼠肠三叶因子基因表达的影响[J].中国实验方剂学,2011,17(3):159-162.
[22] 陈宇,任健,刘家义.疏肝健脾方药对慢性胃炎大鼠模型Bax,Bcl-2蛋白表达的影响[J].辽宁中医药大学学报,2013,15(2):28-29.
[23] 陈铖,龙子江,蔡曼曼,等.胃舒灵对慢性胃炎模型大鼠胃黏膜EGF和EGFR表达的影响[J].中国实验方剂学杂志,2013,19(4):283-285.

