大鼠骨髓间充质干细胞体外诱导分化为心肌样细胞的研究
顾 健,王爱玲,郝玉瑜,张梦达,孙继敏
(安徽医科大学第一附属医院心血管内科,合肥230022)
骨髓间充干细胞(bone marrow mesenchymal stem cells,BMSCs)具有易于获取、在一定条件下能大量扩增,同时自体移植不存在伦理争议,也没有免疫排斥反应且在体内外可诱导分化为内皮细胞、心肌细胞等优势[1-2]。研究发现,BMSCs在体内、体外诱导环境下,可分化为心肌样细胞,但其机制尚不明确[3]。本实验将大鼠BMSCs分别用5-氮胞苷诱导和与心肌细胞共培养的方法进行体外诱导,观察大鼠BMSCs在不同时间段分化为心肌样细胞的能力及表达心肌细胞特异性标志物心肌特异性基因肌钙蛋白I(cardiac-specific troponin I,cTnI)、缝隙连接蛋白43(connexin 43,Cx43)和心肌特异性转录因子4(cardiac-specific transcription factor-4,GATA-4)的差别,为今后进一步研究BMSCs分化机制以及应用于临床治疗缺血性心脏病提供一定的理论依据和技术手段。
1 材料与方法
1.1实验动物 健康雄性SD大鼠16只,均为4周龄,质量80~120 g。同种新生1~3 d乳鼠40只,雌雄不限,用于分离培养心肌细胞。实验动物均由安徽医科大学实验动物中心提供。
1.2试剂及仪器 高糖细胞培养液(high glucose dulbecco′s modified eagle medium,H-DMEM)(杭州四季青公司提供),胎牛血清(Fetal bovine serum,FBS) (Hy-clone公司提供),5-氮胞苷、0.25%胰蛋白酶、0.125%胰蛋白酶(美国Sigm公司),反转录-聚合酶链反应(reverse transcriotion-polymerase chain reaction,RT-PCR)试剂盒(Invitrogen),cTnI、Cx43、GATA-4引物[生工生物工程(上海)有限公司生产,批号依次为ASW10353/4,ASW10351/2,120421L54/5],兔抗大鼠cTnI单克隆抗体、兔抗大鼠CX43多克隆抗体[生工生物工程(上海)有限公司],Ⅸ70型倒置显微镜(日本OLYMPUS TOLYO公司),荧光显微镜及摄像成像系统(上海精密科学仪器有限公司),PCR扩增仪(德国 Biometra T系列)、PCR电泳槽和凝胶成像系统等。
1.3BMSCs及心肌细胞的分离和培养 无菌条件下采集双侧股骨和胫骨骨髓,用含肝素的H-DMEM反复冲洗骨髓腔,收集冲洗液,离心、弃上清,加入含20% FBS、10×104U/L青霉素G、100 mg/L链霉素的H-DMEM培养液4 mL悬浮沉淀细胞,接种于25 cm2塑料培养瓶,放入37 ℃的5%CO2孵箱中进行原代培养。72 h后首次换液,每2~3日换液1次。倒置显微镜每日观察细胞生长情况和形态变化。当细胞约达80%融合时,用0.25%胰蛋白酶消化,按1∶2或1∶3传代,通过不断换液与传代逐渐纯化扩增BMSCs,取第三代细胞用于实验。
取新生1~3 d的SD乳鼠,开胸取出心脏,将心脏剪成1 mm3大小的碎块,再将心脏碎片转移至离心管中,加入0.125%胰蛋白酶5 mL,于37 ℃恒温水浴下消化5 min,将消化悬液转移至新离心管,用含20%FBS、10×104U/L青霉素G、100 mg/L链霉素的培养液3 mL终止消化,制成细胞悬液。按上述步骤消化心肌组织4~5次,直至其消化完全。弃掉首次细胞消化悬液,收集余下细胞悬液,离心、弃上清,细胞沉淀用含20%FBS、10×104U/L青霉素G、100 mg/L链霉素的培养液重悬,接种于25 cm2塑料培养瓶,在37 ℃ 5%CO2培养箱中培养,差速贴壁法培养60 min后更换新培养基以纯化心肌细胞。此后每2~3日换液1次,并用倒置显微镜每日观察细胞生长情况和形态变化。
1.4体外诱导BMSCs分化为心肌样细胞的实验观察 本实验将大鼠BMSCs分别用5-氮胞苷诱导和与心肌细胞共培养的方法进行体外诱导,观察大鼠BMSCs在不同时间段分化为心肌样细胞的能力及表达心肌细胞特异性标志物。① 5-氮胞苷诱导组:取第三代BMSCs,消化后吹打成细胞悬液,按1×108/L接种于覆盖有盖玻片的6孔板,加入10 μmol/L的5-氮胞苷进行诱导,2 d后换回含15%FBS、10×104U/L青霉素G、100 mg/L链霉素的H-DMEM培养液继续培养,根据培养液颜色变化,每2~3日换液1次。②BMSCs与心肌细胞共培养组:取第三代BMSCs与培养第3日的心肌细胞按细胞数量比1∶2混匀,按1×108/L接种于覆盖有盖玻片的6孔板,进行共培养。③对照组:取第三代BMSCs接种于覆盖有盖玻片6孔培养板,密度同前,加入含15%FBS、10×104U/L青霉素G、100 mg/L链霉素的H-DMEM培养基单独培养。倒置显微镜每日观察3组细胞生长情况,在培养的第2、4、6、8、10周取6孔板中的4孔分离细胞,用RT-PCR检测cTnI、CX43和GATA-4基因表达情况(引物见表1),免疫荧光细胞化学染色检测心肌细胞的cTnI和Cx43相关蛋白的表达。

表1 RT-PCR扩增cTnI、CX43和GATA-4所用引物
RT-PCR:反转录-聚合酶链反应;cTnI:肌钙蛋白I;CX43:缝隙连接蛋白43; GATA-4:心肌特异性转录因子4

2 结 果
2.1BMSCs培养情况 BMSCs分离后2~4 h开始贴壁,24 h贴壁完全,细胞形态由圆形、椭圆形逐渐延伸为梭形、多角形,第3~5日细胞开始融合,第7~9日融合可达80%。传代细胞增殖迅速,3~5日可长满瓶底。随着换液与传代,BMSCs逐渐得到纯化。第18~22日可得到第三代细胞,此时细胞多呈梭形,排列方向趋于一致(图1,见封三)。
2.2心肌细胞的培养及鉴定情况 心肌细胞贴壁前为圆形或椭圆形,培养60 min后开始贴壁,约24 h后贴壁完全,贴壁后细胞多呈梭形、短杆状,部分为星形、多角形。第2~3日可出现节律性自发搏动细胞,成簇细胞搏动较明显且搏动频率不一致,为60~80次/min(图2,见封三)。培养第3日的心肌细胞经免疫荧光检测可见有cTnI和Cx43的表达,可见有肌管样结构(图3-1~图3-4,见封三)。
2.3各组细胞形态与生长变化情况 对照组:细胞形态多为梭形,均匀一致,随着培养时间的延长细胞呈集落或是漩涡状生长,培养至第10周时部分细胞很难消化且细胞密度较大的细胞群部分崩解,未见有搏动细胞。5-氮胞苷诱导组:5-氮胞苷诱导后部分细胞脱壁死亡,第7日时细胞体积变大,多呈梭形,部分成杆状,培养至第4周时细胞呈均一的长梭形,集落样或是漩涡状生长,到第10周时细胞部分崩解,未见有搏动细胞。共培养组:BMSCs与心肌细胞共培养1~2 h后即贴壁生长,BMSCs呈长梭形,较心肌细胞更为细长,但没有节律性搏动,1周后BMSCs有趋向搏动心肌细胞的生长趋势,此后这些梭形细胞呈集落样生长,2周后可见心肌细胞周边部分BMSCs搏动,频率为20~40次/min,4周后搏动频率为40~60次/min,此时细胞呈肌性排列,随着培养时间延长,搏动细胞增多,8周后可见部分细胞死亡,10周后搏动细胞较前减少,死亡细胞数增加。
2.4各组RT-PCR及电泳鉴定结果 对照组:cTnI、Cx43和GATA-4mRNA未见有表达;5-氮胞苷诱导组:第2周时cTnI、Cx43和GATA-4mRNA均有表达,GATA-4 mRNA第6周达到高峰,cTnI和Cx43mRNA第8周达高峰,第8、10周未见有统计学差别(图4-1)。共培养组:cTnI和Cx43mRNA第2~8周表达逐渐增加,第8、10周表达未见有统计学差别;GATA-4第6周达高峰(图4-2)。
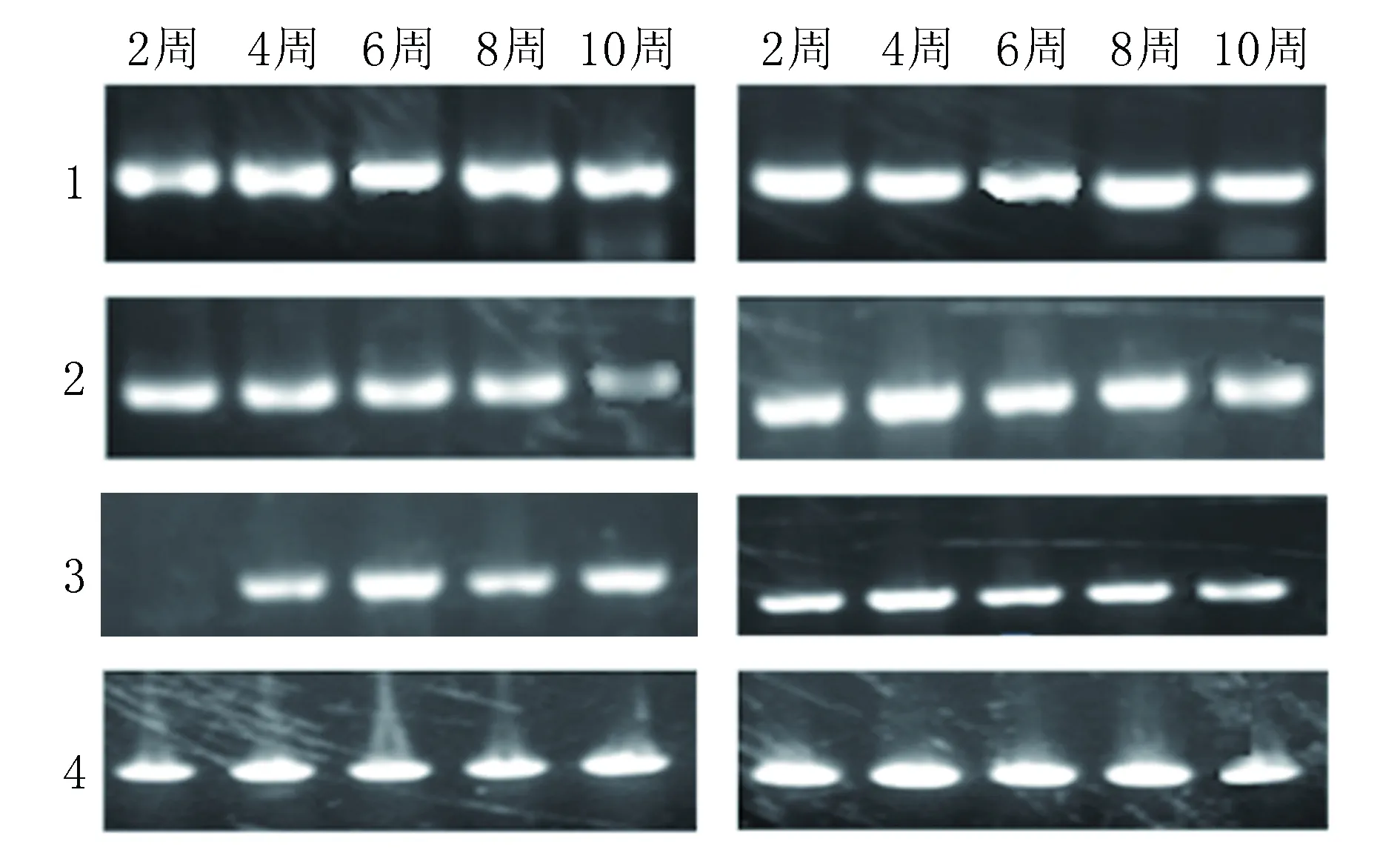
4-1 5-氮胞苷诱导组4-2 共培养组
图45-氮胞苷诱导组与共培养组目的基因电泳结果Fig1为内参GAPDH;Fig2为cTnI的基因表达;Fig3为GATA-4的基因表达;Fig4为Cx43的基因表达
2.5各组数据统计分析结果 GATA-4 mRNA在共培养组及5-氮胞苷诱导组的表达未见有统计学差异(P>0.05),而共培养组及5-氮胞苷诱导组中cTnI mRNA、Cx43 mRNA的表达有统计学差异(P<0.05),且共培养组组中cTnI mRNA、Cx43 mRNA的表达较5-氮胞苷诱导组强,差异具有统计学意义(表2)。

表2 共培养组及5-氮胞苷诱导组GATA-4、cTnI和Cx43mRNA的表达 (n=4)
3 讨 论
诱导BMSCs向心肌细胞分化的研究中,5-氮胞苷是目前比较公认的可体外诱导BMSCs分化为心肌样细胞的药物[4]。5-氮胞苷是一种DNA甲基转移酶抑制剂,Fukuda[5]首次证明5-氮胞苷可体外诱导成年鼠骨髓细胞转化为心肌样细胞,转化后的细胞有肌管形成,具有典型的肌小节结构和心肌样的动作电位等心肌细胞特有的特征,组织学显示cTnI和肌凝蛋白重链阳性。表明BMSCs体外经5-氮胞苷诱导后向心肌样细胞分化特性,但其机制尚不完全明确。近几年研究表明,BMSCs向心肌样细胞分化的过程中,体内心肌环境或体外“心肌样”环境比单纯的化学物质诱导更为重要。袁岩等[6]通过BMSCs与心肌细胞裂解液共培养的方法,体外模拟心肌微环境,结果发现分化后的细胞存在α肌动蛋白、心脏特异性cTnT、Cx43的表达。认为体内心肌环境因素包括细胞间的直接接触、电机械刺激以及心肌细胞分泌的某些细胞因子等。
基因GATA家族是一类锌指蛋白转录因子,该家族目前共有6个成员:GATA1~6 是一组组织特异性表达的转录调节因子,在多种组织的分化和发育中起重要作用。GATA-4参与了心肌的分化和发育,其表达对心肌细胞标志物β肌球蛋白重链、心肌肌钙蛋白、钠钙离等转录和表达至关重要。GATA-4参与小鼠心脏发育的整个过程的表达,在心肌层中的表达一直持续至出生后[7]。本实验结果表明,GATA-4 mRNA在5-氮胞苷诱导及与乳鼠心肌细胞共培养组均有表达,说明BMSCs有向心肌细胞分化的潜能,两组GATA-4 mRNA表达无统计学意义,推测可能与细胞生长环境有关。缝隙连接是一种膜结构,系由一系列细胞间通道构成,介导相邻细胞间电和化学信号的传递。它们由Cx组成,是心肌细胞的特征之一。Cx43是心室肌细胞的主要的Cx。cTnI是心肌细胞的特异性蛋白。肌钙蛋白由球形亚单位TnT、TnI和TnC构成,TnI球蛋白相互作用,肌钙蛋白和原肌球蛋白构型变化,则是由Ca2+与TnC结合后引起,通过一系列变化后引起粗细肌丝之间的相对滑动,最终使心肌纤维收缩。本实验中BMSCs经诱导分化后,RT-PCR结果提示分化后BMSCs心肌特异性基因cTnI表达为阳性,表明诱导后细胞含有心肌特异性结构蛋白,而心肌结构蛋白的出现是心肌细胞收缩的基础。5-氮胞苷诱导组未见有搏动细胞,可能与细胞生长环境、5-氮胞苷诱导剂量等相关。与乳鼠心肌细胞共培养组有搏动频率不一致的搏动细胞出现,靠近心肌细胞处搏动较明显,在培养的第2~6周可见搏动频率不一的搏动细胞增多,第8~10周搏动细胞数有所减少,且搏动频率较前降低,同时细胞死亡数较前明显增多,这可能与细胞生长环境变化等因素有关。
本实验中cTnI、Cx43及GATA-4仅在诱导组细胞有表达。在一定时间内,随着培养时间的延长共培养组上述基因的表达较5-氮胞苷诱导组强,但培养10周以后三者的表达未见有明显差别。5-氮胞苷诱导组未见有搏动细胞,说明该组细胞尚不完全具备成熟心肌细胞的功能,而与乳鼠心肌细胞共培养组不同时段有搏动频率不一的搏动细胞,且靠近心肌细胞的细胞搏动明显,这可能与搏动心肌细胞的机械刺激有关。实验表明,BMSCs于体外在5-氮胞苷诱导及与乳鼠心肌细胞共培养条件下,可被诱导分化为心肌样细胞。诱导分化后的BMSCs的生长及其细胞状态的维持需要稳定的生长环境。心肌微环境是促进BMSCs定向分化为心肌样细胞的因素之一。诱导分化后的BMSCs尚不完全具备成熟心肌细胞的功能。因此,探寻适合BMSCs定向分化的最佳状态、观察已分化心肌样细胞的功能、寻找BMSCs分化为功能性心肌细胞的方法、以及如何保持其长期分化潜能及分化后的状态仍需进一步研究。
[1] Chen G,Nayan M,Duong M,etal.Marrow stromal cells for cell-based therapy:the role of antiinflammatory cytokines in cellular cardiomyoplasty[J].Ann Thorac Surg,2010,90(1):190-197.
[2] Zhu X,Du J,Liu G.The comparison of multilineage differentiation of bone marrow and adipose-derived mesenchymal stem cells[J].ClinLab,2012,58(9/10):897-903.
[3] Polisetti N,Chaitanya VG,Babu PP,etal.Isolation,characterization and differentiation potential of rat bone marrow stromal cells.Vemuganti GK[J].Neurol India,2010,58(2):201-208.
[4] Ling SK,Wang R,Dai ZQ,etal.Pretreatment of rat bone marrow mesenchymal stem cells with a combination of hypergravity and 5-azacytidine enhances therapeutic efficacy for myocardial infarction[J].Biotechnol Prog,2011,27(2):473-482.
[5] Fukuda K.Molecular characterization of regenerated cardiomyocytes derived from adult mesenchymal stem cells[J].Congenit Anom Kyoto,2002,42(1):1-9.
[6] 袁岩,陈连凤,张抒扬,等.心肌细胞裂解液对骨髓间充质干细胞向心肌细胞分化诱导作用的研究[J].中华心血管病杂志,2005,33(2):170-173.
[7] Harlan SM,Reiter RS,Sigmund CD,etal.Requirement of TCTG(G/C) Direct Repeats and Overlapping GATA Site for Maintaining the Cardiac-Specific Expression of Cardiac troponin T in Developing and Adult Mice[J].Anat Rec (Hoboken),2008,291(12):1574-1586.

