小鼠肺炎病毒在严重呼吸道病毒感染中的研究进展
崔玉秀,侯铁永,胡 菊,吴振永,马少林(综述),曾瑞红(审校)
(1.保定市第二中心医院检验科,河北 保定 072750; 2.河北医科大学免疫教研室,石家庄 050017;3.保定市第二中心医院肿瘤科,河北 保定 072750)
没有任何一个动物模型能复制人类疾病的所有方面和特征,人类和黑猩猩是人类呼吸道合胞病毒(human respiratory syncytial virus,hRSV)的天然宿主,而小鼠不是。由于小鼠限制hRSV在其肺部复制,而且hRSV感染小鼠不能完全复制hRSV感染婴幼儿的临床症状和免疫病理反应,因此hRSV/小鼠模型不是研究疫苗增强性免疫病理机制理想的动物模型[1]。近年来出现一个非常具有吸引力的模型,即小鼠肺炎病毒(pneumonia virus of mice,PVM)/小鼠模型,PVM与hRSV均是副黏病毒科肺炎病毒亚科成员,小鼠是PVM的天然宿主。
1 PVM/小鼠模型的优势
PVM和RSV病毒都属于副黏病毒科,肺病毒属,有包膜,负性单链RNA病毒。多态病毒粒子在活体肺组织中复制周期是24~30 h[2]。研究表明,PVM感染的小鼠与RSV感染的婴幼儿的临床症状以及炎性病理反应是一致的[3]。RSV感染小鼠需要的剂量很大,约105TCID50,而PVM感染小鼠仅需要102TCID50,因此后者更有利于研究。PVM的基因组分子结构最早由Easton等[4]提出来,近来被许多综述所引用。PVM基因结构和hRSV的基因结构比较见图1[5]。
2 重组PVM
Dibben等[6-7]应用反向遗传学方法成功地重组PVM的复制形式,使用这一系统,探讨了病毒M2-1、M2-3和P,开启了PVM15病毒株在体外基因的活性和评估可塑性转录起始位点的框架。Krempl等[8]测定全长G蛋白在体内对PVM15病毒株至关重要,而G蛋白仅胞尾区促进体质量减轻。
3 炎性反应和疾病严重程度的关系
PVM为天然宿主,并且与进化相关,通过对PVM的研究可达到对RSV炎性反应的研究。Domachowske等[9]报道了强大的病毒复制单位(滴度为108pfu/gm,肺组织),小鼠发病的标志为身体蜷缩,毛发竖起,体质量减轻和死亡率升高。高致病性病毒株PVMJ3666的最小接种剂量就有反应[9-10]。PVM可在支气管上皮细胞引起免疫反应,这与RSV在人类的验尸标本中分布相似[11]。通过支气管镜检查感染小鼠的肺泡灌洗液和肺组织,显示明显的炎性反应,最显著的是招募大量粒细胞和严重的肺水肿,与急性呼吸窘迫综合征的临床症状一致,严重的炎症、水肿和招募粒细胞与Welliver等[12]对RSV的诊断验尸样本评估相一致PVM在局部复制就可引起巨噬细胞炎性蛋白(macrophage inflammatory protein,MIP)1α、MIP-2、单核细胞趋化蛋白(monocyte chemoattractant protein,MCP)1和γ干扰素的变化。
4 MIP-1α/CC趋化因子配体3是病毒引起炎性反应的组成部分
PVM与流感病毒小鼠模型的研究结果类似,趋化因子MIP-1α/CC趋化因子配体3是PVM感染招募粒细胞的至关重要的因子[13]。MIP-1α/CC趋化因子配体3基因敲除小鼠容易感染PVM,用相同的接种量接种小鼠,肺组织产生的粒细胞与未敲除基因的小鼠相比显著较少,据报道趋化因子受体1和MIP-1α(中性粒细胞和嗜酸性粒细胞主要受体)基因敲除小鼠感染后有相似的结果[13]。这一发现对根据病毒导致的炎性反应及其具体的相关病理设计免疫调节方案很有益[14]。
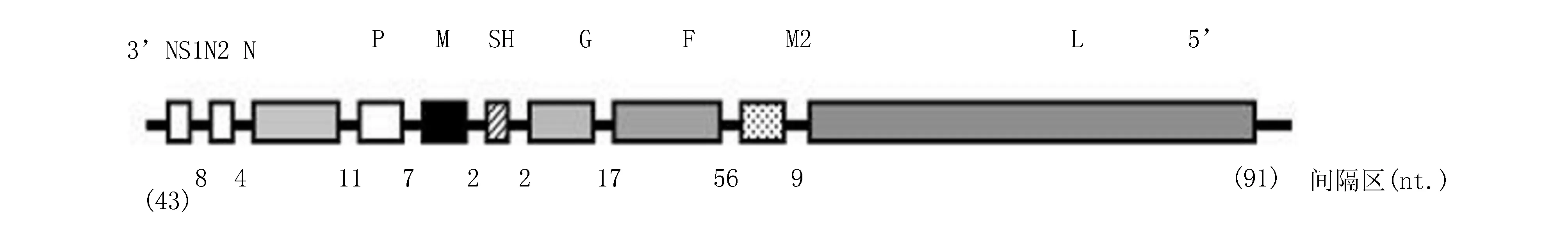
图1PVM的基因组结构NS1和NS2:非结构蛋白;N:核蛋白质;P:磷蛋白质;M:母蛋白;SH:表面狂犬蛋白;
G:吸附蛋白;F:溶解蛋白;M2基因和L:聚合酶蛋白
5 Toll样受体4的作用
关于Toll样受体(Toll-like receptors,TLR)4是否有抵抗呼吸道病毒感染的宿主防御作用,特别是RSV,有研究者对此进行了研究。Kurt-Jones等[15]报道了长期观测病毒颗粒在肺组织TLR缺失的基因敲除的C57BL/10ScCr小鼠,证明存在白细胞介素12受体β2的一个点突变。Ehl等[16]认为,这是由于缺乏白细胞介素12,而非TLR4基因缺失导致了RSV特异性T细胞免疫。Faisca等[17]比较了野生型和TLR4基因缺失型小鼠感染PVM后的反应,观察到病毒复制、体质量减轻、肺功能组织学方面没有区别。van der Sluijs等[18]研究的另一种天然病原体仙台病毒的反应,与Faisca等[17]研究的结果一致。在宿主抵抗天然的呼吸道病毒感染防御功能方面,TLR3、TLR7已经被认为有抵抗RSV宿主防御功能,这可能是天然PVM病原体模型的研究课题[18]。
6 Ⅰ型干扰素受体基因缺失小鼠的不同反应
肺部病毒有不寻常的抗干扰素功能,因为它们不限制干扰素的产生,也不干涉其与受体结合或信号转导,因此有关干扰素和干扰素介导的信号转导机制对促炎因子通路的作用和调节趋化因子的产生受到特别关注。已经发现在野生型和缺乏Ⅰ型干扰素受体小鼠(α/β干扰素受体基因缺失的小鼠)之间的细胞因子基因表达存在差异[19]。在PVM感染后,野生型小鼠比α/β干扰素受体基因敲除小鼠优先引起干扰素抗病毒反应基因的转录;报道显示,PVM感染也导致血清嗜酸性粒细胞趋化因子2、胸腺活化调节趋化因子和促炎核糖核酸酶和小鼠嗜酸性粒细胞相关的RNA酶的表达增高,此现象长期存在于α/β干扰素受体基因敲除小鼠[19]。
7 T淋巴细胞应答、过敏和免疫
虽然最初PVM的细胞内应答几乎存在于所有粒细胞,但是Claassen等[20]研究发现,PVM接种需要的病毒量比较少,非致病性接种后的第8日CD8+T细胞大量增加;对3个PVM特异性T细胞表达进行鉴定,包括P磷蛋白(P261~269)、M基质蛋白(M43~51)和F融合蛋白(F304~312)显示,PVM特异性的CD8+T细胞相对较少,只有10%~20%的P261引起CD8+T细胞产生干扰素γ和肿瘤坏死因子α,细胞因子刺激后产生免疫应答,这一缺陷应答与RSV和仙台病毒5感染后的特征相似[21]。
Claassen等[22]已确定了PVM的CD4+T细胞表位;氨基酸381-385内的G糖蛋白证明了当小鼠CD4+T细胞和上述P261的CD8+T细胞表位肽同时免疫小鼠后对PVM起到的免疫性保护作用,PVM-G的特异性CD4+T细胞招募到肺部后产生γ干扰素和白细胞介素5。
8 PVM与辅助性T细胞2型应答的关系
Barends等[23]报道,PVM抵抗卵清蛋白的同时,导致辅助性T细胞2型细胞因子的mRNA水平增高和相关肺组织嗜酸性粒细胞的浸入。
9 小 结
使用PVM/小鼠模型探讨呼吸道病毒感染最主要的目的是提高对严重疾病分子基础的认识,用以设计全新的治疗策略。PVM/小鼠模型有利于阐明与病毒感染和肺的急性炎性应答有关的机制。PVM感染的小鼠与RSV感染的婴幼儿的临床症状以及炎症病理反应一致。PVM/小鼠模型已被广泛用于RSV感染人类的机制研究,甲醛灭活的PVM免疫小鼠、PVM攻击被免疫的小鼠模型最近也被用于RSV疫苗增强性肺部免疫病理机制的研究。PVM/模型是一个很好的模型,可通过对肺部病毒感染发展,探索固有免疫分子机制,有利于新型疫苗开发和其他预防策略的研究发展。
[1] Rosenberg HF,Domachowske JB.Pneumonia virus of mice severe respiratory virus infection in a natural host[J].Immunol Lett,2008,118(1):6-12.
[2] Easton AJ,Domachowske JB,Rosenberg HF.Animal pneumovirusesis:molecular genetics and pathogenesis[J].Clin Microbiol Rev,2004,17(2):390-412.
[3] Domachowske JB,Bonville CA,Rosenberg HF.Animal models for studying respiratory syncytial virus infection and its long term effects on lung function[J].Pediatr Infect Dis J,2004,23(11 Suppl):S228-S234.
[4] Easton AJ,Chambers P.Nucleotide sequence of the genes encoding the matrix and small hydrophobic proteins of pneumonia virus of mice[J].Virus Res,1997,48:27-33.
[5] Compans RW,Harter DH,Choppin PW.Studies on pneumonia virus of mice (PVM) in cell cultureII.Structure and morphogenesis of the virus particle[J].J Exp Med,1967,126(2):267-267.
[6] Dibben O,Easton AJ.Mutational analysis of the gene start sequences of pneumonia virus of mice[J].Virus Res,2007,130(1/2):303-309.
[7] Dibben O,Thorpe LC,Easton AJ.Roles of the PVM M2-1,M2-2 and P gene ORF 2 (P-2) proteins in viral replication[J].Virus Res,2008,131(1):47-53.
[8] Krempl CD,Wnekowicz A,Lamirande EW,etal.Identification of a novel virulence factor in recombinant pneumonia virus of mice[J].J Virol,2007,81(17):9490-9501.
[9] Domachowske JB,Bonville CA,Dyer KD,etal.Pulmonary eosinophilia and production of MIP-1alpha are prominent responses to infection with pneumonia virus of mice[J].Cell Immunol,2000,200(2):98-104.
[10] Domachowske JB,Bonville CA,Gao JL,etal.The chemokine macrophage-inflammatory protein-1 alpha and its receptor CCR1 control pulmonary inflammation and antiviral host defense in paramyxovirus infection[J].J Immunol,2000,165(5):2677-2682.
[11] Bonville CA,Bennett NJ,Koehnlein M,etal.Respiratory dysfunction and proinflammatory chemokines in the pneumonia virus of mice(PVM) model of viral bronchiolitis[J].Virology,2006,349:87-95.
[12] Welliver TP,Garofalo RP,Hosakote Y,etal.Severe human lower respiratory tract illness caused by respiratory syncytial virus and influenza virus is characterized by the absence of pulmonary cytotoxic lymphocyte responses[J].J Infect Dis,2007,195(8):1126-1136.
[13] Bonville CA,Bennett NJ,Percopo CM,etal.Diminished inflammatory responses to natural pneumovirus infection among older mice[J].Virology,2007,368(1):182-190.
[14] Bonville CA,Lau VK,DeLeon JM,etal.Functional antagonism of chemokine receptor CCR1 reduces mortality in acute pneumovirus infection in vivo[J].J Virol,2004,78(15):7984-7989.
[15] Kurt-Jones EA,Popova L,Kwinn L,etal.Pattern recognition receptors TLR4 and CD14mediate response to respiratory syncytial virus[J].Nat Immunol,2000,1(5):398-401.
[16] Ehl S,Bischoff R,Ostler T,etal.The role of Toll-like receptor 4 versus interleukin-12 in immunity to respiratory syncytial virus[J].Eur J Immunol,2004,34(4):1146-1153.
[17] Faisca P,Tran Anh DB,Thomas A,etal.Suppression of pattern-recognition receptor TLR4 sensing does not alter lung responses to pneumovirus infection[J].Microbes Infect,2006,8(3):621-627.
[18] van der Sluijs KF,van Elden L,Nijhuis M,etal.Toll-like receptor 4 is not involved in host defense against respiratory tract infection with Sendai virus[J].Immunol Lett,2003,89(2/3):201-206.
[19] Garvey TL,Dyer KD,Ellis JA,etal.Inflammatory responses to pneumovirus infection in IFN-alpha beta R gene-deleted mice[J].J Immunol,2005,175(7):4735-4744.
[20] Claassen EA,van der Kant PA,Rychnavska ZS,etal.Activation and inactivation of antiviral CD8 T cell responses during murine pneumovirus infection[J].J Immunol,2005,175(10):6597-6604.
[21] Chang J,Braciale TJ.Respiratory syncytial virus infection suppresses lung CD8+T-cell effector activity and peripheral CD8+T-cell memory in the respiratory tract[J].Nat Med,2002,8(1):54-60.
[22] Claassen EA,van Bleek GM,Rychnavska ZS,etal.Identification of a CD4+T cell epitope in the pneumonia virus of mice glycoprotein and characterization of its role in protective immunity[J].Virology,2007,368(1):17-25.
[23] Barends M,de Rond LG,Dormans J,etal.Respiratory syncytial virus,pneumonia virus of mice,and influenza A virus differently affect respiratory allergy in mice[J].Clin Exp Allergy,2004,34(3):488-496.

