铅、铬胁迫对大弹涂鱼血细胞遗传损伤的彗星实验检测
梁亚芳, 苗 亮, 李明云, 赵 亮, 李笑萌, 徐玉敏, 陈 炯
(宁波大学 海洋学院, 浙江 宁波 315211)
近年来,随着排入海洋的陆源污染物总量不断增加,重金属污染日趋严重[1-2]。对海洋环境重金属离子进行快速有效地检测已成为环境控制和治理中的重要内容。大弹涂鱼(Boleophthalmuspectinirostris)为暖水性潮间带鱼类,在中国东南沿海分布广泛,其食物链短、存活力强,研究显示大弹涂鱼的多项生理指标对环境污染物敏感[3-5]。
彗星实验(Comet assay)又称单细胞凝胶电泳实验(Single cell gel electrophoresis),是一种通过检测DNA链损伤判别遗传毒性的技术[6-7]。该技术已在检测环境污染物对生物的遗传毒性方面已有较多研究报道[8-10]。
本研究采用单细胞凝胶电泳检测重金属Pb、Cr对大弹涂鱼外周血细胞的遗传损伤情况,探讨以DNA损伤作为污染暴露生物标记的可行性,同时为重金属胁迫的血液毒理学以及评估铅、铬对海洋生态系统的影响提供参考资料。
1 材料与方法
1.1 实验动物与试剂
实验用野生大弹涂鱼捕自浙江省宁波市镇海区澥浦沿海滩涂,体长(10.8±1.2) cm,体重(8.4±2.4) g,在实验室暂养7 d后,选取活泼、无病、表皮无损伤的个体进行试验。
实验用醋酸铅、重铬酸钠及其他试剂均购自生工生物工程(上海)有限公司。
1.2 单细胞凝胶电泳方法
用肝素钠处理过的注射器从大弹涂鱼尾部动脉取血,每次取样10尾,用PBS稀释至106个细胞/mL。
Pb、Cr溶液分别用醋酸铅、重铬酸钠配制,以国家渔业水质标准GB11607-89(铅≦0.005 mg/L,铬≦0.05 mg/L)规定的2种离子最高浓度为标准浓度,每种离子均设置4个浓度梯度:标准浓度组、低浓度组(标准浓度的10倍)、中浓度组(标准浓度的100倍)和高浓度组(标准浓度的1000倍)。另设置空白对照组(2种离子浓度均为0)。每组实验均设置3个重复。外周血细胞于25℃染毒1 h后,2000 r/min离心5 min收集血细胞。
参照Singh等[7]的方法进行单细胞凝聚电泳,略加改进。采用3层铺胶法在32×24 mm的盖玻片上铺胶,低熔点琼脂糖和正常熔点的琼脂糖在铺胶后的最终浓度保持在0.5%。第一层在预热的洗液漂洗过的磨砂载玻片上,滴加100 μL 45℃正常熔点的琼脂糖,盖上盖玻片,4℃冰箱中冷凝10 min。揭去盖玻片加35℃ 0.5%的混有血细胞低熔点琼脂糖85 μL,4℃冰箱中冷凝10 min;最后加90 μL的低熔点琼脂糖。4℃下,在高盐裂解液(NaCl 2.5 mol/L,EDTANa2100 mmol/L,Tris-HCl 10 mmol/L,1%十二烷基肌氨酸钠,临用前加Trition X-100终浓度为1%,二甲亚砜终浓度为10%)中裂解2 h。裂解后用PBS漂洗3次后放入碱性电泳缓冲液中(EDTANa21 mmol/L,NaOH 300 mmol/L)解旋40 min。电泳工作电流为200 mA,电泳时间45 min。电泳结束后用pH值7.5的0.4 mol/L的Tris-HCl缓冲液中和15 min后用20 μg/mL的吖啶橙染色15 min,在荧光显微镜(NIKON ECLIPSE 80I)下观察、拍照,根据CASP软件获取的彗星数据计算每个彗星的彗尾长度(Tail Length,TL)、彗尾DNA相对含量(Tail DNA relative%,TD)、尾动量(Tail Moment,TM)和Olive尾动量(Olive Tail Moment,OTm)。用SPSS 13.0软件分析每种离子不同组间的各项数据并进行One-way ANOVA检测,以P<0.05为具有显著性差异。
2 结果
2.1 国标浓度的铅、铬对大弹涂鱼血细胞遗传损伤的影响
由图1可见,空白对照组、Pb国标浓度胁迫组和Cr国标浓度胁迫组的大弹涂鱼血细胞经单细胞凝胶电泳后均呈较规则的圆形,未出现明显的彗星拖尾。与空白对照组相比,Pb国标浓度胁迫组和Cr国标浓度胁迫组在TL、TD、TM、OTM 4项上均无显著性差异(P>0.05),见表1,表明国标浓度的Pb和Cr均不会引起大弹涂鱼血细胞遗传损伤。

图1 国标浓度的Pb、Cr胁迫后大弹涂鱼血细胞彗星图谱
a—空白对照组; b—Pb胁迫组(0.005 mg/L); c—Cr胁迫组(0.05 mg/L)。

表1 国标浓度的Pb、Cr胁迫后大弹涂鱼血细胞DNA彗星实验结果
注:表中数据是依据图片像素和光密度表示DNA损失程度的彗星测量数据,计算方法详见CASP软件说明;同一列各行中字母相同表示差异不显著(P>0.05);字母不同表示差异显著(P<0.05)。下同。
2.2 Pb胁迫对大弹涂鱼血细胞的遗传损伤
单细胞凝胶电泳结果显示,经国标10倍、100倍和1000倍浓度的Pb胁迫后,大弹涂鱼血细胞均出现了明显的彗星拖尾,且随着Pb浓度升高,彗尾长度增加、荧光强度增大(图2)表明细胞DNA受损。CASP软件测量结果显示(表2),彗星的拖尾长度、尾部DNA百分比和尾动量3个指标均随着Pb浓度的升高而显著增大(P<0.05);低浓度组和中浓度组的Olive尾动量均分别显著大于国标组和低浓度组(P<0.05),而高浓度组的Olive尾动量虽高于中浓度组但差异不显著(P>0.05)。可见高于国标浓度的Pb对大弹涂鱼血细胞有明显的遗传损伤,且损伤程度与Pb浓度之间存在“剂量-效应”关系。

图2 不同浓度的Pb胁迫后大弹涂鱼血细胞彗星图像
a—低浓度组(0.05 mg/L); b—中浓度组(0.5 mg/L); c—高浓度组(5 mg/L)。
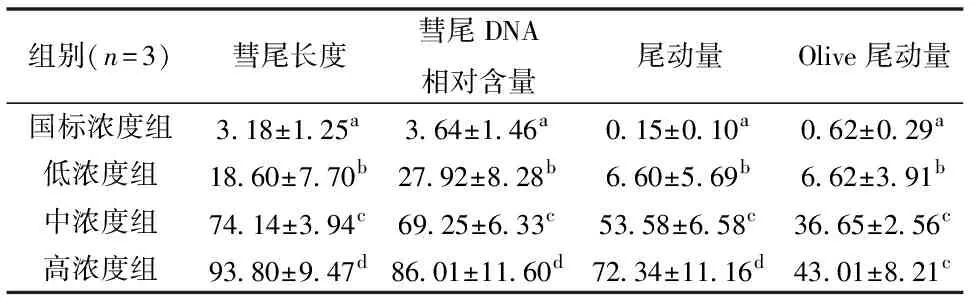
表2 不同浓度的Pb胁迫后大弹涂鱼血细胞DNA彗星实验结果
2.3 Cr胁迫对大弹涂鱼血细胞的遗传损伤
彗星实验结果显示,大弹涂鱼血细胞在受到国标10倍、100倍和1000倍浓度的Cr胁迫后均出现了明显的彗星拖尾,且彗尾的长度和荧光强度均随Cr浓度升高而增加(图3),表明细胞DNA受损。经CASP软件测量(表3),各个浓度组的彗星拖尾长度、尾部DNA百分比、尾动量和Olive尾动量等4个指标均随着Cr浓度的升高而显著增大(P<0.05);低浓度组和中浓度组的Olive尾动量均分别显著大于国标组和低浓度组(P<0.05),表明高于国标浓度的Cr对大弹涂鱼血细胞有明显的遗传损伤,且损伤程度与Cr浓度之间存在“剂量-效应”关系。

图3 不同浓度的Cr胁迫后大弹涂鱼血细胞彗星图像
a—低浓度组(0.5 mg/L); b—中浓度组(5 mg/L); c—高浓度组(50 mg/L)。
3 讨论
重金属是非降解的元素型环境污染物,可引发生态系统破坏,进入水体后会对生物产生显著的毒性作用,并且重金属可在生物体内富集,对生物具有致畸、致癌、致死的作用[11]。国内外学者已在重金属元素引起的海洋污染以及对海洋生物的毒理效应和致毒机制等方面进行了大量的研究[12-16]。
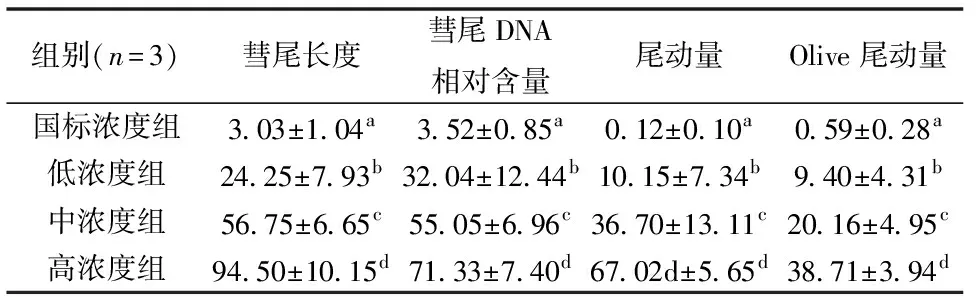
表3 不同浓度的Cr胁迫后大弹涂鱼血细胞DNA彗星实验结果
Pb和Cr都是常见的环境重金属污染物,其中Pb是人体非必需元素,为抑制积累性毒物,可通过食物链传递[17-18]。Pb会损害生物的造血功能,诱发神经系统功能紊乱[19-20],并会干扰DNA代谢(如DNA断裂、甲基化异常等),造成遗传损伤[20-25]。Cr是一种人类必需元素,在肌体的糖代谢和脂代谢中发挥特殊作用[26],但高浓度的Cr也会对细胞和生物体产生毒害作用[27-29]。
目前关于Pb和Cr对鱼类的影响已有较多研究报导,如温茹淑等[29]的研究显示Pb对草鱼鱼苗的24、48、72和96 h半致死浓度分别为0.431、0.338、0.375和0.362 mg/L;雷忻等[30]的研究显示Cr对金鱼的24、48、72和96 h半致死浓度分别为387.1、370.9、281.9和200.2 mg/L,并可造成鳃组织的严重损伤。本研究通过彗星实验检测了Pb和Cr对大弹涂鱼外周血细胞的遗传损伤,结果显示重金属浓度和DNA损伤程度间存在着明显的“剂量-效应”关系,金春华等[5]的研究也显示大弹涂鱼血细胞DNA损伤程度与镉离子浓度间存在“剂量-效应”关系,因此大弹涂鱼外周血细胞的DNA损伤可以作为一种污染暴露的生物标记。
唐建勋等[10]的研究显示Pb可引起泥鳅卵细胞凋亡和DNA损伤,且存在“剂量-效应”关系,但无“时间-效应”关系;金春华等[5]的研究显示镉对大弹涂鱼血细胞的DNA损伤既有“剂量-效应”关系又有“时间-效应”关系。本研究结果显示Pb和Cr浓度与大弹涂鱼血细胞DNA损伤程度间均存在明显的“剂量-效应”关系,而是否存在“时间-效应”关系尚需进一步研究。另外,研究显示不同的重金属离子间存在协同作用或拮抗作用[31],Pb和Cr之间是否有协同作用或拮抗作用有待于进一步研究。
本研究通过彗星实验显示重金属铅和铬都会引起大弹涂鱼血细胞DNA的损伤,但尚不清楚这两种重金属引起遗传损伤的机制以及机体是否能通过激活自身的DNA修复系统进行损伤修复。在今后的研究中,将一方面通过H2AX焦点和磷酸化水平[32-33]检测铅、铬胁迫后大弹涂鱼细胞DNA损伤、修复情况,另一方面通过蛋白质组、转录组研究探讨其遗传损伤机制[34],以丰富重金属铅、铬的环境毒理学研究资料。
参考文献:
[1]马 玉, 李团结, 王 迪, 等. 珠江口滨海湿地沉积物重金属污染现状及潜在生态危害[J]. 热带地理, 2011, 31(4): 353-356.
[2]胡朝晖, 张 干, 丘耀文, 等. 中国渔港沉积物的重金属污染及潜在生态风险评价[J]. 地球化学, 2010, 39(4): 297-304.
[3]冯 涛, 郑微云, 洪万树, 等. 苯并(a)芘对大弹涂鱼肝脏抗氧化酶活性影响的初步研究 [J]. 应用生态学报, 2001, 12(3): 36-40.
[4]刘伟成, 李明云, 黄福勇, 等. 镉胁迫对大弹涂鱼肝脏黄嘌蛉氧化酶和抗氧化酶活性的影响[J]. 应用生态学报, 2006, 17(7): 1310-1314.
[5]金春华, 李明云, 刘伟成, 等. 镉胁迫对大弹涂鱼(Boleophthalmuspectinirostris)血细胞遗传损失的研究[J]. 海洋与湖沼, 2010, 41(1): 80-84.
[6]Singh N P, Mccoy M T, Tice R R, et al. A simple technique for quantitation of low levels of DNA damage in individual cells[J]. Exp Cell Res, 1988, 175(1): 184-191.
[7]Singh N P. Technical report: modification of alkaline microgel eletrophoresis for sensitive detective of DNA damage[J]. Int Radiat Bio, 1994, 66: 23-28.
[8]金帮明, 王辅明, 熊 力, 等. 五氯酚对HeLa细胞毒性及DNA损伤的研究[J]. 环境科学, 2012, 33(2): 658-664.
[9]洛 昊, 梁 斌, 马明辉, 等. 彗星实验检测渤海主要入海河流遗传毒性[J]. 中国环境科学, 2013, 33(1): 161-165.
[10]唐建勋, 程樟顺, 郑荣泉, 等. 重金属Cu、Pb对泥鳅(Misgurnusanguillicaudatus)卵细胞凋亡及DNA损伤的SCGE试验[J]. 海洋与湖沼, 2013, 44(1): 177-181.
[12]Verlecar X N, Jena K B, Chainy G B N. Biochemical markers of oxidative stress inPernaviridisexposed to mercury and temperature[J]. Chem Biol Interact, 2007, 167: 219-226.
[13]田 金, 李 超, 宛 立, 等. 海洋重金属污染的研究进展[J]. 水产科学, 2009, 28: 413-418.
[14]Chen C Y, Dionne M, Mayes B M, et al. Mercury bioavailability and bioaccumulation in estuarine food webs in the Gulf of Maine[J]. Environ Sci Technol, 2009, 43: 1804-1810.
[15]Ferrer L, Andrade S, Asteasuain R, et al. Acute toxicities of four metals on the early life stages of the crabChasmagnathusgranulatafrom Bahia Blanca estuary, Argentina[J]. Ecotoxicology and Environmental Safety, 2006, 65(2): 209-217.
[16]Gopalakrishnan S, Thilagam H, Raja P V. Comparison of heavy metal toxicity in life stage (spermiotoxicity, egg toxicity, embryotoxicity and larval toxicity) ofHydroideselegams[J]. Chemosphere, 2008, 71: 515-528.
[17]Grove P, Banu B S, Devi K D, et al. In vivo genotoxic of mercuric chloride in rat peripheral blood leucocytes using comet assay[J]. Toxicology, 2001, 167(3): 191-197.
[18]赵元凤, 吕景才, 吴益春, 等. 牙鲆对海水中铅积累排放规律研究[J]. 海洋学报, 2004, 26(3): 109-114.
[19]胡秀芝, 周春景, 吴 亚, 等. 铅铜离子对鲫鱼的急性毒性研究[J]. 内江师范学院学报, 2009, 24: 45-48.
[20]辛鹏举, 金银龙. 铅的毒性效应及作用机制研究进展[J]. 国外医学, 2008, 35(2): 70-74.
[21]Andrea H. Carcinogonicity of metal compounds:possible role of DNA repair inhibition[J]. Toxicol Lett, 1998, 103: 235-239.
[22]Dearfield K L, Cimino M C, McCarroll N E, et al. Gene toxicity risk assessment: a proposed classification strategy[J]. Mut Res, 2002, 512: 121-135.
[23]王丙莲, 张迎梅, 谭玉凤, 等. 镉铅对泥鳅DNA甲基化水平的影响[J]. 毒理学杂志, 2002(2): 16-18.
[24]叶细标, 付 华, 朱靳良, 等. 职业接铅工人外周血细胞DNA损伤俭测的彗星试验[J]. 中华劳动卫生职业病杂志, 2002, 18(1): 51-52.
[25]盂 玲, 王焕校, 谭德勇. 六种重金属对大肠杆菌体内质粒DNA一级结构的影响[J]. 中国环境科学, 1999, 19(2): 169-171.
[26]高步先, 夏耕田, 张乃生. 铬的生物学功能及其在动物体内的代谢[J]. 动物医学进展, 2002, 23(6): 49-51.
[27]王晓峰, 楼建林, 邢鸣銮, 等. 六价铬致小鼠DNA损伤及肝肾氧化应激的实验研究[J]. 环境科学学报, 2006, 26(11): 1860-1864.
[28]陈细香, 谢嘉华, 卢昌义, 等. 汞和铬对黄鳝的急性毒性研究[J]. 水利渔业, 2008, 28(2): 103-104.
[29]温茹淑, 郑清梅, 方展强, 等. 汞、铅对草鱼的急性毒性及安全浓度评价[J]. 安徽农业科学, 2007, 35(16): 4863-4864,4914.
[30]雷 忻, 杜 团, 廉振民, 等. 重金属铬对金鱼的毒性效应及鳃的组织学影响[J]. 水生态学杂志, 2009, 2(5): 71-74.
[31]付荣恕, 杜作滨. 铅、镉污染对水丝蚓的急性毒性效应[J]. 山东师范大学学报:自然科学版, 2008, 23(4): 93-95.
[32]刁汇玲, 高金祥, 赵冬梅, 等. 应用γH2AX检测甲醛致DNA损伤的研究[J]. 工业卫生与职业病, 2009, 35(5):129-132.
[33]张俊英, 张士猛, 周平坤. H2AX磷酸化与去磷酸化的分子机制及其对DNA损伤修复反应的调节作用[J]. 军事医学, 2013, 37(3): 227-230.
[34]Lu X J, Chen J, Huang Z A, et al. Influence of acute cadmium exposure on the liver proteome of a teleost fish, ayu (Plecoglossusaltivelis)[J]. Molecular Biology Reports, 2012, 39(3): 2851-2859.

