甘薯多糖提取条件及抗氧化性的研究
全桂静,宋文婷
(沈阳化工大学 制药与生物工程学院, 辽宁 沈阳 110142)
多糖是一类由单糖组成的天然高分子化合物,广泛存在于植物、动物和微生物细胞内.植物多糖种类较多,具有特殊的生物活性,如协助消化、抗疲劳、抗病毒、抗菌消炎、抗衰老、抗辐射、抗肿瘤、降血糖、降血脂及免疫调节等[1-3].多糖在食品工业中具有广泛应用,常被用作增稠剂、稳定剂、成膜剂、持水剂等[4].植物多糖的提取方法主要有溶剂浸提法、酶法、超声辅助提取法、微波辅助提取法、超临界流体萃取法等[5].
甘薯营养丰富,成分均衡,价格低廉,具有很高的药用价值,甘薯多糖具有抗氧化作用[6-7].目前已经展开对甘薯多糖的研究,主要集中在提取工艺方面.本实验主要对甘薯多糖提取工艺进行优化,但以粗多糖得率和多糖含量两项作为优化指标,可以全面衡量提取工艺的优劣.同时对获得的多糖物质进行抗氧化剂研究.
1 材料与方法
1.1 实验材料
甘薯:市售鲜甘薯.
1.2 实验方法
1.2.1 甘薯多糖的提取工艺
甘薯→去皮、切片→烘干→粉碎→无水乙醇回流脱脂→热水浸提→离心过滤→减压浓缩→乙醇沉淀→离心→水溶→脱蛋白→脱色→乙醇沉淀→抽滤→真空干燥→粗多糖[6,8]
1.2.2 操作要点
甘薯去皮,切成薄片,55 ℃烘干,粉碎成甘薯粉.取2.0 g甘薯粉,加入12 mL无水乙醇,77 ℃回流脱脂,回流2次,每次30 min.加入15倍体积的蒸馏水,调pH=7.0,70 ℃搅拌提取2 h,7 800 r/min离心30 min,减压浓缩至原体积的1/3~1/2.加入3倍体积分数85 %的乙醇,使溶液形成均匀的絮状沉淀,室温静置后离心,10 000 r/min离心30 min,收集沉淀.加入20倍体积的蒸馏水,搅拌溶解沉淀,并缓慢加入等体积的质量浓度30 g/L的三氯乙酸溶液,放入4 ℃冰箱,静置过夜,使蛋白完全沉淀,10 000 r/min离心30 min,留上清液.加入总体积2 %的硅藻土脱色30 min,并用真空泵装置进行抽滤,取滤液.加入3倍体积分数85 %的乙醇,使样液形成均匀的絮状沉淀,用真空泵抽滤装置抽滤,真空干燥,最终得粗多糖膏体[10-11].
1.2.3 单因素实验
以甘薯粉为原料,分别以浸提温度(50、60、70、80、90 ℃)、料液比(1∶10、1∶20、1∶30、1∶40、1∶50)、浸提时间(1、2、3、4 h)和提取液pH值(5.0、6.0、7.0、8.0)作为因素,分析不同提取条件对甘薯多糖提取效果的影响,检测指标为粗多糖得率.

1.2.4 正交试验
以粗多糖得率为考察指标,根据单因素实验结果设计正交试验,以优化甘薯多糖的提取条件.
1.2.5 多糖含量的测定——苯酚硫酸法
(1) 葡萄糖标准曲线的制作
精密称取50.0 mg无水葡萄糖,溶解定容至50 mL,得1 g/L葡萄糖储备液.精确吸取储备液0.0、0.1、0.2、0.4、0.6、0.8、1.0 mL移入试管中加水稀释至1.0 mL,加入质量浓度50 g/L的苯酚溶液1 mL混匀,再迅速滴加5 mL浓硫酸,振荡混匀,放置30 min.再将上述各溶液稀释10倍,测A490,得回归方程为:y=0.639 5x+0.017,R2=0.999 3.
(2) 待测样品中多糖含量的测定
称取50.0 mg多糖样品,溶解定容至50 mL.准确量取1.0 mL,按照(1)中方法测定样品.按公式
多糖含量/%=
计算多糖含量.
1.2.6 多糖的抗氧化性研究
(1) 对羟自由基(·OH)清除作用的测定——邻二氮菲-Fe2+氧化法[9]
取10 mL具塞试管,按顺序加入5 mmol/L 邻二氮菲1.5 mL,0.5 mol/L、pH=7.4的磷酸缓冲液3 mL,1 mL、7.5 mmol/L的FeSO4,不同浓度多糖溶液3 mL,1 mL体积分数0.1 %的H2O2,用重蒸水稀释到10 mL,37 ℃保温60 min,测A510.空白管(A510(空白)) 不加H2O2及抗氧化药物,对照管(A510(对照)) 只加H2O2不加抗氧化药物.
羟自由基清除率/%=
取10 mL具塞试管,加入0.05 mol/L、pH=8.2的Tris-HCl缓冲溶液6 mL,25 ℃水浴中预热20 min,加入不同浓度甘薯多糖溶液1 mL,立即加入在25 ℃水浴中预热的邻苯三酚1 mL,于30 s内定容至刻度,最后在25 ℃的水浴中准确反应4 min,立即用8 mol/L盐酸2滴终止反应,测A320.
超氧自由基清除率/%=
2 结果与分析
2.1 甘薯多糖提取
2.1.1 浸提温度对甘薯多糖提取的影响
实验考察了浸提温度对甘薯多糖提取的影响,结果如图1所示.由图1可知:浸提温度对甘薯多糖提取有影响,最佳浸提温度为70 ℃,粗多糖得率为29.53 %,粗提物中多糖质量分数达到55.29 %.结果显示,浸提温度升高后提取物的多糖含量大幅下降,说明高温对多糖的影响较大.

图1 浸提温度对多糖提取的影响
2.1.2 浸提料液比对甘薯多糖提取的影响
实验考察了料液比对甘薯多糖提取的影响,结果见图2.由图2可知:甘薯多糖提取时的最佳料液比为1∶20,粗多糖得率为29.56 %,粗提物多糖质量分数为54.97 %.结果显示料液比对粗提物中多糖含量影响较小.
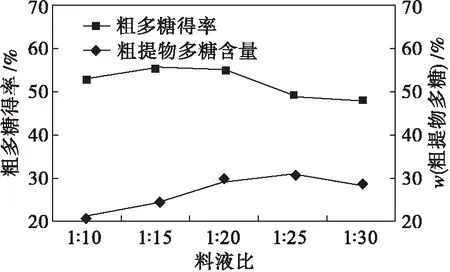
图2 料液比对甘薯多糖提取的影响
2.1.3 时间对甘薯多糖提取的影响
实验考察了提取时间对甘薯多糖得率和多糖含量的影响,结果见图3.由图3可知:浸提3 h时粗多糖得率最高,但粗提物多糖的含量却比浸提2 h时少,从节能角度分析,确定浸提时间为2 h.

图3 浸提时间对甘薯多糖提取的影响
2.1.4 pH值对甘薯多糖提取的影响
实验考察了提取液pH值对甘薯多糖得率和多糖含量的影响,结果见图4.由图4可知:在不同pH值条件下,粗多糖的得率和甘薯多糖的含量存在差异.中性条件下粗多糖的得率和多糖的含量最高,多糖质量分数为53.97 %.结果表明多糖的稳定性受到环境pH值的影响.

`
图4 pH值对甘薯多糖提取的影响
Fig.4 Effect of pH value on the extraction of polysaccharides
2.1.5 提取条件优化
采用L9( 34)正交试验(见表1)优化甘薯多糖提取条件,结果见表2.由表2可知:4个因素对甘薯多糖提取率的影响大小顺序为提取温度>浸提液pH>浸提时间>料液比.综合分析正交试验结果,确定甘薯多糖最佳提取工艺条件为A2B2C2D2,即浸提温度65 ℃、料液比1∶20,浸提时间2.5 h,浸提液pH=6.5.
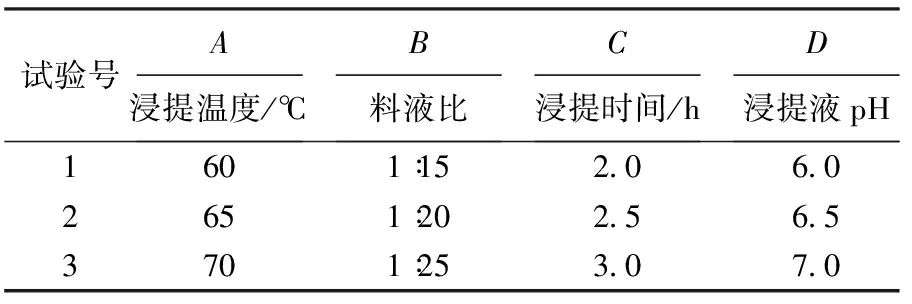
表1 正交试验因素与水平设计

表2 L9(34)正交试验结果
以最优组合进行5次重复性实验,粗多糖得率分别为31.26 %、31.69 %、30.98 %、31.97 %、30.82 %,平均得率为31.34 %,说明此为甘薯多糖的最佳提取条件.该条件下提取的粗多糖中多糖平均质量分数为56.32 %.
2.2 甘薯多糖的抗氧化性
2.2.1 对羟自由基(·OH)的清除作用
实验中研究了甘薯多糖对羟自由基的清除作用,结果见图5.由图5可知:甘薯多糖对羟自由基具有清除作用,且在一定质量浓度范围内清除效果随着多糖质量浓度的增加而增加,当质量浓度为300 mg/L时,羟自由基清除率为62.3 %.说明提取的甘薯多糖具有清除羟自由基的能力,但比Vc的清除能力小.
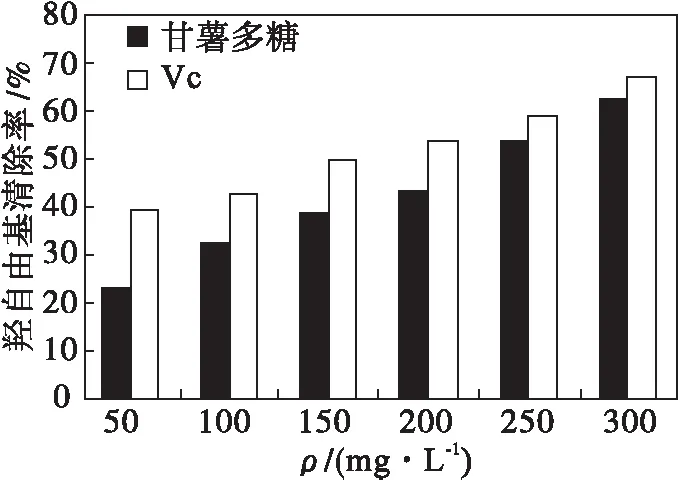
图5 甘薯多糖及Vc对羟自由基的清除作用
实验中研究了甘薯多糖对超氧自由基的清除作用,结果见图6.

图6 甘薯多糖对超氧自由基的清除作用
由图6可知:甘薯多糖具有很强的去除超氧自由基的能力,去除效果随着多糖质量浓度增加而不断加强,且质量浓度超过250 mg/L时对超氧自由基的清除效果明显增强.多糖质量浓度为300 mg/L时,对超氧自由基的清除率为59.2 %,低于对羟自由基的清除率.
3 结 论
采用热水浸提的方法从甘薯中提取多糖,通过单因素试验和正交试验对提取工艺进行优化,确定最佳提取条件为:浸提温度65 ℃,料液比1∶20,浸提时间2.5 h,浸提液pH=6.5,在此工艺条件下甘薯多糖得率为31.34 %.提取温度对多糖提取的得率影响最大,其次分别为:浸提液pH值、料液比、浸提时间.
通过测试对羟自由基和超氧自由基的清除作用来检测甘薯多糖的抗氧化能力,结果表明其具有很强的抗氧化作用,且抗氧化能力随着质量浓度的增加而增强.在50~300 mg/L的质量浓度范围内,甘薯多糖对羟自由基的清除作用优于对超氧自由基的清除作用.
参考文献:
[1] 何余堂,潘孝明.植物多糖的结构与活性研究进展[J].食品科学,2010,31(17):493-496.
[2] 陈旋,张翼,张剑波.植物多糖的研究进展[J].中国新药杂志,2007,16(13):1000-1005.
[3] 施松善,王顺春.多糖生物活性研究进展[J].生命科学,2011,23(7):662-669.
[4] 贾亮亮,袁丁,何毓敏,等.多糖提取分离及含量测定的研究进展[J].食品研究与开发,2011,32(3):189-192.
[5] 尹艳,高文宏,于淑娟.多糖提取技术的研究进展[J].食品工业科技,2007,28(2):248-250.
[6] 林娟,邱宏端,林霄,等.甘薯多糖的提取纯化及成分分析[J].中国粮油学报,2003,18(2):64-66.
[7] 李利华.甘薯多糖超声辅助提取及其抗氧化活性的研究[J].食品工业科技,2012,33(18):257-260.
[8] Yin Y Q,Li Y,Kong L Y.Pentasaccharide Glycosides from the Tubers of Sweet Potato(IpomoeaBatatas)[J].Journal of Agricultural and Food Chemistry,2008,56(7):2363-2368.
[9] 张静丽,王宏勋,张雯,等.灵芝、枸杞多糖复合抗氧化作用[J].食品与机械,2004,20(6):11-12.
[10] 付宏媛,张坤生,任云霞.酶解法提取甘薯多糖技术研究[J].中国食品学报,2008,2(8):128-132.
[11] 高秋萍,阮红.紫心甘薯多糖提取工艺研究[J].食品科学,2009,30(20):113-117.

