白腐真菌产锰过氧化物酶的研究
余 梅,阮小文,谭丽泉,卢玉娟
(1.广东石油化工学院化学工程学院,广东 茂名 525000;2.茂名市环境科学研究所,广东 茂名 525000)
白腐真菌(white rot fungi)是一种能够引起木材白色腐朽病的担子菌,它可以在木质细胞腔内产生胞外氧化酶,该酶具有很强的降解木质素大分子的能力,其降解过程包括木质素碳水化合物结合体的分解、苯基丙烷的分解、侧链分解以及芳香环结构的开裂[1]。白腐真菌主要通过分泌非专一性的降解酶系以单电子氧化、共代谢及脂肪过氧化等途径进行降解活动。白腐真菌的降解酶系统主要包括3种酶:木质素过氧化物酶(lignin peroxidase,LiP)、锰过氧化物酶(manganese-dependent peroxidase,MnP)、漆酶(laccase,Lac),这3种酶都具有多种各自的同工酶,白腐真菌的降解能力与这些酶的产生密切相关。而Pasti等[2]研究表明MnP单独作用同样可以降解多种不同类型的污染物。
MnP与LiP一样,都是代表一系列具有糖基的胞外过氧化物酶,因二者都含有血红素,又称血红素过氧化物酶。相对于其它过氧化物酶,MnP的特别之处在于它的底物是有机酸。MnP可以氧化Mn2+为Mn3+,而Mn3+可以螯合有机酸,这种螯合物可通过扩散离开酶活性中心,在过氧化氢存在时能氧化酚型木质素及木质素模型物,即由 Mn2+及一种螯合物催化木质素发生降解。MnP对木质素的降解有赖于大量稳定的Mn3+的存在,与其它酶一起能把木质素彻底降解为二氧化碳[3-4]。
近年来,直接应用MnP解决环境污染问题逐渐受到人们的关注,而提高MnP的合成水平及其酶活性表达是强化白腐真菌对难降解有机物降解作用的关键所在。
由于黄孢原毛平革菌(Phanerochaetechrysosporium,以下简称P.c.菌)具有十分强烈的降解木质素的能力,因此以其作为研究对象,通过研究P.c.菌摇瓶培养体系在藜芦醇、苯甲醇、吐温80以及不同的金属阳离子等活性因子的影响下的生长及MnP酶活的变化规律,以确定该菌合成MnP的最优条件,为研究P.c.菌产MnP提供一定的科学依据。
1 实验
1.1 菌种、试剂与仪器
P.c.菌(5.776),广州微生物菌种保藏中心。
藜芦醇、吐温80、苯甲醇、MgSO4·7H2O、CuSO4、CaCl2等均为分析纯,天津大茂化学试剂厂。
YXQ-LS-30S11型立式压力蒸汽灭菌器、THZ-92B型气浴恒温振荡器,上海博迅实业有限公司医疗设备厂;LRH-150B型培养箱,广东医疗器械厂;800型离心机,上海精密科学仪器有限公司;TU-1810型紫外可见分光光度计,北京普析通用仪器有限责任公司。
1.2 培养基
马铃薯固体培养基(用于继代培养):马铃薯200 g·L-1、葡萄糖20 g·L-1、KH2PO43 g·L-1、MgSO4·7H2O 1.5 g·L-1、硫胺素8 mg·L-1、琼脂18 g·L-1。
马铃薯液体培养基(用于制备孢子悬浮液):除不加琼脂外,成分同马铃薯固体培养基。
液体限氮培养基[5](用于产酶反应体系):每升液体培养基中含0.2 g KH2PO4、0.05 g MgSO4·7H2O、0.01 g CaCl2、10 g葡萄糖、1 mg VB1、1 mL无机溶液、1.2 mmol酒石酸铵,其中无机溶液组分及含量见表1。

表1 液体限氮培养基中无机溶液的组分及含量/(mg·L-1)
1.3 化学试剂及金属离子对P.c.菌生长及MnP酶活的影响[6-7]
将斜面上的菌种接种到马铃薯固体培养基平板上于30 ℃下培养7~8 d。用马铃薯液体培养基配制孢子悬浮液。
取30 mL液体限氮培养基加入250 mL三角瓶中,121 ℃灭菌30 min后接入3 mL孢子悬浮液,分别加入不同浓度的藜芦醇、苯甲醇、吐温80及Ca2+、Fe2+、Cu2+等活性因子,于30 ℃、160 r·min-1的条件下恒温振荡培养7 d,反应液于3 000 r·min-1下离心10 min,取上清液即为粗酶液。 测定体系中P.c.菌的生物量及MnP 酶活。以不加活性因子的产酶体系为对照。
1.4 分析测试
1.4.1生物量的测定
采用细胞干重法[8]。
1.4.2MnP酶活的测定
取去离子水1 mL、1 mmol·L-1的MnSO4溶液0.4 mL、酒石酸/酒石酸钠缓冲溶液(pH值5.0) 1.2 mL、粗酶液1 mL,最后加入1 mmol·L-1的过氧化氢溶液(现配)0.4 mL启动反应,用紫外可见分光光度计检测混合液在238 nm处3 min内吸光度值的变化。
MnP酶活定义为:1 min内氧化1 μmol Mn2+所需的酶量为一个酶活单位(1 U)[9]。
2 结果与讨论
2.1 藜芦醇浓度对P.c.菌生长及产MnP酶活的影响
改变产酶体系的藜芦醇浓度分别为0 mg·L-1、5 mg·L-1、10 mg·L-1、50 mg·L-1、100 mg·L-1、150 mg·L-1、200 mg·L-1、250 mg·L-1,测定产酶培养后的菌生物量及MnP酶活,结果见图1。

图1 藜芦醇浓度对P.c.菌生长及产MnP酶活的影响
由图1可知,在藜芦醇浓度为0~200 mg·L-1时,可以促进P.c.菌生长,随着藜芦醇浓度的增大,菌生物量增加;在浓度为150 mg·L-1时,菌生物量达到最大,为0.0751 g;之后随着藜芦醇浓度增大菌生物量降低,在浓度达到250 mg·L-1时低于对照组。而较低浓度的藜芦醇(<10 mg·L-1)对MnP酶活没有促进作用;之后随着藜芦醇浓度的增大,MnP酶活增大,在浓度为150 mg·L-1时达到最大,为406.12 U·L-1,约为对照组的2倍;浓度继续增大到250 mg·L-1时,MnP酶活比对照组小,表明此时对产酶起抑制作用。由菌生物量及MnP酶活可知,藜芦醇浓度小于200 mg·L-1时对P.c.菌的生长及产锰过氧化物酶效果较好。藜芦醇学名 “3,4-二甲氧基苯甲醇”,在该产酶体系中是P.c.菌在次生代谢阶段自身合成并分泌到胞外的活性因子,主要作用是作为还原底物诱导MnP的合成。所以在反应体系中添加一定量的藜芦醇,对提高MnP酶活是有利的[10-11]。
2.2 苯甲醇浓度对P.c.菌生长及产MnP酶活的影响
改变产酶体系的苯甲醇浓度分别为0 mg·L-1、5 mg·L-1、10 mg·L-1、50 mg·L-1、100 mg·L-1、150 mg·L-1、200 mg·L-1、250 mg·L-1,测定产酶培养后的生物量及MnP酶活,结果见图2。
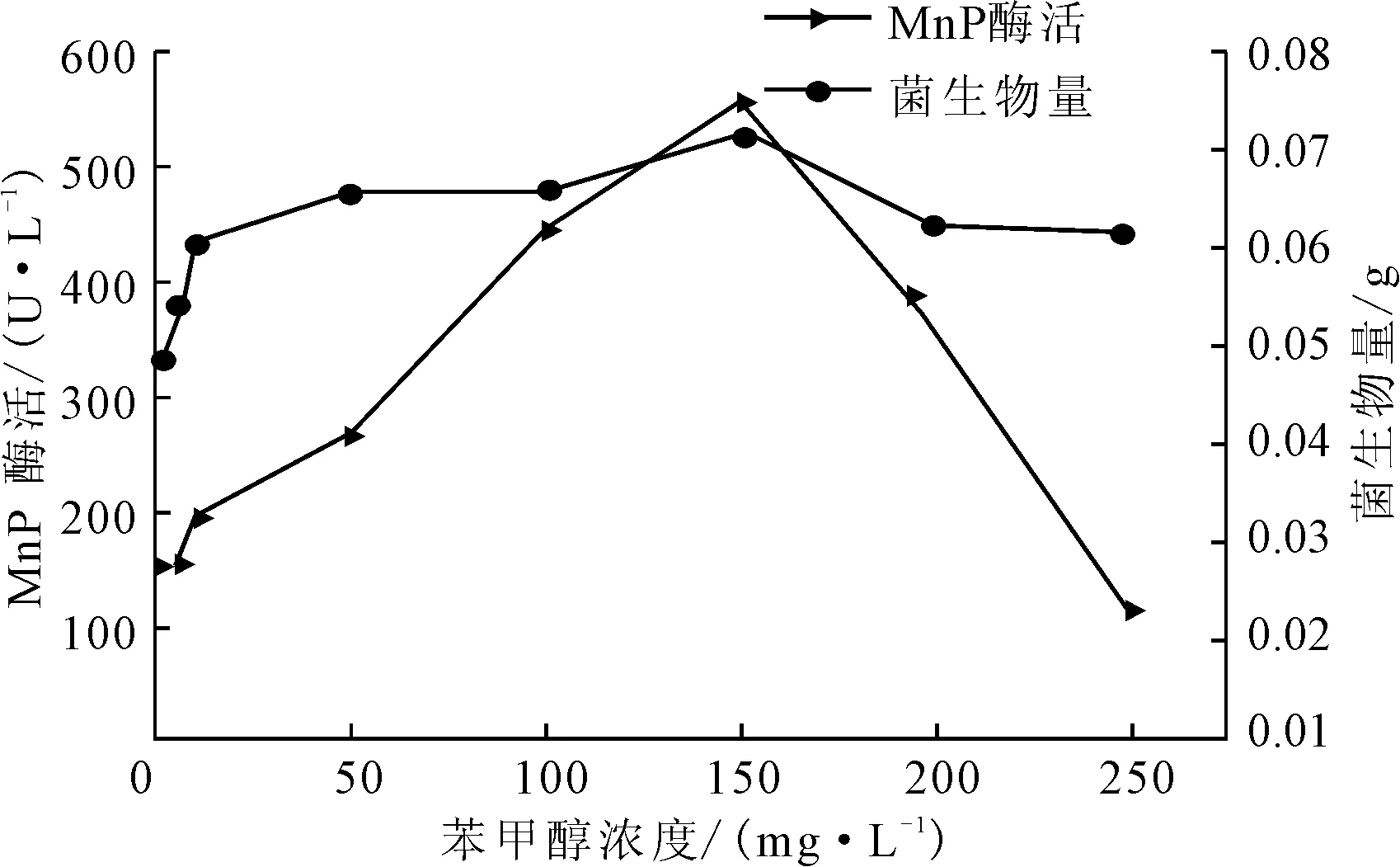
图2 苯甲醇浓度对P.c.菌生长及产MnP酶活的影响
由图2可知,随着苯甲醇浓度的增大,菌生物量及MnP酶活均增大,在苯甲醇浓度为150 mg·L-1时,菌生物量及MnP酶活均达到最大;之后随着苯甲醇浓度的增大,菌生物量及MnP酶活呈下降趋势,说明高浓度的苯甲醇会抑制MnP酶的产生;当苯甲醇浓度达到250 mg·L-1时,MnP酶活低于对照组。苯甲醇具有与藜芦醇相似的结构,可以在一定程度上替代藜芦醇作为诱导剂,促进P.c.菌产酶。
2.3 吐温80浓度对P.c.菌生长及产MnP酶活的影响
改变产酶体系的吐温80浓度分别为0 mg·L-1、1.4 mg·L-1、2.8 mg·L-1、7 mg·L-1、14 mg·L-1、28 mg·L-1、42 mg·L-1,测定产酶培养后的菌生物量及MnP酶活,结果见图3。
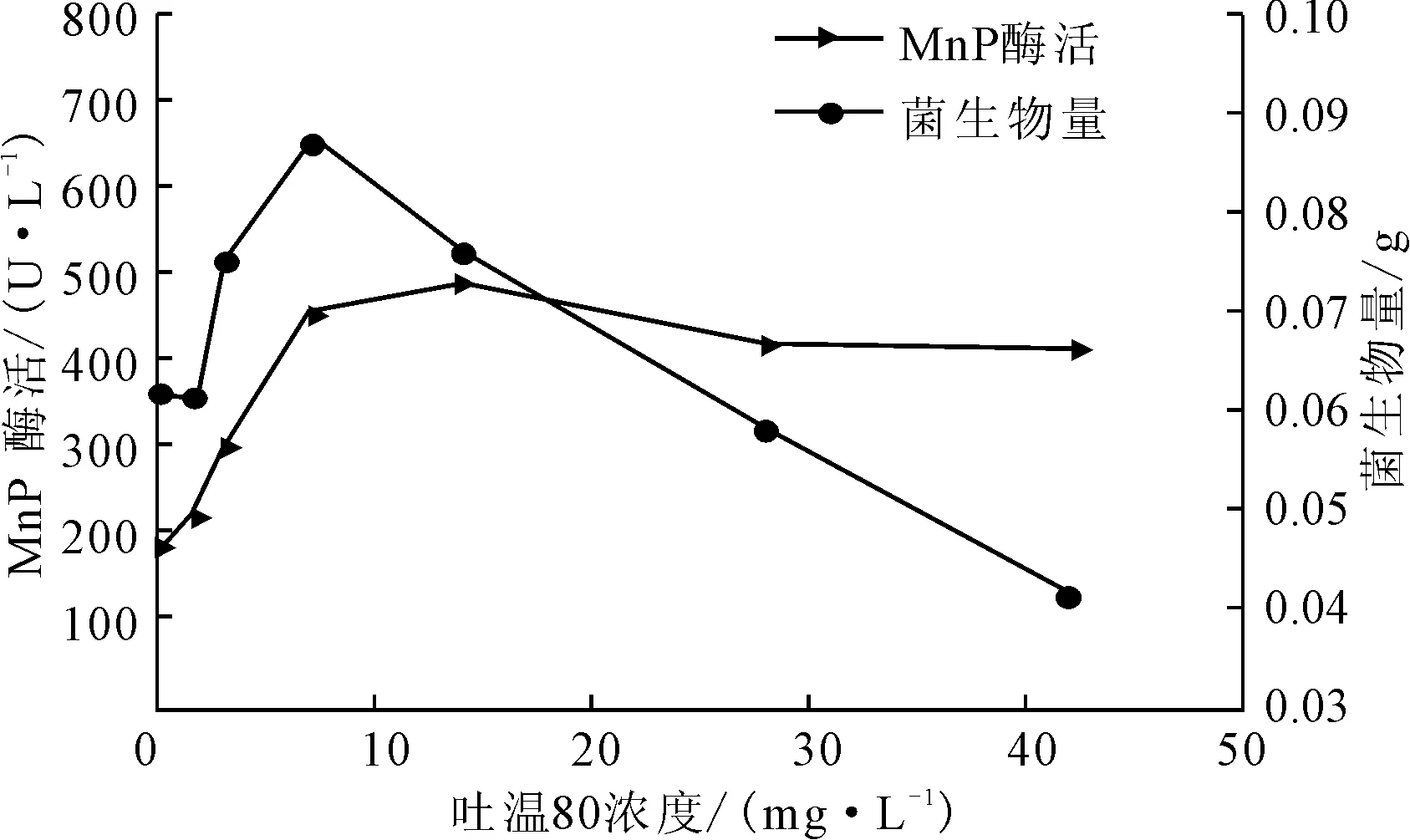
图3 吐温80浓度对P.c.菌生长及产MnP酶活的影响
由图3可知,在低浓度条件下,随着吐温80浓度的增大,菌生物量及MnP酶活均显著增大;在吐温80浓度为7 mg·L-1时菌生物量达到最大,为0.0872 g,之后随着吐温80浓度的增大而显著减小,在28 mg·L-1时低于对照组;而MnP酶活则在吐温80浓度为14 mg·L-1时达到最大,为490.72 U·L-1,之后随着吐温80浓度的增大,酶活略有下降,总体变化不明显。吐温80是非离子型的表面活性剂,浓度较低时,可提高微生物细胞膜的渗透性[12],促使细胞内的酶透过细胞膜分泌出来,有利于酶的合成。吐温80对MnP酶活的影响主要体现在基团对酶的吸附上,当吐温80浓度大于临界胶束浓度(14 mg·L-1)后,形成的胶束对酶具有吸附作用,可能对MnP酶活产生了抑制[13]。
2.4 Ca2+浓度对P.c.菌生长及产MnP酶活的影响
改变产酶体系的Ca2+浓度分别为0 mg·L-1、5 mg·L-1、10 mg·L-1、15 mg·L-1、20 mg·L-1、25 mg·L-1、30 mg·L-1、35 mg·L-1,测定产酶培养后的菌生物量及MnP酶活,结果见图4。
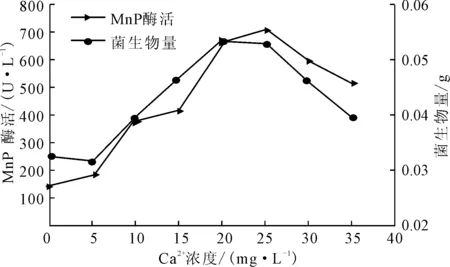
图4 Ca2+浓度对P.c.菌生长及产MnP酶活的影响
由图4可知, Ca2+浓度对P.c.菌的生长及产MnP酶活有很大的影响,随着Ca2+浓度的增大,菌生物量和MnP酶活增大;在Ca2+浓度为25 mg·L-1时,两者均达到最大,分别为0.0531 g和701.48 U·L-1;之后随着Ca2+浓度的增大,菌生物量及MnP酶活减小,但是总体呈促进作用。Ca2+是微生物生长所必需的元素,能有效防止MnP发生热失活,有利于菌的生长及产酶。但是高浓度Ca2+可能会与真菌相互作用,引起菌生理过程的变化,从而抑制其生长。
2.5 Fe2+浓度对P.c.菌生长及产MnP酶活的影响
改变产酶体系的Fe2+浓度分别为0 mg·L-1、2 mg·L-1、4 mg·L-1、6 mg·L-1、8 mg·L-1、10 mg·L-1、12 mg·L-1、14 mg·L-1,测定产酶培养后的菌生物量及MnP酶活,结果见图5。
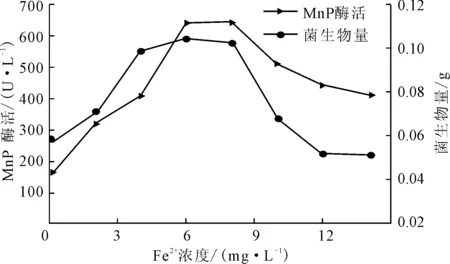
图5 Fe2+浓度对P.c.菌生长及产MnP酶活的影响
由图5可知,Fe2+的添加有效地促进了P.c.菌的生长及MnP酶活;在Fe2+浓度低于8 mg·L-1时,菌生物量及MnP酶活均随着Fe2+浓度的增大而增大;在Fe2+浓度为6~8 mg·L-1时的产酶效果较好,菌生物量达到0.1026 g,MnP酶活达到646.1 U·L-1;当Fe2+浓度大于8 mg·L-1后,菌生物量及MnP酶活随着Fe2+浓度的增大而减小,当Fe2+浓度达到14 mg·L-1时均低于对照组。由此可见,Fe2+在P.c.菌生长及产MnP方面具有很重要的作用。
2.6 Cu2+浓度对P.c.菌生长及产MnP酶活的影响
改变产酶体系的Cu2+浓度分别为0 mg·L-1、0.1 mg·L-1、0.2 mg·L-1、0.3 mg·L-1、0.4 mg·L-1、0.5 mg·L-1、0.6 mg·L-1、0.7 mg·L-1,测定产酶培养后的菌生物量及MnP酶活,结果见图6。
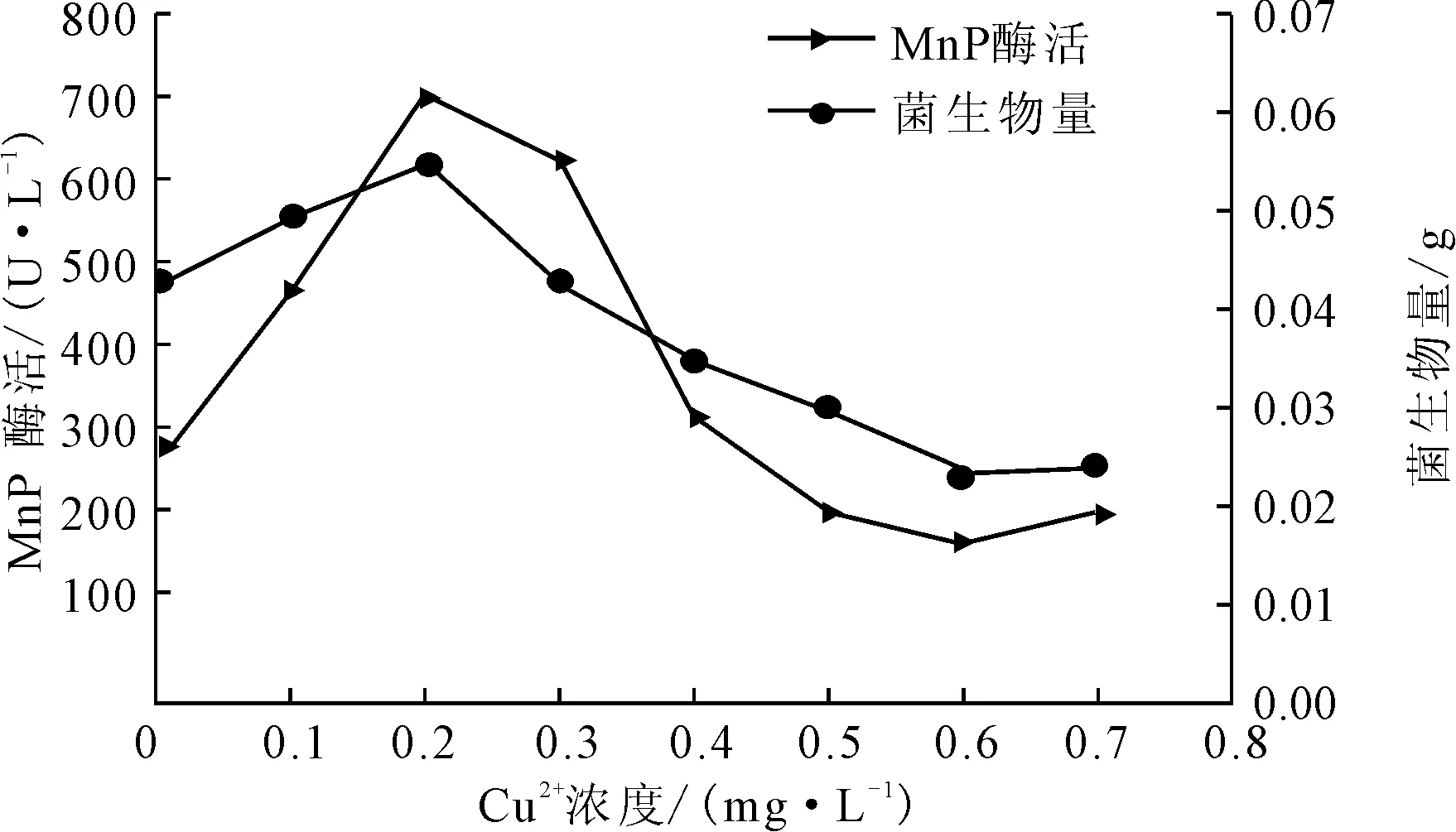
图6 Cu2+浓度对P.c.菌生长及产MnP酶活的影响
由图6可知,随Cu2+浓度的增大,菌生物量及MnP酶活均增大;在浓度为0.2 mg·L-1时,菌生物量及MnP酶活均达到最大,分别为0.0546 g和701.48 U·L-1,说明低浓度Cu2+可以显著促进P.c.菌的生长及MnP酶活;而当Cu2+浓度超过0.2 mg·L-1后,菌生物量及MnP酶活呈明显下降趋势;当Cu2+浓度达到0.4 mg·L-1时,菌生物量及产MnP酶活已经低于对照组,说明该浓度下Cu2+已对菌的生长及产MnP酶活产生了显著的抑制作用。这可能是由于Cu2+的重金属作用引起的。重金属离子会对微生物起毒害作用,可使蛋白质变性,且毒害作用在重金属离子浓度较高时尤为明显,所以Cu2+浓度越高,毒害作用越严重,使酶几乎失活[14]。
3 结论
(1)藜芦醇、苯甲醇和吐温80的添加有利于白腐真菌的生长及产MnP:藜芦醇在浓度为150 mg·L-1、苯甲醇在浓度为150 mg·L-1、吐温80在浓度为14 mg·L-1时对MnP酶活的促进作用最好。
(2)Ca2+、Fe2+对白腐真菌的生长及MnP酶活的影响是一致的,表现为“先促进,后抑制”的作用。
(3) Cu2+对白腐真菌的生长及MnP酶活的抑制作用较明显,仅在浓度小于0.4 mg·L-1时略微促进酶活,大于该浓度均表现为抑制作用。
参考文献:
[1]张力,邵喜霞,韩大勇.白腐真菌木质素降解酶系研究进展[J].畜牧与饲料科学,2009,30(1):35-37.
[2]PASTI M B,PASZCZYNSKI A,GROZCZYNSKI S.Influence of aromatic substitution patterns on azo dye degradability byStreptomycesspp. andPhanerochaetechrysosporium[J].Appl Environ Microbiol,1992,58(11):3605-3613.
[3]徐海娟,梁文芷.白腐菌降解木素酶系及其作用机理[J].环境污染治理与设备,2000,1(3):51-54.
[4]崔艳红,韩庆功,常魁珍,等.木质层孔菌产锰过氧化物酶条件的优化及酶学性质研究[J].饲料工业,2012,33(12):55-59.
[5]李慧蓉,陈建海.黄孢原毛平革菌对蒽的降解研究[J].化工环保,2000,20(2):11-14.
[6]谭丽泉,余梅,黄敏,等.黄孢原毛平革菌的生长及降解石油条件的优化[J].化工环保,2012,32(1):11-15.
[7]陈敏,郭倩,姚善泾.响应面法优化白腐菌Pleurotuseryngii-Co007产木质素降解酶条件[J].核农学报,2011,25(3):482-487.
[8]MOREIRA M T,SANROMAN A,FEIJOO G,et al.Control of pellet morphology of filamentous fungi in fluidized bed bioreactors by means of a pulsing flow[J].Enzyme and Microbial Technology,1996,19(4):261-266.
[9]PASZCZYNSKI A,CRAWFORD R L,HUYNH V B.Manganese peroxidase ofPhanerochaetechrysosporium:Purification[J].Purification Methods in Enzymology,1988,161(2):264-270.
[10]CANECL A M,ORTH A B,TIEN M.Lignin and veratryl alcohol are not inducers of the ligninolytic system of phanaerochaete chrysosporium[J].Applied and Environment Microbiology,1993,59:2909-2913.
[11]BOCKLE B,MARTINEZ M J,GUILLEN F,et al.Mechanism of peroxidase in activation in liquid cultures of the ligninolytic fungus pleurotus pulmonarius[J].Appl Environ Microbiol,1999,65(3):923-928.
[12]JEFERIES T W,CHOI S,KIRK T K.Nutritional regulation of lignin degradation byPhanerochaetechrysosporium[J].Appl Environ Microbiol,1981,42(2):290-296.
[13]韩增辉.表面活性剂构建体系中漆酶对木素模式化合物的催化降解[D].长沙:湖南大学,2012.
[14]李德莹,龚大春,田毅红,等.金属离子对纤维素酶活力影响的研究[J].酿酒科技,2009,18(6):40-42.

