非核苷类抗乙肝病毒小分子抑制剂的研究进展
蔡文玺,刘文波,苏发生,王润玲,董卫莉
(天津医科大学药学院 天津市临床药物关键技术重点实验室,天津 300070)
慢性乙型肝炎病毒(HBV)感染与肝疾病(如慢性肝功能不足、肝硬化和肝癌等)有着非常大的关系[1]。据世界卫生组织(WHO)估计,目前,超过20亿人曾感染过HBV。其中,约3.5亿人仍然长期感染,成为病毒携带者。每年大约有100万HBV感染者死于肝硬化、肝功能衰竭和肝癌。目前,抗HBV临床用药主要是核苷或核苷类似物,由于它们是通过与天然三磷酸脱氧核苷(dNTPs)竞争来抑制HBV DNA聚合酶的,所以不可避免地会产生耐受性。因此,迫切需要开发可用于联合治疗的作用于病毒生命周期新靶点的药物[2]。鉴于此,许多研究机构致力于研发与核苷和核苷类似物抑制剂具有不同作用模式的非核苷类抗HBV药物。作者就非核苷类抗HBV小分子抑制剂的最新研究进展进行综述。
1 苯丙(烯)酰胺类
在HepAD38细胞分析筛查中,苯丙(烯)酰胺类衍生物(1~8,图1)表现出很好的抗HBV活性,其IC50均低于4 μmol·L-1,并且无常见的毒性[3]。构效关系研究显示,乙烯基溴类有着比乙烯基氯类稍高的活性和较低的毒性。通常,A环的4位取代基对其活性影响不大,而B环的4位取代基可提高化合物活性。另外,AT-61(化合物1)和AT-130(化合物8)在体外研究中同样表现出对拉米夫定耐受突变株的抑制活性。AT-61具有高度特异性,只选择性抑制人类HBV的复制,对其它病毒复制无影响。最初,苯丙(烯)酰胺类衍生物的作用机制被认为是通过干扰前基因组pgRNA的包装,从而产生不成熟的核心颗粒,而不是作用于HBV DNA聚合酶来抑制HBV复制的。Katen等[4-5]研究表明,AT-130通过与位于HBV衣壳蛋白的B和C二聚体连接处的憎水口袋键合,诱导三级和四级结构的细微改变,从而导致形态学上正常的衣壳缺少逆转录酶前基因组RNA复合体。
Qiu等[6]以苯丙酰胺类化合物马蹄金素[N-(N-苯甲酰基-L-苯丙氨酰基)-O-乙酰基-L-苯丙氨醇,MTS]为先导化合物,设计并合成了一系列新型苯丙酰胺类衍生物,并在离体实验中对它们进行了抗HBV活性测试。结果表明:在测试浓度范围内,化合物9~11(IC50分别为4.37 μmol·L-1、2.85 μmol·L-1、0.71 μmol·L-1,图1)对HBV DNA复制的抑制活性远高于阳性对照拉米夫定(IC50=82.42 μmol·L-1),该类化合物已作为治疗乙型肝炎的一类新药进行临床前研究。
Jiang等[7]首次在胡椒科植物荜茇中发现一系列具有抗HBV活性的酰胺类生物碱,其中化合物12(IC50=210 μmol·L-1,SI=16.4,图1)对HBeAg的分泌具有很强的抑制作用。该化合物也属于苯丙(烯)酰胺类,且结构简单,可作为先导结构进一步优化以提高活性。

图1 苯丙(烯)酰胺类化合物的结构式
2 喹啉类
Liu等[8]发现一些喹啉类衍生物(图2)具有强效的抗HBV活性。在7-羟基喹啉化合物中,化合物13(IC50=3.5 μmol·L-1,SI=37.9)和14(IC50=2.6 μmol·L-1)在抑制HBV DNA活性方面均高于阳性对照拉米夫定(IC50=343.2 μmol·L-1)。在6-羟基喹啉化合物中,化合物15和16能同时抑制HBsAg和HBeAg的分泌[9];它们还能抑制HBV DNA的复制,IC50分别为10.7 μmol·L-1和4.7 μmol·L-1。构效关系研究表明,氟代物可提高活性,而硫化物氧化而成的亚磺酰基对抗HBV活性和细胞毒性的影响较小。
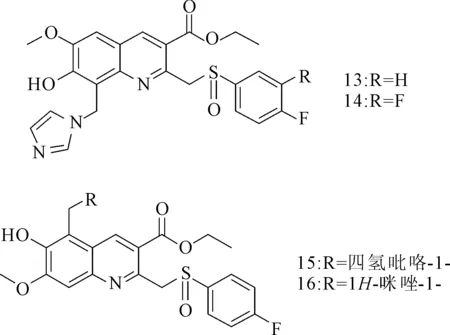
图2 6(7)-羟基喹啉类化合物的结构式
Cheng等[10]合成了一系列4-芳基-6-氯-喹啉-2-酮类衍生物(图3),其中的大多数化合物均可抑制HBsAg的分泌,IC50为0.01~2.84 μmol·L-1。构效关系研究显示,化合物17~19比相应的羟基乙基衍生物20~22具有更好的抗HBV活性,表明在4-芳基-6-氯-喹啉-2-酮的3位引入羟乙基是赋予其抗HBV活性的一个重要特征[11]。此外,酯衍生物化合物23对抑制HBsAg和HBeAg的分泌作用及HBV DNA的复制均表现出非常好的活性。抗HBV作用机理初步研究表明,化合物23主要是通过促进HBV增强子ENⅠ和ENⅡ的转录来发挥抗HBV作用[12]。
3 二氢嘧啶类
二氢嘧啶类(HAPs)化合物Bay41-4109(24,IC50=50 nmol·L-1,图4)、Bay38-7690(25,IC50=150 nmol·L-1,图4)和Bay39-5493(26,IC50=30 nmol·L-1,图4)对HBV复制有很强的抑制作用。构效关系研究表明:1位N上的氢原子对于保持化合物的抗病毒活性是必要的;2位为含氮的芳香杂环活性较好,为苯环时则活性消失;4位上为2-氯-4-氟苯基时活性最强[13]。该类化合物是目前唯一明确作用于病毒核衣壳的抗HBV化合物,主要通过作用于病毒核衣壳、误导其装配达到抑制HBV感染的目的[14]。Bay41-4109与AT-130的结合位点和对病毒核衣壳的加速组装以及稳定效果有相似之处,但是它们有着不同的表面共价结合特点。在结合了Bay41-4109的衣壳结构中,C-亚基口袋拥有最强的结合密度,然而在结合了AT-130的衣壳结构中,最强结合密度在B-亚基口袋[15]。
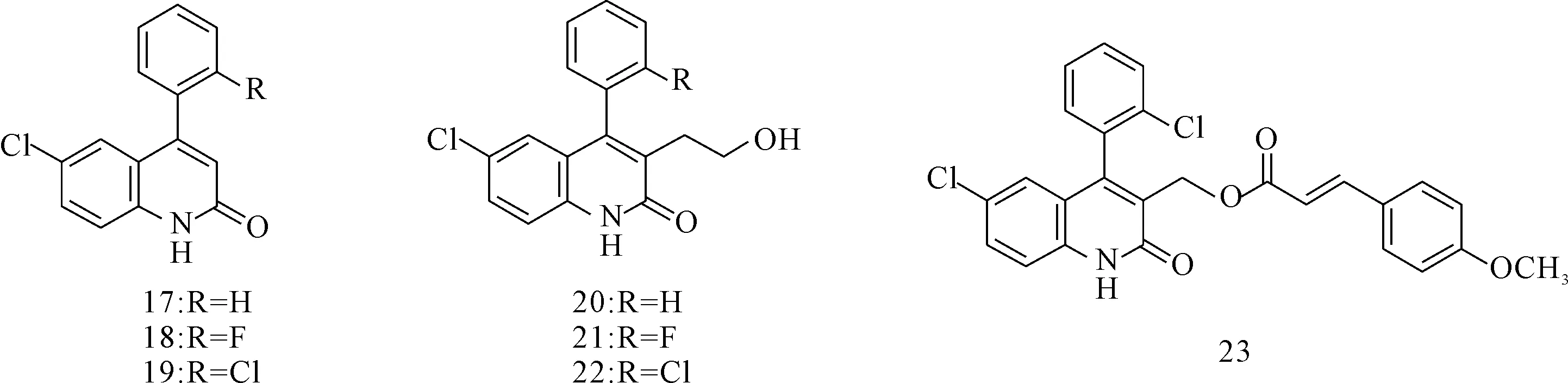
图3 4-芳基-6-氯-喹啉-2-酮类化合物的结构式

图4 二氢嘧啶类化合物的结构式
另外,体外实验还发现Bay41-4109能够有效地抑制一些对拉米夫定和阿德福伟耐药的HBV毒株。在临床研究中,Bay41-4109和Bay41-5493表现出了良好的药代动力学性质。鉴于HAPs化合物特殊的作用机制,及其体内外活性评价中表现出的高效低毒的性质,该类化合物有望成为新型的HBV治疗药物[16]。
4 吲哚类
已在俄罗斯批准上市治疗流感病毒A和B感染的Arbidol(27,图5)具有抑制某些病毒的活性,如呼吸道合胞病毒、副流感病毒、鼻病毒和丙型肝炎病毒[17-18]等。将其抗病毒谱扩展至HBV,IC50为22.85 μg·mL-1[19]。衍生物28~31(图5)也表现出显著的抗HBV活性,IC50均小于60 μg·mL-1[20-21]。构效关系研究显示,在苯环上引入氟或氯原子可提高其抗HBV活性,将硫原子氧化成磺酰基可提高其抗HBV活性[22-23]。
Qu等[24]合成了一系列3-氨乙基吲哚类衍生物,并在HepG2.2.15细胞系中评价了它们的抗HBV活性。其中,化合物32(IC50=0.4 μmol·L-1,图5)和33(IC50<1 μmol·L-1,图5)具有很好的抗HBV活性,且细胞毒性较低,CC50分别为40.6 μmol·L-1和>25 μmol·L-1,具有进一步的研究价值。
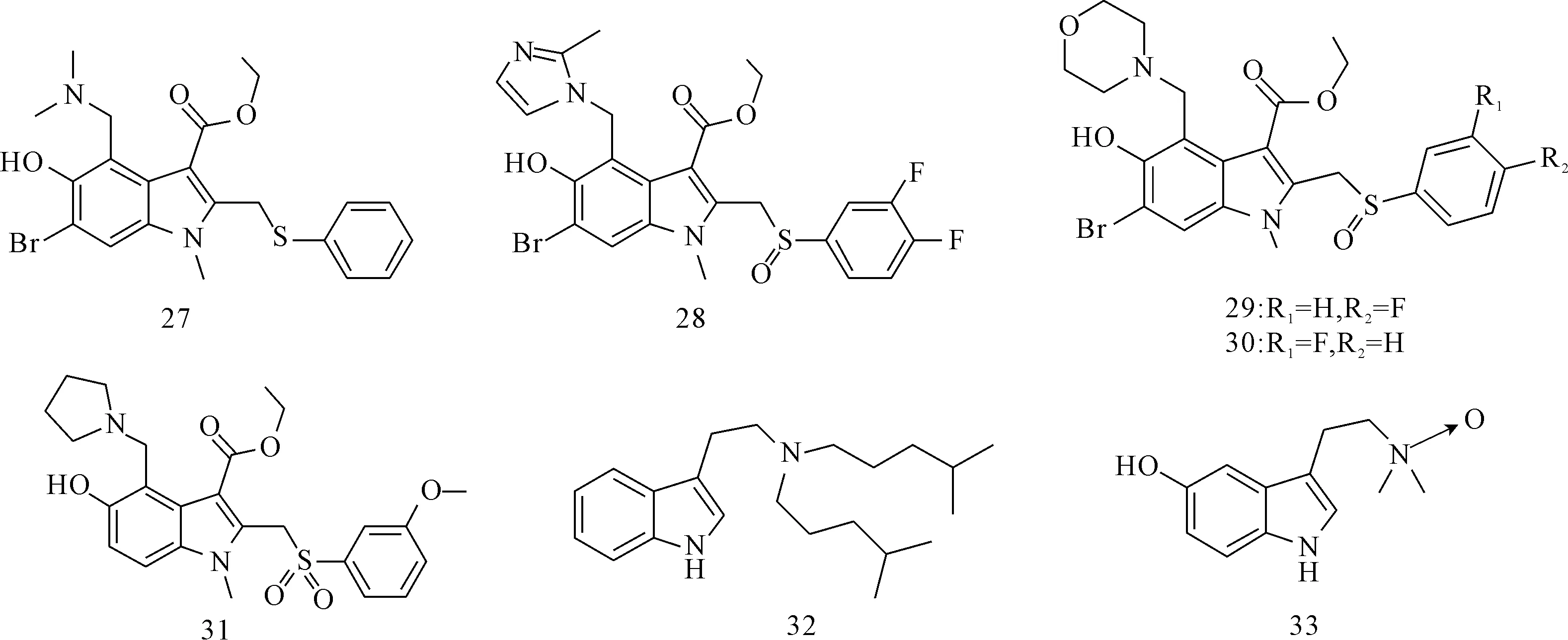
图5 吲哚类化合物的结构式
5 三唑类
Dougherty等[25]通过高通量筛选,发现化合物34(图6)可以抑制HBsAg的分泌作用,EC50为1.5 μmol·L-1,CC50超过50 μmol·L-1,而对HBV DNA的复制无抑制作用,说明其抑制作用不依赖于病毒基因的复制,有望成为抗HBV的新型小分子抑制剂。通过化合物库筛查,Asif-Ullah等[26]发现化合物35(图6)可以抑制核心蛋白和表面蛋白PreS区的相互作用,可以阻止HuH7细胞生成HBV颗粒,IC50为0.12 μmol·L-1。尽管该化合物表现出很好的抗HBV活性,但仍需对其与表面和核心蛋白作用的详细机制进行更深入研究。
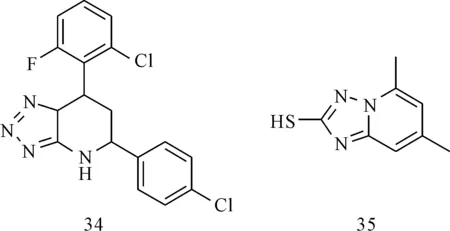
图6 三唑类化合物的结构式
6 苯并咪唑类
在一次随机筛选中,Li等[27]发现化合物36(图7)是一种HBV抑制剂,其抑制HBV DNA的IC50为14.2 μmol·L-1。在此基础上,对该化合物进行优化衍生得到的化合物37(IC50=0.9 μmol·L-1,SI>111,图7)和38(IC50=0.7 μmol·L-1, SI>714,图7)[28]表现出了有效的抗HBV活性。但是,这些结构的水溶性不好,为了提高其水溶性和口服生物利用度, Luo等[29]对结构进行优化,发现化合物39(IC50<0.41 μmol·L-1,SI>81.2,图7)具有很好的成药性,且毒性比对照药拉米夫定(SI=31.3)要低得多。

图7 苯并咪唑类化合物的结构式
7 吡啶-2-酮类
LÜ等[30]合成了一系列吡啶-2-酮类化合物,并评价了它们的抗HBV活性和细胞毒性。发现化合物40(IC50=0.206 μmol·L-1,SI>532,图8)和41(图8)具有较高的抗HBV活性,细胞毒性较低。
张明峰等[31]设计合成了一系列吡啶-2-酮类化合物,并评价了它们的活性,发现它们对HBV DNA的复制都有一定的抑制作用。其中化合物42和43(图8)显示出很好的抑制HBV DNA复制活性,具有进一步研究的价值。构效关系研究表明,当以其它基团取代苯环N原子上的对乙氧基苯基时,抗HBV活性有所下降,而且毒性有所增加,其中以烷基取代毒性增加最为显著。由此可以看出,N原子上的供电子基团对化合物的活性非常重要,而烷烃对活性不利。

图8 吡啶-2-酮类化合物的结构式
8 噻唑类
Korba等[32]研究发现,硝唑尼特(NTZ,44)及其脱乙酰基类似物(45)、RM-4832(46)、RM-4848(47)、RM-4850(48)和RM-4852(49)具有较高的抗HBV抑制活性,其EC50为0.12~1.2 μmol·L-1,结构见图9。尤其是在Huh7细胞瞬时转染实验中发现,硝唑尼特和RM-4850能够有效抑制一些拉米夫定和阿德福韦酯耐药的HBV毒株。目前硝唑尼特正处于治疗慢性丙型肝炎的Ⅱ期临床研究阶段。

图9 噻唑类化合物的结构式
含噻唑的双杂环化合物50(IC50=76.4 μmol·L-1,图10)表现出中等的抗HBV活性[33]。构效关系研究表明,位于杂环B 5位的大脂肪族基团对化合物的抗HBV DNA复制活性有利,其羧酸类似物51(IC50=60 μmol·L-1,图10)的抑制活性与其酯类似物52(IC50=2.4 μmol·L-1,图10)和53(IC50=1.1 μmol·L-1,图10)相比明显降低。噻唑环A环可以由噻吩环(54,图10)和苯并噻吩环(55,图10)代替。其中,双噻唑杂环化合物56(IC50=0.14 μmol·L-1,图10)表现出最强的抗HBV DNA复制活性,其活性比对照药拉米夫定(IC50=0.26 μmol·L-1)还要高。这些化合物在200 μg·mL-1浓度下,对HBV DNA聚合酶无活性,预示其作用机制与DNA聚合酶的抑制无关。

图10 含噻唑双杂环类化合物的结构式
9 噻二唑类
Chen等[34]在对噻二唑杂环生物活性的研究中首次报道了1,2,3-噻二唑杂环具有抗HBV活性,在0.6 μmol·L-1的浓度下,化合物57(图11)可以将HBsAg和HBeAg的分泌分别降低88.6%和15.5%,并能抑制HBV DNA的复制,IC50为400 μmol·L-1。以化合物57为先导结构,利用活性拼接和生物电子等排原理,Dong等[35]设计合成得到一系列新型含1,2,3-噻二唑的丙烯酰胺类衍生物,并在离体实验中评价了它们的抗HBV活性,其中化合物58、59、61(IC50分别为10.4 μmol·L-1、3.59 μmol·L-1、9.00 μmol·L-1,图11)能够抑制HBV DNA的复制,而化合物60(IC50=12.26 μmol·L-1,图11)能特异性抑制HBeAg的分泌。

图11 噻二唑类化合物的结构式
10 其它类化合物
苯磺酸类化合物(Bis-ANS,62,图12)可以和衣壳蛋白键合,抑制正常衣壳的装配,促进非衣壳聚合物的装配[36],是一种新型HBV抑制剂。Zhang等[37]新合成了一系列异黄酮类化合物,活性测试发现化合物63(图12)具有最好的抗HBV活性,它对HBsAg、HBeAg的分泌及HBV DNA复制均有抑制活性,IC50分别为10.22 μmol·L-1、2.34 μmol·L-1和4.70 μmol·L-1,且具有较小的细胞毒性,CC50为717.95 μmol·L-1。Crosby等[38]发现萘醌三聚体(64,图12)
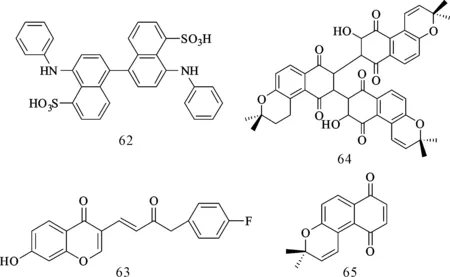
图12 其它结构抗HBV抑制剂
具有很好的抗HBV DNA复制的活性(EC50=0.009 μmol·L-1,CC50=279 μmol·L-1),并尝试将其吡喃/二氢吡喃环用甲氧基取代或直接去掉以寻找HBV的小分子抑制剂,但是,结构更简单的萘醌三聚体类似物的活性都比化合物64差。在尝试重新合成化合物64时,小分子化合物65(图12)被合成出来并表现出很强的抗HBV活性,并对拉米夫定耐药病毒株有抑制作用,且与核苷类抗HBV药物的抑制机制不同。
11 展望
尽管目前临床所用核苷类抗HBV药物具有快速有效的抗病毒活性,但依然存在耐受性及副作用等许多需要解决的问题。为消除这些不良反应,需开发不同作用机制的新药。许多非核苷类化合物显示出潜在抗HBV活性。其中,很多药物表现出很强的抗HBV活性,并可选择性作用于耐药性病毒。与核苷类抑制剂作用机制不同,这些结构新颖的非核苷类抑制剂通过作用于HBV衣壳化、衣壳的装配和mRNA转录等发挥作用。鉴于抗病毒药物的发展、新的候选药的发现以及联合治疗的应用,乙肝的治疗在不久的未来将会得到有效解决。
参考文献:
[1]KIM K H,KIM N D,SEONG B L.Discovery and development of anti-HBV agents and their resistance[J].Molecules,2010,15(9):5878-5908.
[2]ZHANG F,WANG G.A review of non-nucleoside anti-hepatitis B virus agents[J].Eur J Med Chem,2014,75:267-281.
[3]WANG P,NADUTHAMBI D,MOSLEY R T,et al.Phenylpropenamide derivatives:Anti-hepatitis B virus activity of the Z isomer,SAR and the search for novel analogs[J].Bioorg Med Chem Lett,2011,21(15):4642-4647.
[4]KATEN S P,CHIRAPU S R,FINN M G,et al.Trapping of hepatitis B virus capsid assembly intermediates by phenylpropenamide assembly accelerators[J].ACS Chem Biol,2010,5(12):1125-1136.
[5]KATEN S P,TAN Z,CHIRAPU S R,et al.Assembly-directed antivirals differentially bind quasiequivalent pockets to modify hepatitis B virus capsid tertiary and quaternary structure[J].Structure,2013,21(8):1406-1416.
[6]QIU J,XU B,HUANG Z,et al.Synthesis and biological evaluation of Matijing-Su derivatives as potent anti-HBV agents[J].Bioorg Med Chem,2011,19(18):5352-5360.
[7]JIANG Z Y,LIU W F,HUANG C G,et al.New amide alkaloids from piper longum[J].Fitoterapia,2013,84:222-226.
[8]LIU Y,ZHAO Y,ZHAI X,et al.Synthesis and anti-HBV activities evaluation of new ethyl 8-imidazolylmethyl-7-hydroxyquinoline-3-carboxylate derivativesinvitro[J].Arch Pharm (Weinheim),2008,341(7):446-452.
[9]LIU Y,ZHAO Y,ZHAI X,et al.Synthesis and anti-hepatitis B virus evaluation of novel ethyl 6-hydroxyquinoline-3-carboxylatesinvitro[J].Bioorg Med Chem,2008,16(13):6522-6527.
[10]CHENG P,ZHANG Q,MA Y B,et al.Synthesis andinvitroanti-hepatitis B virus activities of 4-aryl-6-chloro-quinolin-2-one and 5-aryl-7-chloro-1,4-benzodiazepine derivatives[J].Bioorg Med Chem Lett,2008,18(13):3787-3789.
[11]GUO R H,ZHANG Q,MA Y B,et al.Synthesis and biological assay of 4-aryl-6-chloro-quinoline derivatives as novel non-nucleoside anti-HBV agents[J].Bioorg Med Chem,2011,19(4):1400-1408.
[12]GUO R H,ZHANG Q,MA Y B,et al.Structure-activity relationships study of 6-chloro-4-(2-chlorophenyl)-3-(2-hydroxyethyl) quinolin-2(1H)-one derivatives as novel non-nucleoside anti-hepatitis B virus agents[J].Eur J Med Chem,2011,46(1):307-319.
[13]WEI J,LIN L,SU X,et al.Anti-hepatitis B virus activity of leaf extracts in human HepG2.2.15 cells[J].Biomed Rep,2014,2(1):147-151.
[14]BILLIOUD G,PICHOUD C,PUERSTINGER G,et al.The main hepatitis B virus (HBV) mutants resistant to nucleoside analogs are susceptibleinvitroto non-nucleoside inhibitors of HBV replication[J].Antiviral Res,2011,92(2):271-276.
[15]DONG C,YU J,ZHU Y,et al.Inhibition of hepatitis B virus gene expression & replication by crude destruxins fromMetarhiziumanisopliaevar.dcjhyium[J].Indian J Med Res,2013,138(6):969-976.
[16]杨秀岩,赵国明,李松.以乙肝病毒核衣壳为靶标的二氢嘧啶类化合物及其作用机制研究进展[J].中国药物化学杂志,2013,23(6):493-498.
[17]KHAMITOV R A,LOGINOVA SIa,SHCHUKINA V N,et al.Antiviral activity of arbidol and its derivatives against the pathogen of severe acute respiratory syndrome in the cell cultures[J].Vopr Virusol,2008,53(4):9-13.
[18]ZHONG Q,YANG Z,LIU Y,et al.Antiviral activity of arbidol against Coxsackie virus B5invitroandinvivo[J].Arch Virol,2009,154(4):601-607.
[19]CHAI H,ZHAO Y,ZHAO C,et al.Synthesis andinvitroanti-hepatitis B virus activities of some ethyl 6-bromo-5-hydroxy-1H-indole-3-carboxylates[J].Bioorg Med Chem,2006,14(4):911-917.
[20]LENEVA I A,RUSSELL R J,BORISKIN Y S,et al.Characteristics of arbidol-resistant mutants of influenza virus:Implications for the mechanism of anti-influenza action of arbidol[J].Antiviral Res,2009,81(2):132-140.
[21]BORISKIN Y S,LENEVA I A,PECHEUR E I,et al.Arbidol:A broad-spectrum antiviral compound that blocks viral fusion[J].Curr Med Chem,2008,15(10):997-1005.
[22]CHAI H F,LIANG X X,LI L,et al.Identification of novel 5-hydroxy-1H-indole-3-carboxylates with anti-HBV activities based on 3D QSAR studies[J].J Mol Model,2011,17(8):1831-1840.
[23]KAUSHIK S,GUPTA S P,SHARMA P K.Design and development of anti-hepatitis B virus agents[J].Curr Med Chem,2010,17(29):3377-3392.
[24]QU S J,WANG G F,DUAN W H,et al.Tryptamine derivatives as novel non-nucleosidic inhibitors against hepatitis B virus[J].Bioorg Med Chem,2011,19(10):3120-3127.
[25]DOUGHERTY A M,GUO H,WESTBY G,et al.A substituted tetrahydro-tetrazolo-pyrimidine is a specific and novel inhibitor of hepatitis B virus surface antigen secretion[J].Antimicrob Agents Chemother,2007,51(12):4427-4437.
[26]ASIF-ULLAH M,CHOI K J,CHOI K I,et al.Identification of compounds that inhibit the interaction between core and surface protein of hepatitis B virus[J].Antiviral Res,2006,70(2):85-90.
[27]LI Y F,WANG G F,HE L,et al.Synthesis and anti-hepatitis B virus activity of novel benzimidazole derivatives[J].J Med Chem,2006,49(15):4790-4794.
[28]LUO Y,YAO J P,YANG L,et al.Design and synthesis of novel benzimidazole derivatives as inhibitors of hepatitis B virus[J].Bioorg Med Chem,2010,18(14):5048-5055.
[29]LUO Y,YAO J P,YANG L,et al.Synthesis and anti-hepatitis B virus activity of a novel class of thiazolylbenzimidazole derivatives[J].Arch Pharm Chem Life Sci,2011,344(2):78-83.
[30]LV Z,SHENG C,WANG T,et al.Design,synthesis,and antihepatitis B virus activities of novel 2-pyridone derivatives[J].J Med Chem,2010,53(2):660-668.
[31]张明峰,吕志良,李科.新型吡啶-2-酮酰胺类化合物的设计、合成及抗乙肝病毒活性研究[J].药学实践杂志,2013,31(2):102-106.
[32]KORBA B E,MONTERO A B,FARRAR K,et al.Nitazoxanide,tizoxanide and other thiazolides are potent inhibitors of hepatitis B virus and hepatitis C virus replication[J].Antiviral Res,2008,77(1):56-63.
[33]ZHAO W G,WANG J G,LI Z M,et al.Synthesis and antiviral activity against tobacco mosaic virus and 3D-QSAR of alpha-substituted-1,2,3-thiadiazoleacetamides[J].Bioorg Med Chem Lett,2006,16(23):6107-6111.
[34]CHEN H J,WANG W L,WANG G F,et al.Rational design and synthesis of 2,2-bisheterocycle tandem derivatives as non-nucleoside hepatitis B virus inhibitors[J].Chem Med Chem,2008,3(9):1316-1321.
[35]DONG W L,LIU Z X,LIU X H,et al.Synthesis and antiviral activity of new acrylamide derivatives containing 1,2,3-thiadiazole as inhibitors of hepatitis B virus replication[J].Eur J Med Chem,2010,45(5):1919-1926.
[36]ZLOTNICK A,CERES P,SINGH S,et al.A small molecule inhibits and misdirects assembly of hepatitis B virus capsids[J].J Virol,2002,76(10):4848-4854.
[37]ZHANG Y,ZHONG H,LV Z,et al.Anti-hepatitis B virus and anti-cancer activities of novel isoflavone analogs[J].Eur J Med Chem,2013,62:158-167.
[38]CROSBY I T,BOURKE D G,JONES E D,et al.Antiviral agents 3.Discovery of a novel small molecule non-nucleoside inhibitor of hepatitis B virus (HBV) [J].Bioorg Med Chem Lett,2011,21(6):1644-1648.

