饲粮能量水平对育成期水貂生长性能和血清生化指标的影响
杨颖,李一清,徐佳萍,曲勃,邢秀梅※
(1.中国农业科学院特产研究所吉林省特种经济动物分子生物学省部共建实验室,长春 130112; 2.长春职业技术学院,长春 130021)
育成期是幼龄水貂的生长发育期,这一时期的水貂生长发育旺盛,体长和体重增加速度快,对能量需要量较高[1]。因此,饲粮应充分保证幼貂机体快速生长发育的能量需要。如果饲粮能量供给不足,会导致生长发育缓慢或停止,进而会导致一些疾病的产生。血清生化指标在一定程度上反映动物机体的代谢机能和健康状况,也是进行疾病诊断的一个重要途径。近年来,国内、外关于营养因素对毛皮动物的血清指标影响有些报道,但能量水平对水貂血清生化指标的影响却鲜有报道[2~5]。本研究以水貂为研究对象,通过配制不同能量水平的饲粮,研究其对水貂生长性能和血清生化指标的影响,旨在探讨水貂饲粮能量需要与机体能量代谢相关血清指标的相关性,为科学、合理设计育成期水貂饲料配方提供科学的依据和参考。
1 材料与方法
1.1 试验日粮
设计8种水貂干粉料试验日粮,能量水平分别为13.0 MJ/kg(A组)、13.5MJ/kg(B组)、14.0MJ/kg(C组)、14.5MJ/kg(D组)、15.0MJ/kg(E组)、15.5MJ/kg(F组)、16.0MJ/kg(G组)、16.5MJ/kg(H组)。试验饲粮组成及营养成分见表1。
表1试验日粮组成及营养成分(风干基础)
Table1compositionandnutrientlevelsofexperimentaldiets(dry matter,%)
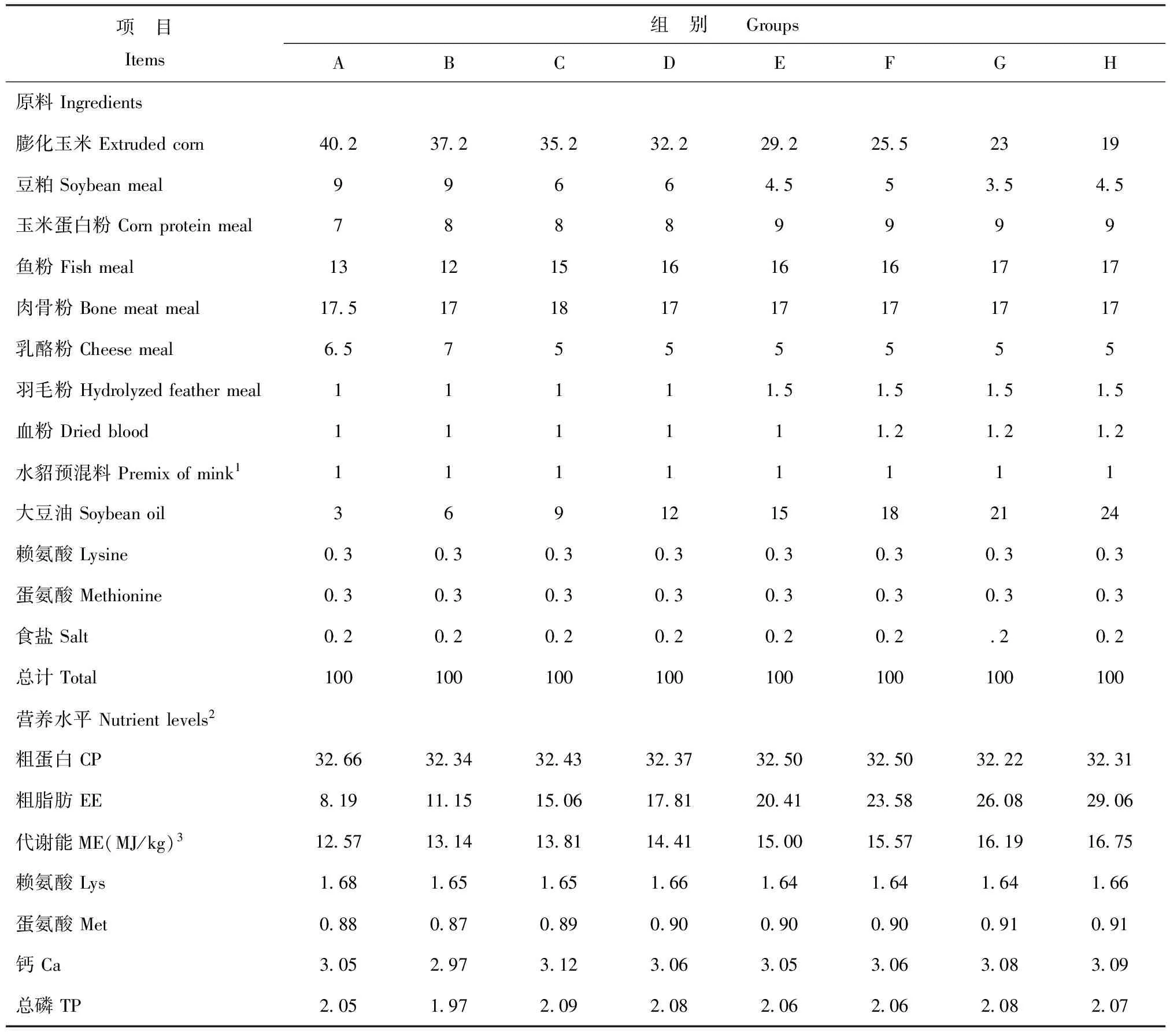
项 目Items组 别 GroupsABCDEFGH原料Ingredients膨化玉米Extrudedcorn4023723523222922552319豆粕Soybeanmeal99664553545玉米蛋白粉Cornproteinmeal78889999鱼粉Fishmeal1312151616161717肉骨粉Bonemeatmeal17517181717171717乳酪粉Cheesemeal657555555羽毛粉Hydrolyzedfeathermeal111115151515血粉Driedblood11111121212水貂预混料Premixofmink111111111大豆油Soybeanoil3691215182124赖氨酸Lysine0303030303030303蛋氨酸Methionine0303030303030303食盐Salt020202020202202总计Total100100100100100100100100营养水平Nutrientlevels2粗蛋白CP32663234324332373250325032223231粗脂肪EE8191115150617812041235826082906代谢能ME(MJ/kg)312571314138114411500155716191675赖氨酸Lys168165165166164164164166蛋氨酸Met088087089090090090091091钙Ca305297312306305306308309总磷TP205197209208206206208207
注:1.每千克预混料含有VA200 000IU,VD340 000IU,VE5000IU,VB112mg,VB2200mg,VB6200mg,VB122.5mg,VK340mg,VC7500mg,烟酸500mg,泛酸800mg,叶酸100mg,胆碱10 000mg,生物素7.5mg,Fe 2000mg,Cu 500mg,Mn 400mg,Zn 1500mg,I 15mg,Se 5mg,Co 7.5mg;2.粗蛋白、粗脂肪、钙、总磷为测定值,其它为计算值;3.代谢能是根据消化率、总能以及狗的氮矫正公式[NRC 2005]得出的推算值,其他为测定值。
Note:Contained the following per kg of premix VA200 000IU,VD340 000IU,VE5000IU,VB112mg,VB2200mg,VB6200mg,VB122.5mg,VK340mg,VC7500mg,niacin acid 500mg,pantothenic acid 800mg,folic acid 100mg,choline 10 000mg,biotin 7.5mg,Fe 2000mg,Cu 500mg,Mn 400mg,Zn 1500mg,I 15mg,Se 5mg,Co 7.5mg;2.Values of CP,EE,Ca and TP were measured,others were calculated;3.ME calculated according to the digestibility coefficients achieved,GE and N-correction from Nutrient requirements of dogs[NRC 2005].
1.2 主要试剂及仪器
总蛋白试剂盒、白蛋白试剂盒、葡萄糖试剂盒、总胆固醇试剂盒、直接高密度脂蛋白试剂盒、直接低密度脂蛋白试剂盒(北京中生北控生物科技有限公司),AMS-18型全自动生化分析仪(北京北方奥普森科技发展有限公司)。
1.3 试验动物及饲养管理
2011年7月初,在中国农业科学院特产研究所毛皮基地(农业部长白山野外观测实验站)选择60日龄192只体重(♂1.04±0.06kg、♀0.76±0.03kg)相近、健康水貂,随机分成8组,每组24只(公、母各半),单笼饲养。8组水貂分别饲喂代谢能为13.0MJ/kg、13.5MJ/kg、14.0MJ/kg、14.5MJ/kg、15.0MJ/kg、15.5MJ/kg、16.0MJ/kg、16.5MJ/kg的试验日粮。预饲期7d,正式饲喂50d。每天早、晚各饲喂1次,自由饮水,每15d称重1次。
1.4 血液采集及处理
每组选择7只公貂、7只母貂于晨饲前剪趾采血5mL,置于一次性真空采血促凝管中,立即颠倒混合5次~8次,室温静置30min,3000r/min离心15min,取上层血清分装于1.5mL灭菌Eppondorf管中,保存于-80℃备用。
1.5 检测原理及分析方法
将保存在-80℃的血清样品置于4℃冰箱中缓慢融化。同时参照各试剂盒说明书进行血清生化指标的检测。具体测试指标及原理如下:
总蛋白(Total Protein,TP):双缩脲法;白蛋白(Albumin,Alb):溴甲酚绿法;总胆固醇(Cholesterol,TC):酶比色法;直接高密度脂蛋白胆固醇(Direct High Density Cholesterol,DHDL-C)、直接低密度脂蛋白胆固醇(Direct Low Density Cholesterol,DLDL-C):清除法;葡萄糖(Glucose,Glu):葡萄糖氧化酶法。
1.6 数据处理
2 结果
2.1 能量水平对育成期水貂生长性能的影响
水貂试验末体重差异极显著(P<0.01)。公貂试验末体增重明显高于母貂,公貂的A组(13.0MJ/kg)显著低于其他各组,母貂G组(16.0MJ/kg)的体重显著高于其他各组(表2)。
表2育成期水貂体重累积生长结果
Table2GrowthofbodyweightinminksofgrowingPeriod(kg)
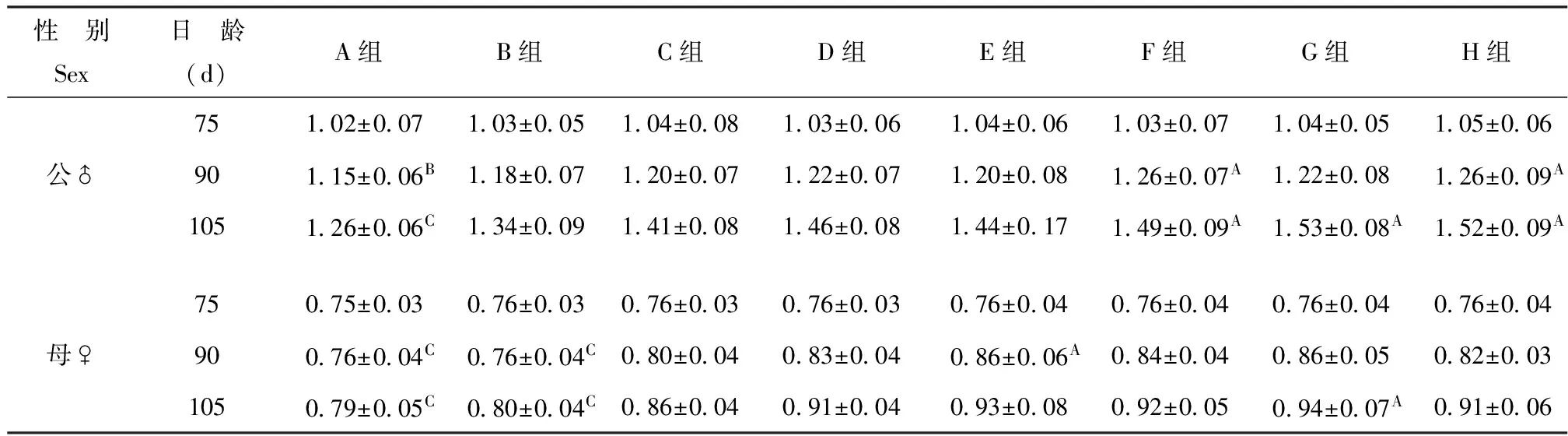
性 别Sex日 龄(d)A组B组C组D组E组F组G组H组公♂75102±007103±005104±008103±006104±006103±007104±005105±00690115±006B118±007120±007122±007120±008126±007A122±008126±009A105126±006C134±009141±008146±008144±017149±009A153±008A152±009A母♀75075±003076±003076±003076±003076±004076±004076±004076±00490076±004C076±004C080±004083±004086±006A084±004086±005082±003105079±005C080±004C086±004091±004093±008092±005094±007A091±006
注:同行数据肩标不同大写字母表示差异极显著(P<0.01),不同小写字母表示差异显著(P<0.05),未标字母表示差异不显著(P>0.05),下表同。
Note:In the same row,values with different capital letter superscripts mean very significant difference(P<0.01),small letter superscripts mean significant difference(P<0.05),while no letter superscripts mean no significant difference(P>0.05),the same as below.
2.2 能量水平对育成期水貂血清生化指标的影响
2.2.1公貂血清生化指标的检测结果由表3可以看出,公貂的血清白蛋白F组、E组极显著高于B组(P<0.01),G组、A组、H组、D组、C组、B组之间差异不显著(P>0.05);血清总胆固醇G组、F组、H组显著高于E组、C组、D组、B组、A组(P<0.05),G组、F组、H组之间及E组、C组、D组、B组、A组之间差异不显著(P>0.05);血清总蛋白F组显著高于C组、A组、B组(P<0.05),而H组、G组、E组、D组之间差异不显著(P>0.05);血清葡萄糖各组之间没有显著差异(P>0.05);直接高密度脂蛋白胆固醇H组显著高于C组、A组(P<0.05),而F组、E组、G组、D组、B组之间没有显著差异(P>0.05);直接低密度脂蛋白胆固醇G组、H组、D组显著高于F组、C组、E组、A组、B组,各处理组之间存在显著差异(P<0.05),而G组、H组、D组之间及F组、C组、E组、A组、B组之间差异不显著(P>0.05);血清总胆固醇/直接高密度脂蛋白胆固醇的比值中G组显著高于C组、B组、A组、H组、E组、D组、F组(P<0.05),C组、B组、A组、H组、E组、D组、F组之间没有显著差异(P>0.05)。
表3公貂血清生化指标的检测结果
Table3Testingresultsofserumparametersmaleminks

组别Groups项 目ItemsAlb(g/L)TC(mmol/L)TP(g/L)Glu(mmol/L)DHDL-C(mmol/L)DLDL-C(mmol/L)TC/DHDL-CA1475±025bc626±056Cb5118±518ab617±090 766±059b 292±022Cb 082±002bB1421±020Bc635±013Cb5110±496Aab620±052785±039278±042Cb083±003bC1448±069c663±034Cb5151±159615±101777±059b312±034BCb084±003bD1453±103c656±054Cb5298±404Bc581±132834±048444±110ABa079±006BbE1558±106ab683±041BCb5352±140bc691±147869±057292±032Cb079±002BbF1568±071Aa752±076ABa5756±488Aa589±064877±176336±036BCb078±009BbG1478±046bc786±068Aa5370±340640±073855±031526±126Aa093±006AaH1461±076c746±019ABa5393±189697±081901±138a487±154Aa082±011Bb
2.2.2母貂血清生化指标的检测结果由表4可以看出,母貂的血清白蛋白F组显著高于A组(P<0.01),B组、C组、D组之间差异不显著(P<0.05);血清总胆固醇各处理组之间存在极显著差异(P<0.01),依次为H组、F组、G组>D组>A组、B组。H组、F组、G组之间,E组、D组之间以及C组、A组、B组之间差异不显著(P>0.05);血清总蛋白G组、F组、D组、E组、H组、C组与A组、B组差异极显著(P<0.01),D组、E组、H组之间及A组、B组之间差异不显著(P>0.05);血清葡萄糖F组显著高于A组(P<0.05),D组、B组、G组、C组、H组之间差异不显著(P>0.05);直接高密度脂蛋白胆固醇各处理组之间存在极显著差异(P<0.01),依次为G组、H组、F组>C组、E组、D组、A组、B组。G组>F组>C组>A组、B组差异显著(P<0.05),H组与F组之间、G组与H组之间、C组、E组、D组之间及E组、D组、A组、B组之间差异不显著(P>0.05);直接低密度脂蛋白胆固醇(DLDL-C)指标中G组、H组显著高于E组、D组、A组、C组、F组、B组(P<0.05)。G组、H组之间及E组、D组、A组、C组、F组、B组之间差异不显著(P>0.05);血清总胆固醇/直接高密度脂蛋白胆固醇(TC/DHDL-C)的比值中各处理组之间差异显著(P<0.05),依次为E组>F组>G组。E组、D组、A组之间,A组、B组、F组之间,F组、C组、H组之间及C组、H组、G组之间差异不显著(P>0.05)。
表4母貂血清生化指标的检测结果
Table2Testingresultsofserumparametersfemaleminks

组别Groups项 目ItemsAlb(g/L)TC(mmol/L)TP(g/L)Glu(mmol/L)DHDL-C(mmol/L)DLDL-C(mmol/L)TC/DHDL-CA1481±077c656±058Dd4224±337b565±042c 697±057Bd 207±063Bb094±009ABCabcB1552±112B636±042Dd4616±049b639±065694±048Bd169±028Bb092±003ABCDbcdC1549±078679±093CDd5536±530b596±026bc825±173Bc179±017Bb084±013CDEdefD1537±104bc772±079BCc5901±607672±117787±046Bcd224±034b098±007ABabE1605±076Aab823±068ABbc5890±237698±096ab802±042Bcd224±056b102±005AaF1658±094Aa903±068Aa5978±255a728±152a1040±126Ab171±032Bb088±009BCDEcdeG1513±127bc882±082Aab6109±416631±0741156±116Aa291±082Aa077±004EfH1620±042ab910±034Aa5699±162584±165bc1119±108Aab290±050Aa082±007DEef
3 讨论
3.1 饲粮能量水平对育成期水貂体重的影响
试验组60日龄时体重相同,随着日龄的增加,体重差异越来越大;到105日龄时,G组水貂的生长强度显著大于其他各组,G组母貂体重高于A组150g,G组公貂的体重高于A组270g。能量过高造成动物的采食量过低,导致水貂从饲料中获得的其他营养物质不足,从而影响动物的生长性能。由此可以表明,能量在一定范围内可提高水貂体重,而超出此范围反而抑制了其生长。依照NRC(1982)[6],公貂成长所需的能量比母貂高33%,公貂成长所需代谢能为17.07MJ/kg DM,母貂为16.44MJ/kg DM。
3.2 饲粮能量水平对血清蛋白质代谢的影响
血清生化指标的变化是组织细胞通透性和机体新陈代谢机能发生改变的反应[7]。血清中总蛋白、白蛋白的含量变化在一定程度上反映了动物机体对日粮蛋白质吸收和代谢程度。血清中TP含量升高是蛋白质代谢旺盛的体现,有利于机体对蛋白质的吸收和利用,从而降低饲料消耗[8]。
本试验中各组TP公貂都略高于母貂,都随日粮能量水平的升高呈现先升高后降低的趋势。公貂在E组、F组没有显著差异(P>0.05),但F组(代谢能为15.5MJ/kg)达到最高;母貂G组、F组没有显著差异,但G组(代谢能为16.0MJ/kg)最高。血清Alb也是机体蛋白质的一个来源,它能够增加血容量和维持血浆胶体渗透压,同时有运输和解毒的作用,能促使组织蛋白和血浆蛋白之间的相互转化,是衡量肝脏功能和机体营养状况的重要指标[9]。周勤飞等[7](2010)对生长猪的研究结果显示,血清中TP、Alb指标随日粮消化能水平的升高呈现先升高后下降的趋势。本试验的研究结果与之一致,水貂饲喂不同能量水平的日粮后,血清Alb含量母貂各组都明显高于公貂,且均呈现先升高后降低的趋势,公貂、母貂均在日粮F组(代谢能为15.5MJ/kg)达到最高。
3.3 饲粮能量水平对血清血糖和血脂代谢的影响
血清中的Glu是动物机体内不可缺少的营养物质,不仅为动物大脑、神经系统、肌肉、脂肪组织等的代谢提供能源,而且还是合成脂肪代谢所需的还原性辅酶(NADPH)的重要物质[10]。Ligt等[11](2002)研究发现,处于生长期的猪饲喂含不同能量水平日粮后,血糖浓度随消化能水平提高而上升,而采食量下降。本试验母貂血糖水平随日粮代谢能水平的升高出现先升高后降低趋势,F组(代谢能为15.5MJ/kg)最高;公貂血糖没有显著差异(P>0.05),但H组(代谢能为16.5MJ/kg)最高。
血脂是指血浆或血清中的脂类物质,主要包括甘油三酯(TG)、胆固醇、磷脂(PL)和非酯化脂肪酸(NEFA)。血脂是机体赖以生存的重要基本物质,它在体内过多或过少将导致机体代谢的不平衡。血脂水平可以间接反映机体不同的生理或病理状态[12]。林映才等[13](2003)用不同代谢能水平的日粮饲喂育肥猪发现,血清TC随代谢能水平的升高呈上升趋势。Adam等[14](2008)用豆油饲喂小鼠也发现,血清TC随日粮胆固醇的增加而增加。本试验结果与上述结果一致,水貂血清TC随日粮代谢能升高而升高,且母貂明显高于同组公貂,其中母貂血清TC在代谢能为16.5MJ/kg时达到最高,而公貂则代谢能为16.0MJ/kg时最高。高密度脂蛋白(HDL-C)和低密度脂蛋白(LDL-C)是胆固醇的主要运输者,HDL-C通过胆固醇的逆向转运,并且把外周组织中衰老细胞膜上的胆固醇以及血浆中的胆固醇运回肝脏代谢,而LDL-C是向组织转运肝脏合成的内源性胆固醇[15]。本试验结果显示,HDL-C和LDL-C都随能量水平的升高呈上升趋势,血清HDL-C母貂G组、H组、F组之间没有显著差异(P>0.05),代谢能16.5MJ/kg为最高。公貂H组、F组、E组之间没有显著差异(P>0.05),代谢能16.0MJ/kg为最高;血清LDL-C母貂C组、F组、B组之间没有显著差异(P>0.05),代谢能13.5MJ/kg为最低,公貂E组、A组、B组之间差异不显著(P>0.05),代谢能13.5MJ/kg为最低。
4 结论
通过本研究的结果得出,随着日粮能量水平的提高,水貂血清中的TC、Glu、HDL-C、LDL-C含量也随着升高;血清中TP、Alb随饲喂日粮浓度的升高出现先升高后降低的结果。水貂可能在拐点处(F组,代谢能为15.5MJ/kg)蛋白质的消化吸收效果最好;育成期水貂体重随着能量水平的提高也呈现先升高后降低的结果,其中G组(16.0MJ/kg)最高。
通过以上的血清生化指标可推断,育成期日粮代谢能水平公貂不低于13.5MJ/kg、母貂不低于14.0MJ/kg能够满足水貂的基本能量需求。
[1]杨嘉实.特产经济动物饲料配方[M].北京:中国农业出版社,1999:54-55.
[2]张铁涛,张志强,高秀华,等.饲粮蛋白质水平对冬毛期水貂部分血清生化指标的影响[J].动物营养学报,2011,23(6):1052-1057.
[3]Zhang HH.,Li GY,Yang FH,et al.Effects of different dietary protein levels on growth performance,serum biochemical parameters and fur characteristics of minks in winter growing furring period[J].Chinese journal of animal nutrition,2011,23(1):78-85.
[4]宋兴超,魏海军,薛海龙,等.水貂12项血清生化指标的初步检测与分析[J].经济动物学报,2010,14(3):125-128.
[5]崔虎,张铁涛,高秀华,等.饲粮蛋白质水平对冬毛期蓝狐生长性能、营养物质消化代谢及血清生化指标的影响[J].动物营养学报,2011,23(12):2214-2224.
[6]NRC.Nutrient Requirements of Mink and Foxes[M].Washington:National Academy Press,1982.
[7]周勤飞,王永才,王金勇,等.能量水平对生长猪生产性能、养分消化率和血清生化指标的影响[J].中国畜牧杂志,2010,46(23):44-47.
[8]耿业业,张铁涛,高秀华,等.饲粮脂肪水平对育成期蓝狐生长性能、体质沉积及血清生化指标的影响[J].动物营养学报,2011,23(9):1637-1646.
[9]李晓丽,董淑丽,何万领,等.果寡糖对不同生长阶段固始鸡血液生化指标的影响[J].中国粮油学报,2010,25(4):43-55.
[10]肖宇,王利华,孙国强,等.外源寡糖对奶山羊血清生化指标和抗氧化指标的影响[J].动物营养学报,2012,24(2):342-348.
[11]Van de Ligt CPA,Lindemann MD,Cromwell GL.Assessment of chromium tripicolinate supplementation and dietary protein level on growth,carcass and blood criteria in growing pigs[J].J Anim Sci,2002,80:2412-2419.
[12]陈宗良.血脂、脂蛋白及载脂蛋白的基本概念[J].中国循环杂志,2009,24(4):315-316.
[13]林映才,蒋宗勇,余德谦,等.肥育猪消化能需要量研究[J].动物营养学报,2003,15(2):22-28.
[14]Adam SK,Das S,Soelaiman IN,et al.Consumption of repeatedly heated soy oil increases the serum parameters related to atherosclerosis in ovariectomized rats[J].Tohoku J Exp Med,2008,215:219-226.
[15]周顺伍.动物生物化学[M].第3版.北京:中国农业出版社,2000:144-146.

