自动电位滴定法和高效液相色谱法测定深颜色果蔬中维生素C浓度的比较
甘振威,武广恒,刘国良,张娅婕,徐 坤,谢 林,甘 露
(1.吉林大学公共卫生学院预防医学实验教学中心,吉林 长春 130021;2.吉林大学基础医学院生物化学与分子生物学实验中心,吉林 长春 130021)
维生素与人们健康的关系越来越密切,作为维生素之王的水溶性维生素C(Vc)又称抗坏血酸,对人体健康起着至关重要的生理作用[1-4],因此受到了人们的广泛关注;同时Vc可作为营养新资源、保健食品研发中一项重要的食品理化检测指标。而天然Vc广泛存在于蔬菜和水果中,尤其在花青素较多的深色果蔬中Vc含量极其丰富;Vc是一种含有6个碳原子的酸性多羟化合物[5],Vc的水溶液极易氧化,受热、光和碱性等条件影响而破坏。因此,有必要寻找到一种有效的检测方法,更好地解决深色果蔬中Vc浓度测定的问题。近年来文献[6-7]报道:Vc浓度测定方法主要有氧化还原滴定法、分光光度法、自动电位滴定法和高效液相色谱法(HPLC)等。常用的氧化还原滴定法方法简单,但在滴定深色物质时,终点不易判断;分光光度法操作费时;HPLC法灵敏度高,选择性好,发展前景较好;自动电位滴定法成本低,操作简单灵活,更适合少量样品的测定。因此,有必要寻找到一种有效的检测方法,更好解决深色果蔬中Vc浓度测定的问题。本文作者研究应用自动电位滴定法和HPLC法检测果蔬样品中Vc浓度的可行性和优缺点,为少量和批量果蔬中Vc的定量分析提供方法依据。
1 材料与方法
1.1 实验材料、试剂和主要仪器 长春市市内超市采购西红柿、红柿椒、紫甘蓝、紫茄子、红心萝卜、红薯、胡萝卜、油菜、苦瓜、菜花、韭菜、西兰花、菠菜、青椒和尖椒15种蔬菜及杨梅、樱桃、草莓、柑橘、芒果、柠檬、火龙果、紫葡萄、鲜枣、荔枝、西瓜、黄桃、猕猴桃、苹果及香蕉15种水果样品;实验用水为去离子水,Vc标准(GR天津市科密欧化学试剂有限公司),甲醇(Fisher-A4524),草酸(GR,北京化工厂),2,6-二氯酚靛酚(2,6-DCIP)等;自动电位滴定仪(ZD-2A型,上海大中分析仪器厂),高速分散均质机(FP-200,江苏金坛实验仪器厂),高效液相色谱仪(LC20AD,日本岛津公司),超声波清洗器(KQ-100E,上海京工实业有限公司),循环水式真空泵(SHZ-DⅢ,巩义市英峪仪器厂),色谱柱C18(250.0mm×4.6mm,5.0μm),电子天平(E12140)。
1.2 Vc标准溶液的制备 准确称取Vc 0.1000g,用0.1%草酸溶解并定容至100mL棕色容量瓶中,储备液浓度为1g·L-1,冷藏保存。工作溶液用0.1%草酸溶液稀释储备液至0.02g·L-1。
1.3 2,6-DCIP溶液的制备及标定 准确称取2,6-DCIP 0.1000g,溶于300mL含有105mg碳酸氢钠的沸水中,待溶液冷却后过滤、定容于500mL棕色容量瓶中,作为储备液(浓度为0.2g·L-1),冷藏保存。用水将储备液稀释成0.02g·L-1作为工作溶液,临用现配。准确量取Vc工作液20.00mL,置于50mL烧杯中,插入电极,用2,6-DCIP滴定。以消耗2,6-DCIP的体积为横坐标,电位变化率(△E/△V)为纵坐标作图,出现△E/△V峰值时,即为等当点(图1),计算出每毫升2,6-DCIP相当于Vc的毫克数(T)。
1.4 流动相的处理 配制0.1%草酸溶液2L,用孔径0.45μm微孔滤膜过滤,过滤液、甲醇溶液一并进行超声处理10min,待用。
1.5 HPLC标准曲线制备 分别取Vc储备液100、200、300、400和500μL,用0.1%草酸定容至10.0mL,使浓度分别为10、20、30、40和50mg·L-1(图2)。
1.6 HPLC检测条件 流动相:0.1%草酸90%,甲醇10%;流速:0.9mL·min-1;UV检测波长:254nm;柱温:30℃;进样量:5.0μL。
1.7 蔬菜和水果样品的制备 精确称取所测样品的可食部分100.00g,加入2~4倍0.1%草酸制成匀浆[8](匀浆过程在冰水浴中进行),经过滤或离心处理,取滤清液定量分成二等份,一份采用自动电位滴定法测试;另一份用HPLC法测试,全过程避光操作。
1.8 样品中Vc浓度测定 准确量取一等份滤清液20.00mL于小烧杯中,采用自动电位滴定法测定,当△E/△V最大时,即为滴定终点,记录2,6-DCIP滴定用量,乘以T值,计算所测样品Vc的毫克数,再折算出每百克样品可食部分的量,以mg/100g表示。Vc=(V1-V2)×T/W×100,式中V1和V2为滴定样品及空白所用2,6-DCIP毫升数;W为滴定时所用样品稀释液中含样品的克数。用HPLC法测定另外一份样品,将滤清液通过0.45μm一次性滤器过滤到小试剂瓶中,取5.0μL样品进行测定(浓度高的样品稀释后进样)。计算所测样品液的Vc浓度(mg·L-1),换算为每百克样品可食部分的含量,以mg/100g表示。
1.9 准确度和精密度实验 用标准样加入法进行Vc回收实验[9],计算其回收率。分别用5次平行实验测定红柿椒样品中Vc浓度,计算平行测定的均值、标准偏差及相对标准偏差(RSD)。
1.10 统计学分析 采用SPSS 14.0软件进行统计分析。30种蔬菜、水果中的Vc浓度以表示,组间样品均数比较采用配对t检验。
2 结 果
2.1 自动电位滴定法和HPLC法测定15种蔬菜和15种水果Vc浓度 浅色或无色果蔬样品Vc浓度比较差异无统计学意义(P>0.05);在含有花青素或胡萝卜素较多的深颜色样品中,Vc浓度比较差异也未见统计学意义(P>0.05)。说明自动电位滴定法测定深颜色样品与HPLC法无区别,均能克服样品颜色对结果的影响。见表1。
表1 30种果蔬中Vc浓度Tab.1 Concentrations of Vc in 30kinds of fruits and vegetables[,wB/(mg·100g-1)]
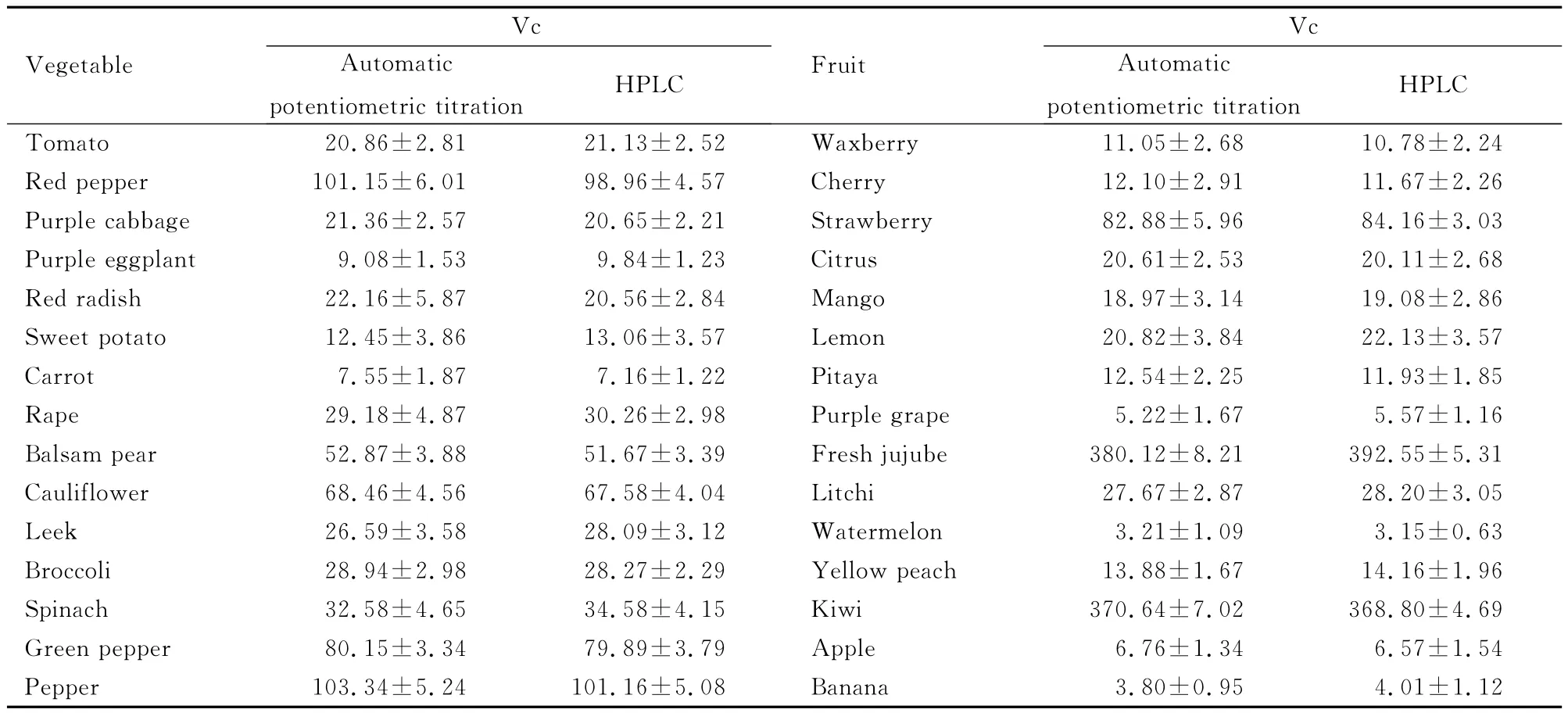
表1 30种果蔬中Vc浓度Tab.1 Concentrations of Vc in 30kinds of fruits and vegetables[,wB/(mg·100g-1)]
11.05±2.6810.78±2.24 Red pepper 101.15±6.0198.96±4.57Cherry 12.10±2.9111.67±2.26 Purple cabbage 21.36±2.5720.65±2.21Strawberry 82.88±5.9684.16±3.03 Purple eggplant 9.08±1.539.84±1.23Citrus 20.61±2.5320.11±2.68 Red radish 22.16±5.8720.56±2.84Mango 18.97±3.1419.08±2.86 Sweet potato 12.45±3.8613.06±3.57Lemon 20.82±3.8422.13±3.57 Carrot 7.55±1.877.16±1.22Pitaya 12.54±2.2511.93±1.85 Rape 29.18±4.8730.26±2.98Purple grape 5.22±1.675.57±1.16 Balsam pear 52.87±3.8851.67±3.39Fresh jujube 380.12±8.21392.55±5.31 Cauliflower 68.46±4.5667.58±4.04Litchi 27.67±2.8728.20±3.05 Leek 26.59±3.5828.09±3.12Watermelon 3.21±1.093.15±0.63 Broccoli 28.94±2.9828.27±2.29Yellow peach 13.88±1.6714.16±1.96 Spinach 32.58±4.6534.58±4.15Kiwi 370.64±7.02368.80±4.69 Green pepper 80.15±3.3479.89±3.79Apple 6.76±1.346.57±1.54 Pepper 103.34±5.24101.16±5.08Banana 3.80±0.95 HPLC Tomato 20.86±2.8121.13±2.52Waxberry Vegetable Vc Automatic potentiometric titration HPLCFruit Vc Automatic potentiometric titration 4.01±1.12
2.2 红柿椒样品的准确度和精密度测定实验 通过红柿椒样品的加标法进行Vc的回收率实验,计算回收率、平均回收率和RSD。自动电位滴定法的回收率为98.34%~103.98%,平均回收率为101.16%,RSD为1.77%~2.88%;HPLC法的回收率为99.66%~101.49%,平均回收率为100.57%,RSD为0.15%~0.32%。见表2和3。
3 讨 论
在测定蔬菜、水果中Vc浓度时,常采用氧化还原滴定法(粉红色为滴定终点)[10],虽然此方法便捷,但也存在样品的颜色对测试结果造成偏差的弊端[11]。现今的农贸市场蔬菜、水果种类繁多,带有颜色的食物随处可见,而深颜色的果蔬中Vc浓度较高,为便于及时了解其营养情况,给人们的健康饮食提供参考数据,找到更合理的测试方法[12]是本实验研究的目的所在。用自动电位滴定法进行标准Vc浓度的标定时,当滴定溶液2,6-DCIP逐渐增加时,标准Vc溶液中对应离子浓度发生改变,从而引起测量电极电位的变化,当电极的变化率(△E/△V)达到最大时,即为等当点[13],随着2,6-DCIP逐渐增加,△E/△V反而趋于减少。测试样品时,设定等当点电位值为e0,电极电位变化的信号经仪器调制放大电路处理后,送回取样回路,通过e-t转换器控制滴定液流量,当电极信号e与设定终点信号e0相同时,样品滴定结束。实验排除了指示剂的使用,减少了利用颜色判断终点的人为因素,也无需考虑样品溶液的浑浊度对数据的影响,因而提高了测试的准确度和精确度,其回收率为98.34%~103.98%,RSD为1.77%~2.88%,说明此方法具有较高的灵敏度和准确度。

表2 红柿椒的加标回收率Tab.2 Recovery rate of red pepper

表3 红柿椒的精密度实验结果Tab.3 Results of precision test of red pepper
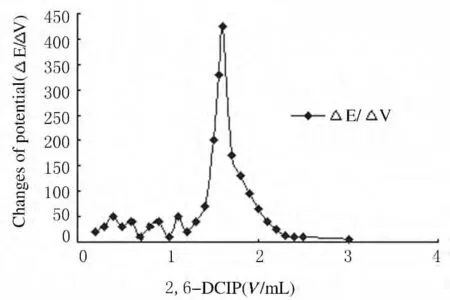
图1 自动电位滴定法测定等当点曲线图Fig.1 Equivalent point curve detected by automatic potentiometric titration

图2 HPLC法测定Vc标准曲线图Fig.2 Vc standard curve detected by HPLC method
本研究中采用自动电位滴定法和HPLC法对果蔬样品的Vc浓度进行测定,所得2组数据差异无统计学意义;HPLC标准曲线R2=0.9999,平均回收率为100.57%,RSD为0.15%~0.32%,说明了方法的准确性和可靠性,样品中的颜色不再影响测试结果。回收率及精密度实验结果显示:2种方法均避开了颜色判断终点所造成的偏差,且均有很好的特异性。自动电位滴定法操作简便[14],对单个样品的测试更具灵活性,成本较低,适合于学生的教学实验,能够提高操作者的动手能力;HPLC法是目前较理想的检验方法,检测更快速、有效,且样品一般不需要衍生过程[15],但因测试前仪器需要较长时间的稳定,测试条件要求较高,相对成本较大,更适合于多样品同时检测。
[1]赵昕梅,远凌威,陈世峰,等.高效液相色谱法测定果蔬中维生素C含量[J].信阳师范学院学报:自然科学版,2013,26(1):49-53.
[2]刘淑霞,陈玉娟,李 琳,等.葛根保肝茶对醋氨酚致小鼠急性肝损伤的保护作用[J].吉林大学学报:医学版,2013,39(1):25-28.
[3]包 宇,杨建雄,孙润广.淫羊藿苷与淫羊藿次苷Ⅱ的体外抗氧化作用[J].吉林大学学报:医学版,2012,38(3):423-428.
[4]朱屋彪,侯 勇,陈健萍.比较不同方法测定蔬菜中维生素C含量[J].广东化工,2013,40(8):148-150.
[5]吴 坤.营养与食品卫生学[M].北京:人民卫生出版社,2007:98-100.
[6]王艳颖,姜国斌,胡文忠,等.高效液相色谱法测定草莓中维生素C含量[J].大连大学学报,2006,27(2):21-26.
[7]李会静,张建利,王 亮.高效液相色谱法测定猕猴桃中维生素C的含量[J].煤炭与化工,2013,36(4):140-141.
[8]王乐乐,安华明.HPLC测定刺梨果实中维生素C含量方法的优化[J].现代食品科技,2013,29(2):397-400.
[9]伍云卿,涂杰峰,范 超,等.加标回收实验方案探讨[J].福建分析测试,2010,19(3):67-71.
[10]孙 义.水果和蔬菜中维生素C含量的测定方法综述[J].天津化工,2008,22(3):58-59.
[11]陈秋丽,甘振威,张娅婕,等.电位滴定法测定深色蔬菜和水果中的维生素C[J].吉林大学学报:医学版,2004,30(5):821-822.
[12]朱 佳,孙 杰.高效液相色谱测定维生素C方法的研究进展[J].食品研究与开发,2012,33(5):229-231.
[13]董月菊,梁美霞,戴洪义.利用自用电位滴定法测定果汁中维生素C含量[J].果树学报,2010,27(6):1042-1045.
[14]BaöB,Jakubowska M,Górski K.Application of renewable silver amalgam annular band electrode to voltammetric determination of vitamins C,B1and B2[J].Talanta,2011,84(4):1032-1037.
[15]Franco V,Maria E,Maria S,et al.Optimization and validation of a UV-HPLC method for vitamin C determination in strawberries(Fragaria ananassa Duch),using experimental designs[J].Food Anal Methods,2012,5(5):1097-1104.

