肺结核合并鲍曼不动杆菌感染的临床特点及对常用抗生素的耐药性分析
杨燕 胡华 陈影 王俊玲 朱晓雅 董娇 范恒建
鲍曼不动杆菌(Ab)是不动杆菌属中最常见的引起呼吸道感染的条件致病菌,近年来的临床分离率和感染致病率逐年增高。鲍曼不动杆菌是一种革兰阴性非发酵菌,广泛存在于医院环境、正常人皮肤表面等自然环境,当机体抵抗力下降、免疫功能低下时可成为优势菌引起机体感染。鲍曼不动杆菌曾对某些青霉素类、头孢菌素类、氨基糖苷类、氟喹诺酮类等抗菌药敏感,但随着广谱抗生素和免疫抑制剂的广泛使用,出现了多重耐药(MDR-Ab)或泛耐药(PDR-Ab)。专科医院中部分肺结核患者因病程长、反复入院,肺结构破坏、细胞免疫功能低下及长期应用抗生素等易并发下呼吸道感染。本研究分析了肺结核患者合并鲍曼不动杆菌感染的临床特点及耐药性,为专科医院临床合理用药和控制医院内感染提供客观依据。
材料和方法
一、材料来源
1. 来源患者一般资料:2009年1月至2012年12月我院肺结核合并下呼吸道鲍曼不动杆菌感染患者129例。男84 例,女45例,年龄范围15~93岁,中位年龄55岁。结核病诊断标准经胸部X线片或CT与痰涂片阳性鉴定等方法确诊[1];Ab感染诊断标准参照中华医学会呼吸病学分会《医院获得性肺炎诊断和治疗指南(草案)》[2]。
2.相关试剂和仪器:血琼脂、巧克力琼脂和麦康凯琼脂培养基(均为济南百博公司生产);VITEK-32全自动微生物分析系统(法国生物梅里埃公司)。
二、研究方法
1.标本采集与处理:(1)留痰标准:清醒患者,晨起清洁口腔后深咳,尽量留取第一口痰或经纤维支气管镜保护性气管毛刷检;意识障碍患者,清洁鼻腔用无菌吸痰管留痰;气管切开者采用深部无菌吸痰法留取。同一患者1周内的相同标本视为重复分离菌株,不做重复统计。
2. 细菌分离、鉴定及药敏试验:符合留痰标准的患者采集标本立即送检。严格按照《全国临床检验操作规程》[3]及仪器的使用程序完成细菌的分离、培养、鉴定和药敏试验。鉴定药敏判断标准采用美国临床与实验室标准化研究所推荐的标准判定药敏结果;同一患者不同时期培养获得的相同菌株只统计第一次所分离菌株的药敏结果。
3.数据的整理和分析:药敏结果按抑菌圈直径大小作为判定敏感度高低的标准,分为耐药、中介和敏感。数据采用世界卫生组织细菌耐药性监测软件WHONET5.6软件进行分析。
三、相关定义
PDR-Ab指包括对头孢吡肟、头孢他啶、亚胺培南、美罗培南、哌拉西林/三唑巴坦、环丙沙星、左氧氟沙星等抗生素均耐药[4-5]。
结 果
1.临床特点:2009年1月至2012年12月我院确诊为肺结核合并下呼吸道感染,并经呼吸道分泌物培养分离出鲍曼不动杆菌住院患者129例,2009年18例,2010年29例,2011年33例,2012年49例。合并慢性阻塞性肺疾病(COPD)41例、支气管扩张8例、间质性肺炎或肺间质纤维化11例、糖尿病26例。1年内反复住院≥2次且每次住院大于30 d 59例,连续应用激素>3周52例,抗结核治疗前应用广谱抗生素如青霉素、左氧氟沙星、头孢类抗生素等109例。胸部CT新出现的大片状阴影89例、空洞27例等。主要临床症状和体征见表1。
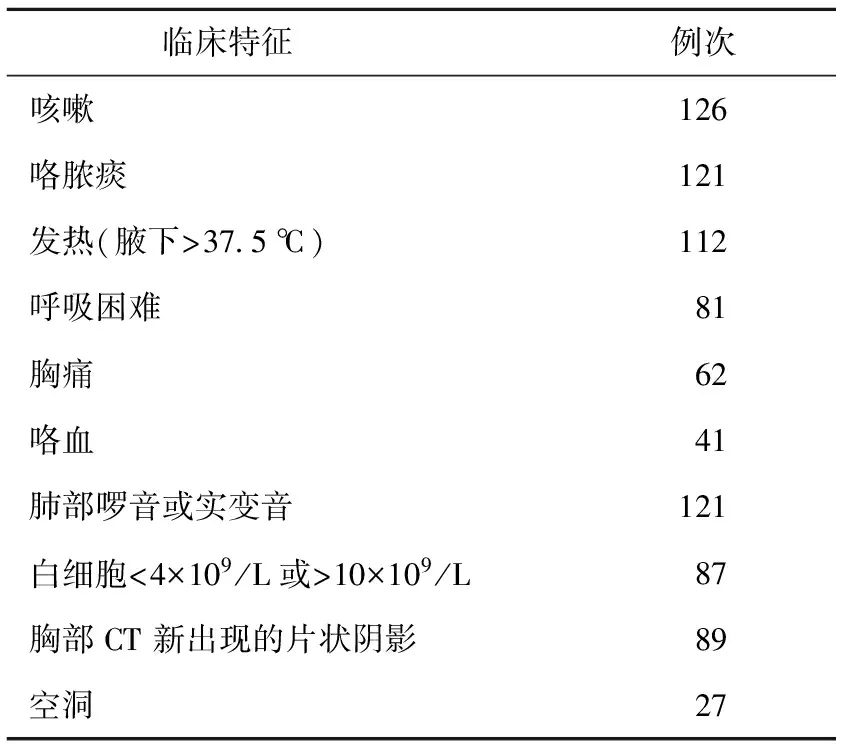
表1 129例肺结核合并Ab感染患者的主要临床特征
2. 不同年份鲍曼不动杆菌临床分离株检出情况:2009年1月至2012年12月我院临床共分离出138株鲍曼不动杆菌呼吸道病原菌(不计重复菌株),2009年25株(18.1%),2010年32株(23.2%),2011年39株(28.3%),2012年42株(30.4%)。其中经痰标本培养检测107例(77.5%)、支气管镜下保护毛刷刷检标本培养27例(19.6%)、气管插管吸痰标本培养4例(2.8%)。
3. 鲍曼不动杆菌对常用抗生素的药敏及耐药情况:鲍曼不动杆菌对头孢他啶、哌拉西林、头孢噻肟、头孢曲松耐药情况最为严重,其次为哌拉西林-他唑巴坦、环丙沙星、左氧氟沙星等,对亚胺培南、头孢吡肟、头孢哌酮-舒巴坦、米诺环素保持较好活性,具体见表2。
而且鲍曼不动杆菌对抗生素的耐药幅度上升最快的为头孢哌酮-舒巴坦和亚胺培南,至2012年分别为50.0%(21/42)、45.2%(19/42),具体见表3。泛耐药菌株共10株(7.2%,10/138)。
讨 论
一、肺结核合并鲍曼不动杆菌感染检出逐年增多
鲍曼不动杆菌是引起院内呼吸道机会性感染的重要病原菌[6]。近年来肺结核患者常常先在基层、综合性医院就诊,经过多次诊断性治疗、反复住院以及广谱抗生素应用无效才转诊到专科医院。患者多是慢性消耗、营养低下、免疫力低下、肺实质结构破坏,且由于治疗疗程长、治疗效果差、住院周期长或反复住院,加之广谱抗生素的应用及侵袭性操作等更易合并下呼吸道机会性感染。肺结核患者使用左氧氟沙星、利福平、链霉素或阿米卡星及含棒酸类抗生素等药物进行抗结核治疗,这些药物本身就是广谱抗生素,这些药物的长期、联合使用可能引起菌群紊乱导致机会性感染。
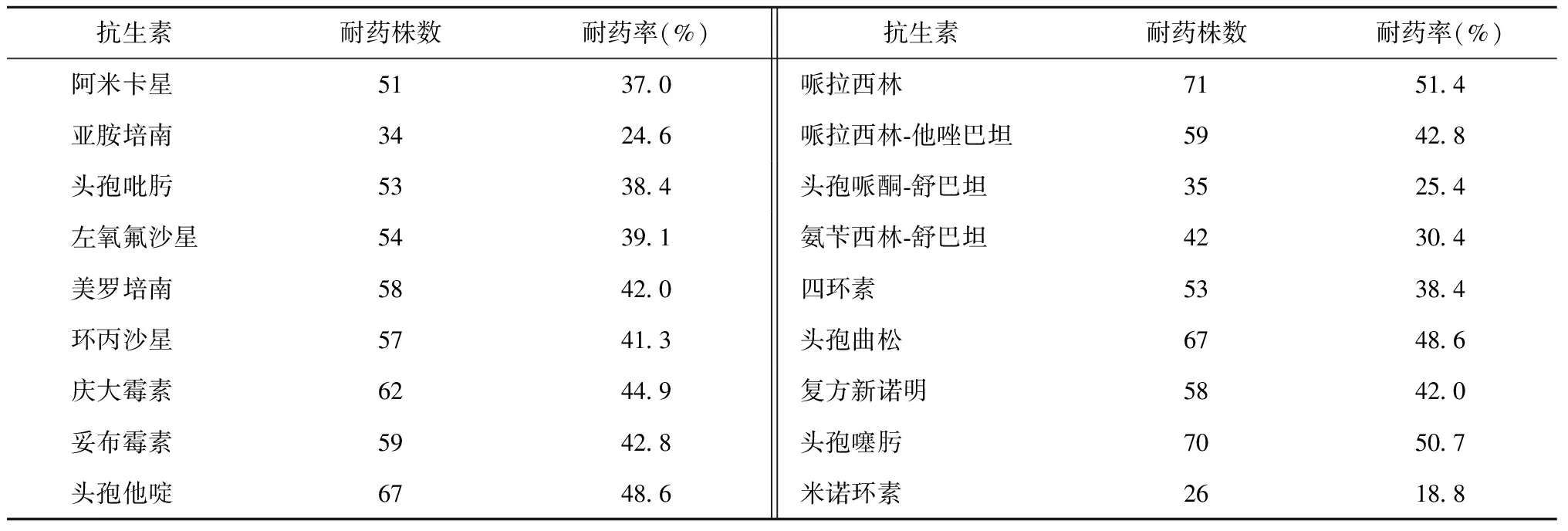
表2 138株鲍曼不动杆菌临床分离株对常用抗生素的耐药情况
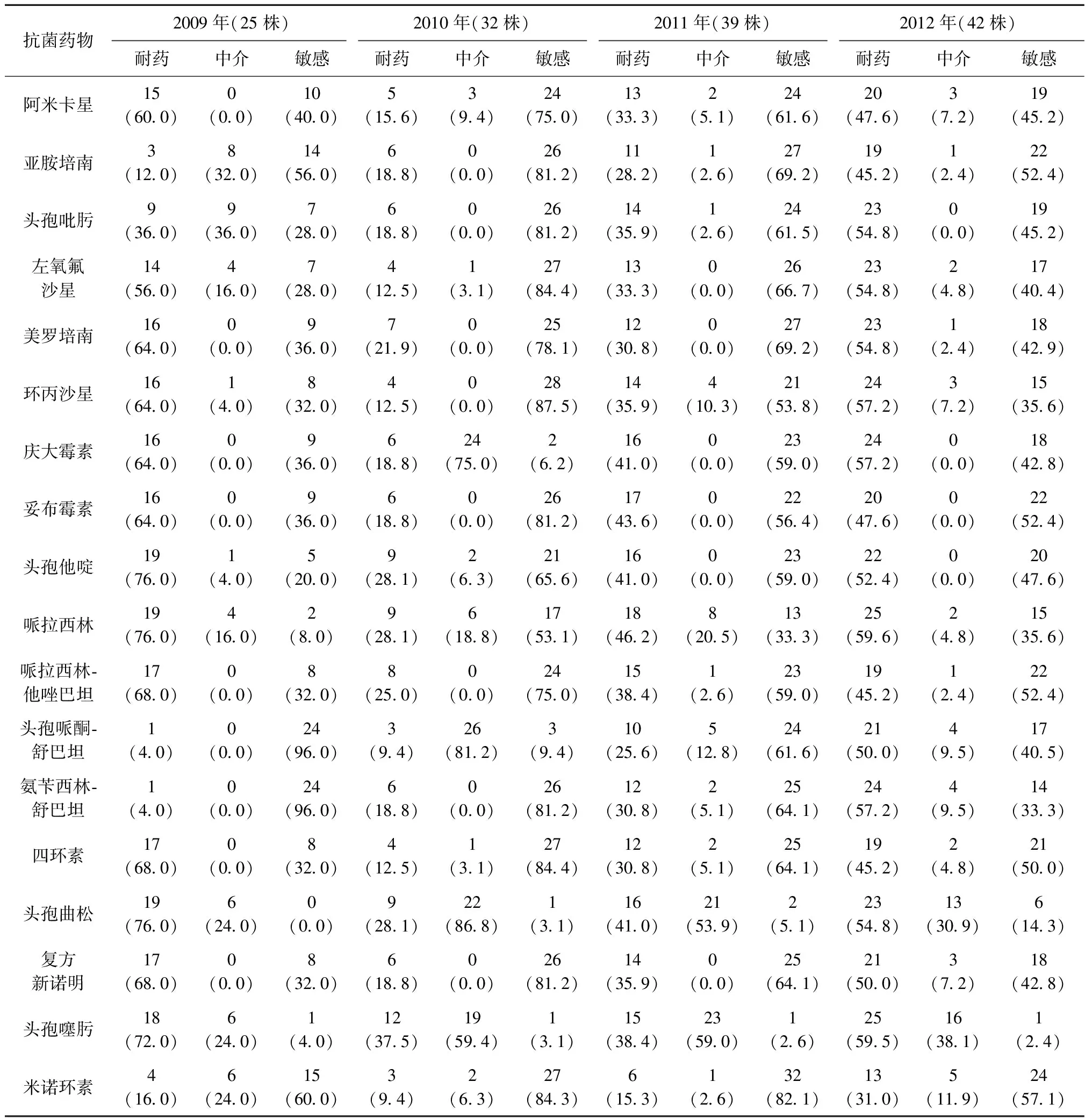
表3 不同抗菌药物2009—2012年鲍曼不动杆菌药敏检测结果
肺结核合并鲍曼不动杆菌感染的患者常合并其他肺部基础疾病[4],此次研究发现其中COPD 41例、间质性肺炎或肺间质纤维化11例、支气管扩张8例。而且1年内反复住院≥2次且每次住院>30 d的59例,连续应用激素>3周的52例,109例有应用广谱抗生素史。因此对于经正规抗结核治疗无效或病情突然加重的肺结核患者要密切注意,而对于经确诊无抗结核药物耐药性的患者,要警惕医院获得性肺炎。肺结核合并获得性肺炎的重要原因可能与条件致病菌引起的内源性感染和细菌从外界植入引起的外源性感染有关[7]。另有研究表明,鲍曼不动杆菌烟酰胺酶会影响一线抗结核药物吡嗪酰胺的活化[8]。因此,有肺结核隔离病房的专科医院更应加强对呼吸系统感染的控制和预防,严格执行无菌技术操作和各项消毒隔离制度,加强基础护理及手卫生,合理应用抗生素,从而有效降低院内感染的发生率。
二、专科医院鲍曼不动杆菌在临床分离感染菌中的分离率呈增加趋势,且多重耐药菌株迅速增加[5]
我院肺结核合并下呼吸道机会性感染者中经呼吸道标本分离出鲍曼不动杆菌的患者例数逐年增多,对药敏结果进行回顾性分析发现在2009年头孢哌酮-舒巴坦的敏感率最高96.0%,其次米诺环素60.0%、亚胺培南56.0%,而阿米卡星、左氧氟沙星、美罗培南、环丙沙星、庆大霉素、妥布霉素、头孢他啶、哌拉西林、哌拉西林-他唑巴坦、四环素、头孢曲松、复方新诺明、头孢噻肟耐药率在50%以上。而到2012年头孢哌酮-舒巴坦、亚胺培南的敏感率分别下降到40.5%、52.4%,而耐药率上升到50.0%、45.2%。头孢吡肟、左氧氟沙星、美罗培南、环丙沙星、庆大霉素、头孢他啶、头孢曲松、哌拉西林、头孢噻肟耐药率仍在50%以上。这与国内外许多地区都出现敏感性下降、耐药性逐渐增高的结果一致[9-10]。与2012年国内13家教学医院呼吸科及呼吸科重症监护病房、呼吸科监护病房鲍曼不动杆菌亚胺培南耐药率(76.8%)低[11]。分析与目前综合医院临床应用亚胺培南于抗鲍曼不动杆菌感染治疗带来的耐药率越来越高[12],而专科医院结核病房部分为负压层流病房以及临床应用碳青霉烯类抗生素较少有关。阿米卡星、庆大霉素耐药率高但上升较慢与该类药物目前仍适用于耐药结核的治疗以及因不可逆的不良反应较重,近年临床应用减少有关。
目前鲍曼不动杆菌对抗生素产生耐药的速度非常快,且多为多重耐药、泛耐药菌株,常常失去时机导致临床治疗失败[13]。国外虽然已有报道通过蛋白组学快速诊断野生型与耐药鲍曼不动杆菌[14],但目前临床感染鲍曼不动杆菌的病死率仍然极高[12]。其耐药机制主要是产生碳青霉烯酶 OXA-23酶以及外膜蛋白和青霉素结合蛋白的改变以及主动外排有关[15-16]。此次研究也分离出鲍曼不动杆菌泛耐药株10株(7.2%)。但本研究也提示米诺环素一直保持有较好的敏感性,可考虑作为临床治疗严重多重耐药的最后选择[13]。因此对于结核病合并鲍曼不动杆菌感染使用抗生素更需严格规范,尽量在药敏结果指导下用药,减少经验用药,防止耐药率快速上升而造成严重后果[17]。
总之,在肺结核合并鲍曼不动杆菌感染患者对常用抗菌药物的耐药率均较高,多重耐药现象严峻。对于老年、免疫力低下、肺实质结构破坏、长期应用抗结核药物、长期反复住院、长期应用抗生素的这些患者,需要注意有无合并鲍曼不动杆菌感染的可能。因此,连续、动态、规范地监测医院感染病原菌的药敏谱,掌握病原菌的流行病学及抗生素耐药特性,进而有效避免鲍曼不动杆菌在结核专科医院流行和传播。
[1]中华人民共和国卫生部疾病预防控制局,中华人民共和国卫生部医政司,中国疾病预防控制中心.中国结核病防治规划实施工作指南(2008年版).北京:中国协和医科大学出版社,2008.
[2]中华医学会呼吸病学分会.医院获得性肺炎诊断和治疗指南(草案). 中华结核和呼吸杂志,1999,22(4):201-203.
[3]中华人民共和国卫生部医政司.全国临床检验操作规程. 南京:东南大学出版社,2006.
[4]Cisneros JM, Rodríguez-Bao J.Nosocomial bacteremia due to Acine-tobacter baumannii: epidemiology, clinical features and treatment.Clin Microbiol Infect,2002,11(8):687.
[5]Klugman KP.Clinical impact of antibiotic resistance in respiratory tract infections.Int J Antimicrob Agents,2007,29(Suppl 1):S6-10.
[6]Yamada K, Yanagihara K, Araki N, et al. Clinical characte-ristics of tertiary hospital patients from whom Acinetobacter calcoaceticus-Acinetobacter baumannii complex strains were isolated. Intern Med,2012,51(1):51-57.
[7]Khan MA, Mahomed MF, Ashshi AM, et al. Drug resistance patterns of Acinetobacter baumannii in Makkah, Saudi Arabia. Pakistan.J Med Res,2012,51(4):127-131.
[8]Fyfe PK, Rao VA, Zemla A,et al. Specificity and mechanism of Acinetobacter baumanii nicotinamidase; implications for activation of the front-line TB drug pyrazinamide. Angew Chem Int Ed Engl,2009,48(48): 9176-9179.
[9]Tsai HT,Wang JT,Chen CJ,et al. Association between antibio-tic usage and subsequent colonization or infection of extensive drug-rsisitant Acinetobacter baumanii;a matched case-control study in intensive care units. Diagn Microbiol Infect Dis,2008,62(3):298-305.
[10]Klugman KP. Clinical impact of antibiotic resistance in respiratory tract infections. Int J Antimicrob Agents,2007,37(1):S6-10.
[11]刘又宁,曹彬,王辉,等.中国九城市成人医院获得性肺炎微生物学与临床特点调查. 中华结核和呼吸杂志,2012, 35(10):739-746.
[12]Giamarellou H,Poulakou G.Multidrug-resistant Gram-negative infections:what are the treatment options. Drugs,2009,69(14):1879-1901.
[13]Jiménez-Mejías ME, Pichardo-Guerrero C, Márquez-Rivas FJ,et al.Cerebrospinal fluid penetration and pharmacokinetic/pharmacodynamic parameters of intravenously administered colistin in a case of multidrug-resistant Acinetobacter baumannii meningitis.Eur J Clin Mierebiol Infect Dis,2002,21(3):212-214.
[14]Chang CJ, Lin JH, Chang KC, et al. Diagnosis of β-lactam resistance in Acinetobacter baumannii using shotgun proteomics and LC-nano-electrospray ionization ion trap mass spectrometry. Anal Chem,2013,85(5):2802-2808.
[15]Zarrilli R,Giannouli M,Tomasone F,et al.Carbapenem resis-tance in Acinetobacter baumannii: the molecular epidemic features of an emerging problem in health care facilities.J Infect Dev Ctries,2009,3(5):335-341.
[16]Kouyama Y, Harada S, Ishii Y, et al.Molecular characterization of carbapenem-non-susceptible Acinetobacter spp. in Japan: predominance of multidrug-resistant Acinetobacter baumannii clonal complex 92 and IMP-type metallo-β-lactamase-producing non-baumannii Acinetobacter species. J Infect Chemother,2012,18 (4):522-528.
[17]Yuan Z,Tam VH.Polymyxin B:a new strategy for multidrug-resistant Gram-negative organisms. Expert Opin Investig Drugs,2008,17(5):661-668.

