分子印迹基质固相分散快速分离分析辣椒制品中的苏丹红
, ,,,立钢
(东北林业大学理学院,黑龙江哈尔滨 150040)
苏丹红是一种非天然的化学染色剂,是人工合成的含有萘环结构的化合物,同时含有偶氮结构。由于其色彩鲜泽,常用于工业染料方面。苏丹红被国际癌症研究机构归类为三类致癌物质即动物致癌物,对人类也有潜在的危害。而且毒理学相关研究表明,苏丹红Ⅰ,Ⅱ,Ⅲ,Ⅳ有致突变性和致癌性,美国欧盟等都已明文规定禁止将苏丹红添加到食品中,近年来我国也禁止将它使用在相关食品添加剂中[1 - 3]。目前常用HPLC、GC/MS、LC/MS、GPC/LC、极谱法、ELISA等方法对食品中的苏丹红进行检测。传统的实验方法,检测灵敏度差,耗时长。本实验是采用分子印迹技术(MIT)和基质固相分散萃取(MSPD)联用的一种新型检测苏丹红的方法。分子印迹技术目前是比较成熟的一门科学技术,始于生物化学,材料科学等学科,在色谱分离,固相萃取,食品检验和环境监测等都有十分广泛的应用[4 - 6]。制备得到的分子印迹聚合物(MIP)拥有预定性,特异识别性和广泛使用性三个特点。在已有的报道中,苏丹红 - 分子印迹聚合物已经被成功制备出来,并且作为固相萃取的吸附剂萃取分离辣椒等样品中的苏丹红[7 - 9]。然而,在制备过程中,大多采用的是本体聚合技术,得到的聚合物,模板分子包埋过深,不利于洗脱和再结合。并且,在应用之前,需采用一定的溶剂将苏丹红从固体样品中提取出来,然后再进一步进行固相萃取净化处理,步骤繁琐。本实验采用表面印迹技术,以纳米SiO2为载体,苏丹红IV为模版分子,甲基丙烯酸为功能单体,二甲基丙烯酸乙二醇酯为交联剂制备分子印迹聚合物。表面印迹技术可以很好的解决传统的本体聚合带来的模板分子包埋过深等问题。所得分子印迹物作为基质固相萃取中的吸附剂萃取辣椒制品中的苏丹红。基质固相分散技术具有快速简便,集萃取、净化、浓缩于一体,而且样品和提取溶剂用量少,环境污染少等优点[10]。
1 材料与方法
1. 1 材料与仪器
二甲基丙烯酸乙二醇酯 美国Sigma - Aldrich;苏丹红Ⅰ,Ⅱ,Ⅲ,Ⅳ标准品、硅烷偶联剂KH570 上海阿拉丁;偶氮二异丁腈、甲醇、乙醇甲基丙烯酸、乙酸、98%浓硫酸 天津科密欧;乙腈 色谱纯,美国Fisher;纳米SiO2宣城晶瑞;实验用水为去离子水。实验中所用到的辣椒面和辣椒酱样品均购买于哈尔滨当地的农贸市场。
H7650电子显微镜 日本日立公司;LC - 15C液相色谱 日本岛津公司;HSY - B 恒温振荡摇床 金坛市精达仪器制造厂;FT - IR360傅立叶红外光谱仪 美国Nicolet公司;DZKW - C恒温水浴锅 上海树立公司。
1. 2 标准溶液的制备
在100mL甲醇中分别溶解5. 0mg苏丹红Ⅰ,Ⅱ,Ⅲ,Ⅳ配制得到50μg/mL标准溶液,保存在冰箱中。
1. 3 分子印迹聚合物的制备
将KH570在纯甲苯(25mL),蒸馏水(8mL)和98%浓硫酸(6. 5mL)中65℃水解4h,分液漏斗去水层,再加入纳米SiO2(1. 0g),98%浓硫酸(2mL)在油浴中114℃条件下反应4h。纯甲醇洗涤离心干燥10h制得SiO2- KH570。取模板分子苏丹红Ⅳ(1mmol)加入功能单体甲基丙烯酸(4mmol)和氯仿(20mL)的混合液中搅拌1h。再加入交联剂二甲基丙烯酸乙二醇酯(20mmol)和引发剂偶氮二异丁腈(0. 06g),SiO2- KH570(1. 0g)在磁力搅拌300r/min水浴60℃下反应24h。合成后的产物用纯甲醇洗涤离心多次后,置于60℃烘箱中干燥。以20%乙酸甲醇为溶剂对产物进行索氏提取至无色,最后真空干燥,即得到分子印迹聚合物MIP。而非分子印迹聚合物NIP与MIP制备方法一样,只是不加入模板分子苏丹红Ⅳ。
1. 4 MIP和NIP吸附等温线的测定
分别在2. 0mL不同浓度的苏丹红IV溶液中加入MIP和NIP 20. 0mg,恒温震荡24h,离心后用HPLC检测苏丹红IV的剩余浓度。
1. 5 MIP和NIP的动力学考察
称取MIP和NIP各20. 0mg与2. 0mL苏丹红Ⅳ标准溶液振荡1、3、4、5、7、9min,离心后用HPLC检测苏丹红Ⅳ的剩余浓度。
1. 6 基质固相分散萃取分离辣椒制品中苏丹红
称取辣椒面0. 05g,分子印迹聚合物0. 05g,在研钵中混合研磨8min。转移到空的注射器中,用4mL 5%的乙酸乙醇进行洗脱,用HPLC检测洗脱液中苏丹红的含量。
实验中优化了影响萃取苏丹红的各种因素,采用的是单因变量法,即在固定其它条件下,改变某一条件,研究其对萃取效果的影响。以四种苏丹红的回收率为考量指标,能够得到最佳苏丹红回收率的条件即为最优条件。考察的萃取条件包括MIP与辣椒面比例(1/2,1/1,3/2,2/1,5/2,3/1),研磨时间(2、4、6、8、10min),洗脱剂种类(纯甲醇、1%乙酸甲醇、5%乙酸甲醇、纯乙醇、1%乙酸乙醇、5%乙酸乙醇)和洗脱体积(1、2、3、4、5、6、7mL)。
1. 7 液相色谱分析
安捷伦SB - C18色谱柱(150mm × 4. 6mm,5μm);进样量20μL;流动相为纯乙腈;流速1. 0mL/min;检测波长505nm。
2 结果与分析
2. 1 分析印迹聚合物的表征
分子印迹聚合物的电镜图如图1所示,径粒分布大小均匀,大约为40 ~ 50nm。分子印迹聚合物和二氧化硅的红外光谱图如图2所示。对于分子印迹聚合物,3435cm-1处为O - H的伸缩振动吸收峰;2956cm-1处为C - H的伸缩振动吸收峰;1731cm-1处为C=O伸缩振动吸收峰;1456cm-1和1386cm-1处为C - H弯曲振动吸收峰;1155cm-1处为Si - O振动吸收峰。对于二氧化硅,3418cm-1处为O - H的伸缩振动吸收峰;1132cm-1处为Si - O振动吸收峰。
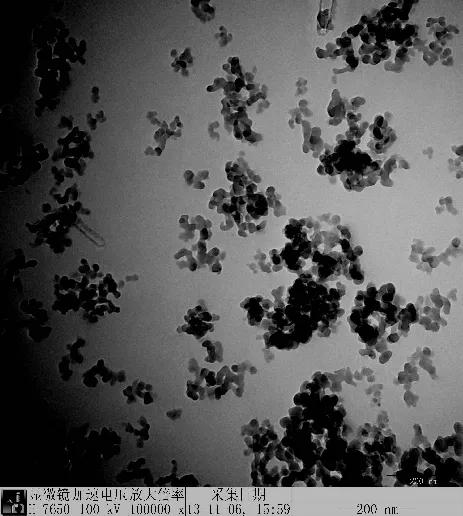
图1 分子印迹聚合物的透射电镜图Fig. 1 The TEM image of MIP
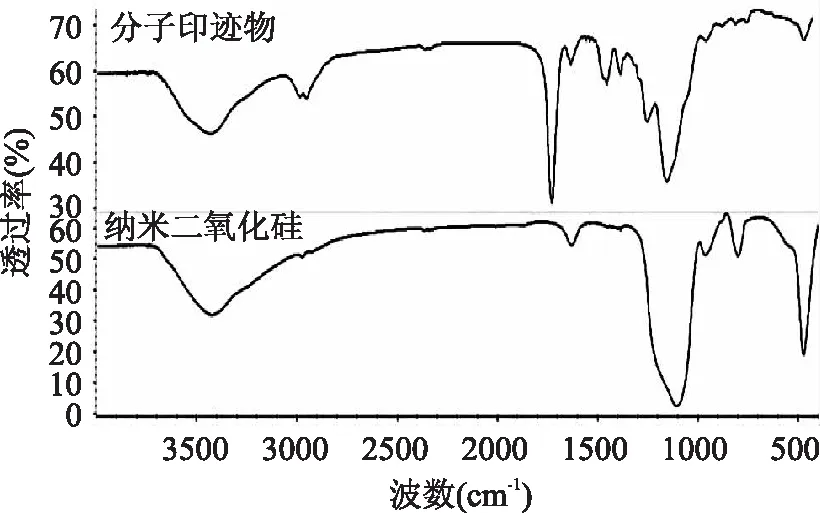
图2 分子印迹聚合物的红外谱图Fig. 2 FTIR spectra of MIP
2. 2 吸附等温的测定和Scatchard分析
吸附到聚合物上苏丹红Ⅳ的量为Q(mg/g)。计算公式为:Q=(Ci-Cf)V/m;Ci(mg/L)为苏丹红Ⅳ的初始浓度;Cf(mg/L)为苏丹红Ⅳ的平衡浓度;V(mL)为吸附溶液的体积;m为聚合物的质量(mg)。
聚合物对苏丹红IV的平衡吸附量随着苏丹红IV浓度的增加而增加(图3)。进一步将该结果进行Scatchard分析,拟合方程为Q/Cf=(Qmax-Q)/Kd。式中,Q(mg/g)为聚合物对苏丹红Ⅳ的吸附量;Cf(mg/L)为苏丹红Ⅳ的平衡浓度;Qmax(mg/g)为最大表观结合量;Kd(mg/L)为结合位点的平衡离解常数。以Q/Cf对Q作图(图4)。在测定的浓度范围内,对于MIP而言,可以拟合出两条线性关系(图4a),即MIP对模板分子存在两种结合位点。MIP这两种结合位点的最大表观结合量和平衡离解常数分别为Qmax1=0. 8306mg/g,Kd1=4. 760mg/L;Qmax2=4. 146mg/g,Kd2=112. 4mg/L。对NIP进行拟合只能得到一条线性关系(图4b),即NIP对模板分子只有一种结合方式,经计算得到的最大表观结合量和平衡离解常数分别为Qmax=0. 8692mg/g;Kd=29. 07mg/L。
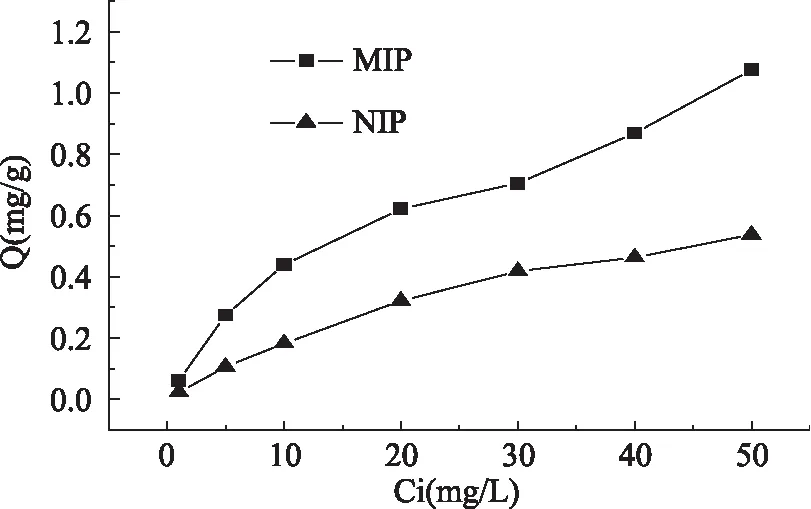
图3 MIP及NIP对苏丹红IV的吸附等温线Fig. 3 Binding isotherms of MIP and NIP
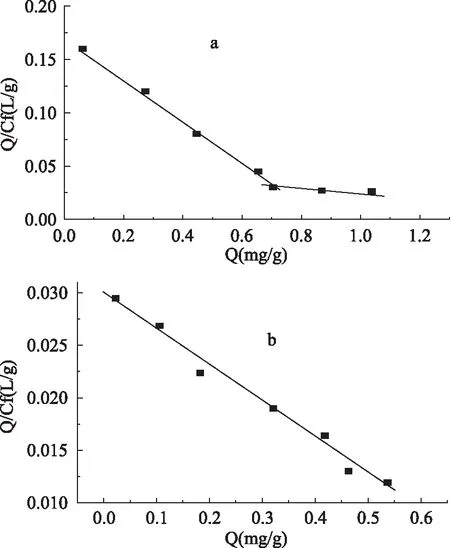
图4 MIP(a)和NIP(b)Scatchard分析曲线Fig. 4 Scatchard plot analysis of MIP(a)and NIP(b)
2. 3 吸附动力学考察
由实验数据得到聚合物对苏丹红在不同时间内的吸收量Qt(mg/g),结果如图5所示。
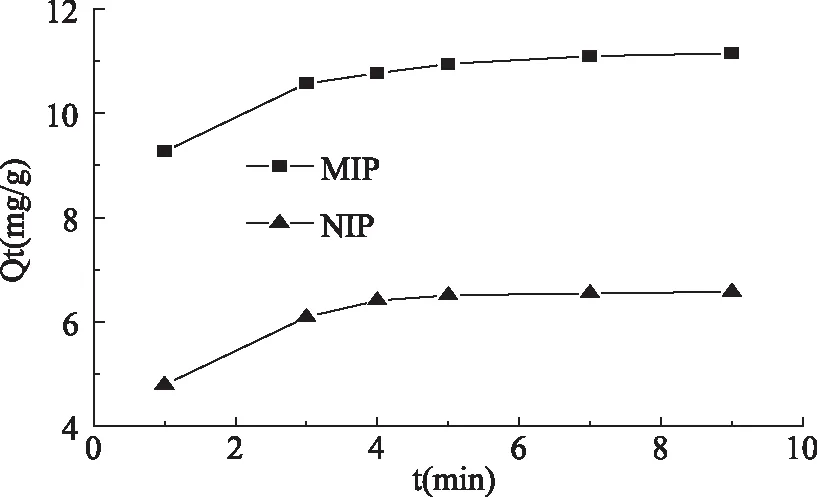
图5 MIP和NIP吸附动力学结果Fig. 5 The kinetic curves of MIP and NIP
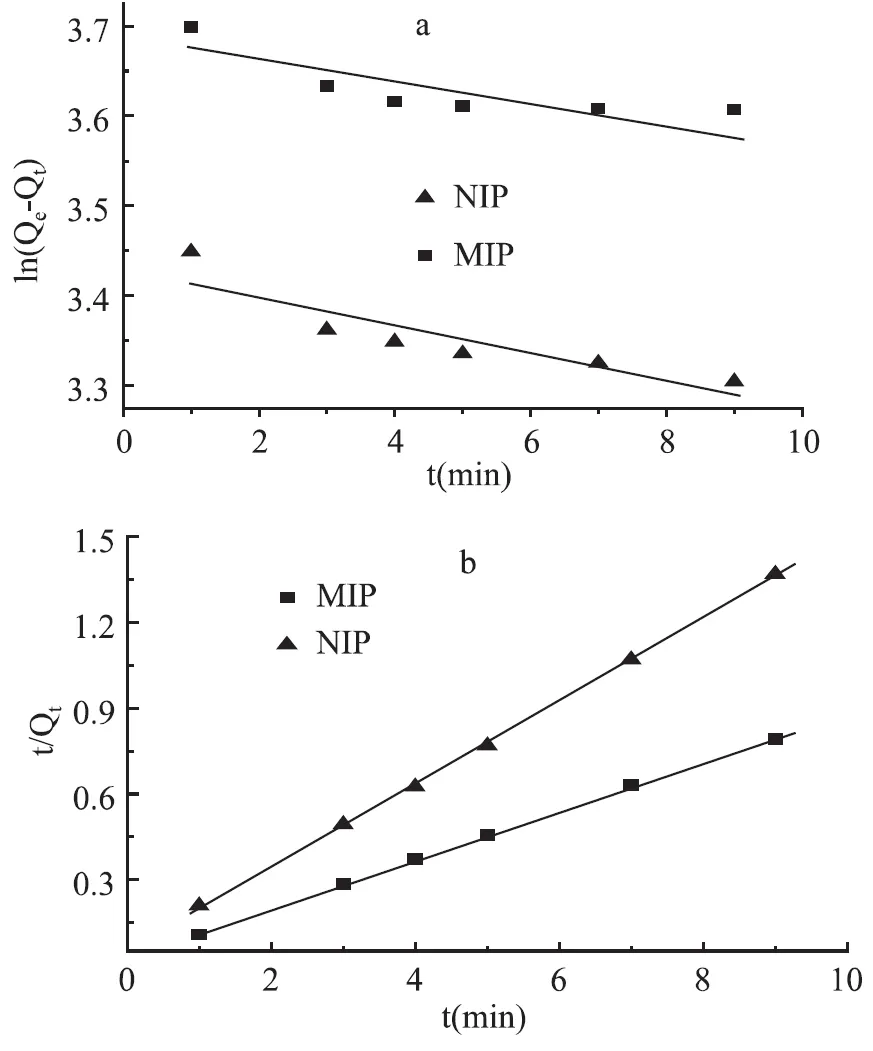
分别对数据进行准一级动力学和准二级动力学拟合,拟合方程分别为:ln(Qe-Qt)=lnQe-k1t和t/Qt=1/k2Qe2+t/Qe。式中,Qt(mg/g)是不同时间的吸收量,Qe(mg/g)是平衡时的吸附量,k1(min-1)和k2(g·mg-1·min-1)分别是准一级和准二级动力学的吸收速率常数。
对MIP和NIP分别由ln(Qe-Qt)对t作图(图6a)进行准一级动力学拟合得到直线y= - 0. 0099x+3. 677,R2=0. 632和y= - 0. 0158x+3. 4306,R2=0. 8037。对MIP和NIP分别由t/Qt对t作图(图6b)进行准二级动力学拟合得到直线y=0. 1451x+0. 0542,R2=0. 9995和y=0. 0856x+0. 0266,R2=0. 999。由结果可知MIP和NIP对苏丹红的吸收均符合准二级动力学吸附模型。
2. 4 萃取条件的优化
应用制备得到的MIP作为基质固相分散的吸附剂对辣椒面中的4种苏丹红进行萃取,优化了影响萃取结果的条件。实验结果显示,当MIP与辣椒制品比例为1∶ 1,研磨时间为8min,采用4mL 5%乙酸乙醇作为洗脱剂得到的苏丹红萃取效果最佳。
2. 5 分析方法评价及应用
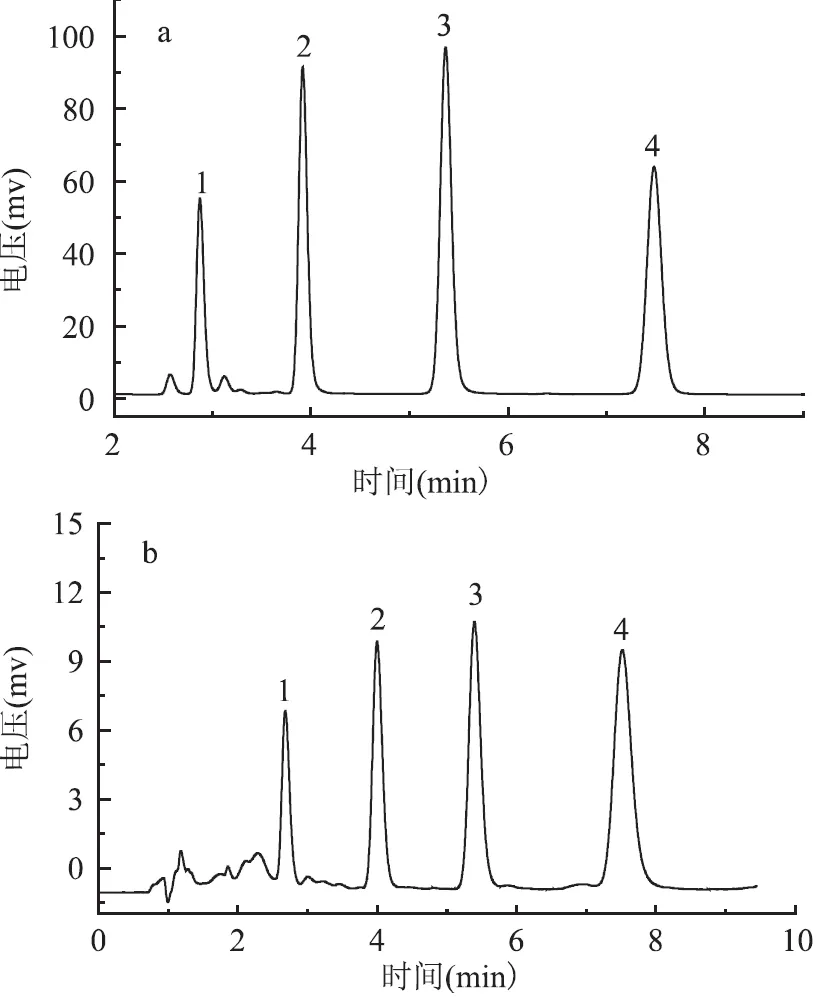
采用液相色谱检测4种苏丹红,色谱图如图7所示。线性范围为0. 05 ~ 10μg/mL。苏丹红Ⅰ,Ⅱ,Ⅲ,Ⅳ的检出限分别为0. 016,0. 015,0. 011和0. 010μg/mL。精密度的考察是通过对同一批辣椒样品连续分析6次,得到测定苏丹红Ⅰ,Ⅱ,Ⅲ,Ⅳ的相对标准偏差RSD分别为4. 8%,3. 2%,5. 4%和5. 0%。本实验又对样品进行了加标回收实验,得到的苏丹红Ⅰ,Ⅱ,Ⅲ,Ⅳ的加标回收率分别为96. 4%,95. 7%,94. 4%和98. 3%。从哈尔滨市场上购买了5种辣椒面和5种辣椒酱,应用此方法进行检测,均未发现苏丹红的存在。随后我们对这些样品进行了苏丹红Ⅰ,Ⅱ,Ⅲ,Ⅳ的加标回收实验,得到的四种苏丹红的回收率在94. 7% ~ 98. 4%范围内,证明了本方法可以很好的应用于不同辣椒样品基质的分析中。
3 结论
本实验以苏丹红Ⅳ为模板分子,以表面印迹法制备得到了分子印迹聚合物。对其进行了吸附等温线的测定,Scatchard分析以及动力学分析。最后将其应用于基质固相分散的吸附剂萃取分离辣椒制品的4种苏丹红。由于苏丹红Ⅰ,Ⅱ,Ⅲ,Ⅳ的结构式类似,因此4种苏丹红均能被所合成的MIP提取出来,且得到了较高的回收率。该方法减少了样品预处理的步骤,快速、准确、灵敏度高。
[1]李军,雍炜,李刚,等. HPLC 法测定辣椒及其制品中苏丹红色素含量[J]. 检验检疫科学,2005,15(2):43 - 45.
[2]周金森,龙军标,刘赐敏,等. SPE - HPLC 法测定辣椒粉中苏丹红I ~ IV[J]. 中国卫生检验杂志,2011,21(10):2411 - 2415.
[3]李娜,董文宾,魏新军,等. 紫外 - 可见光光度法快速检测蛋黄中苏丹红IV的研究[J]. 食品工业科技,2009,30(12):397 - 400.
[4]颜流水,井晶,黄智敏,等. 槲皮素分子印迹聚合物的制备及固相萃取性能研究[J]. 分析实验室,2006,25(5):97 - 100.
[5]董襄朝. 分子印迹聚合物在复杂体系分离中的应用研究进展[J]. 分析测试学报,2004,23(6):119 - 123.
[6]祁克宗,施祖灏,彭开松,等. 基质固相分散萃取 - 高效液相色谱法检测鸡组织中均三嗪类药物残留[J]. 分析化学,2007,35(11):1601 - 1606.
[7]徐莉,刘英菊,刘有芹,等. 分子印迹聚合物固相萃取红椒粉中的苏丹红[J]. 化学研究与应用,2008,20(7):812 - 815.
[8]徐小艳,邓世俊,孙远明. 分子印迹固相萃取 - 高效液相色谱法测定食品中苏丹红I - IV[J]. 理化检验 - 化学分册,2013,49(2):153 - 155.
[9]郑红,韩鸿萍,李晶,等. 苏丹红 - 分子印迹聚合物的合成与性能研究[J]. 青海大学学报:自然科学版,2006,24(3):61 - 64.
[10]胡小钟,储晓刚,余建新,等. 基质固相分散和气相色谱 - 质谱法测定浓缩苹果汁中22 种有机氯农药和15 种拟除虫菊酯农药的残留量[J]. 分析测试学报,2004,23(5):38 - 42.

