氢氧化钠溶液标准物质的研制*
梁秀丽 荀其宁 王学琴 张 坤 梁 旭 王 强
(1.中国兵器工业集团第五三研究所(余姚分所),余姚 315400;2.中国兵器工业集团第五三研究所,济南 250031)
0 引言
氢氧化钠溶液标准物质是容量分析中常用的参考标准物质,它在工业、农业、国防、化工和医疗等行业的实验室中应用非常广泛。目前,很多分析检测实验室,特别是一些中小企业和一些新建实验室,容量分析使用的标准溶液由于在配制、标定等方面受实验室的设备、人员因素的影响,其量值结果往往有较大的偏差,给测定结果带来了不利的影响。
针对以上情况,我们开展了研制氢氧化钠溶液标准物质的工作,采用称量电位滴定法,成功研制浓度为0.1mol/kg和0.5mol/kg的氢氧化钠溶液标准物质,经有关部门批准后,提供给社会各实验室使用,为实验室提供一个统一的量值标准,有助于提高其分析检测能力。笔者谨以0.1mol/kg氢氧化钠溶液标准物质为例,介绍氢氧化钠溶液标准物质的研制过程。
1 实验部分[1-2]
1.1 主要仪器与试剂
1)所用仪器设备:pHs-3c型酸度计,配有指示电极(216型银电极)和参比电极(217型双盐桥饱和甘汞电极);METTLER163型电子分析天平(最大称量30g,分度值0.00001g)和AL204型电子分析天平(最大称量200 g,分度值0.0001 g);90-1型电磁搅拌器,搅拌速度:0~1250r/min,加热温度:0~150℃。
2)所用试剂:氢氧化钠(纯度98.9%);邻苯二钾酸氢钾(一级标准物质GBW06106邻苯二钾酸氢钾纯度标准物质,纯度99.998%,不确定度为0.05%(k=2));去离子水(离子交换+电渗析+二次蒸馏)。
1.2 氢氧化钠溶液的制备
1.2.1器具的清洗
用于配制氢氧化钠溶液的所有器具均应洗涤,并干燥后使用。由于氢氧化钠易腐蚀玻璃,因此,盛放该溶液的器具要用聚乙烯塑料容器。由于塑料在加工、运输过程中会有杂质和灰尘,因此,使用前必须清洗干净,先用自来水洗涤几次,然后用去离子水洗涤两遍,对于100mL的塑料瓶,清洗干净后,要放在80℃的鼓风烘箱中烘干,待烘箱温度降到室温后取出,盖上瓶盖,用于分装氢氧化钠溶液。
1.2.2氢氧化钠溶液的配制[1]
称取110g优级纯的氢氧化钠,溶于100mL煮沸的无CO2水中,注入聚乙烯塑料容器中,密闭放置至溶液清亮,用塑料管吸取81mL的上层清液,注入盛有15L煮沸无CO2水的塑料容器中,摇匀后加上带有碱石灰的玻璃管,放置一周后分装使用。所配制溶液的浓度约为0.1mol/kg。
1.2.3氢氧化钠溶液的分装
将配制好的氢氧化钠溶液,用洗涤干净并干燥后的量筒量取100mL,加入到100mL塑料瓶中,共分装150瓶(单元),用于均匀性检验和稳定性考察实验。
2 氢氧化钠溶液的均匀性检验[3-4]
采用F检验法对标准溶液进行均匀性检验。标准溶液在配制完成后,从150个分装单元中随机抽取18个单元,采用称量滴定法,按照定值实验的条件进行测定,每个单元测定4次。
对0.1mol/kg氢氧化钠溶液结果见表1,对表1中的数据进行统计处理,通过比较组间方差和组内方差,判断各组测量值之间是否存在显著差异。应用F法检验的公式计算F值,并查表得统计检验的临界值,取给定的某一显著水平a,设a=0.05,当自由度为(17,54)时,查表得到F(17,54),0.05=1.82。由表1数据计算的F值为1.77,因FNaOH 表1 氢氧化钠溶液均匀性检验结果 续表 稳定性是标准物质的重要技术指标,在贮存期间必须定期对氢氧化钠溶液进行抽样测定。采用t检验法对配制的氢氧化钠溶液进行稳定性考察。从18个单元中任取一组,按照定值实验的条件进行测量,每隔1个月测量一次,在测量过程中,每组测量4次,当a=0.05时,查表得到t0.05,6=2.45。对于表2稳定性检验数据,进行统计计算,所有的统计量t值均小于t0.05,6,以上氢氧化钠溶液的数据没有显著变化,则该标准溶液在6个月时间内是稳定的。 表2 氢氧化钠溶液稳定性检验结果 称量电位滴定法是使用分析天平称量标准滴定溶液的质量,从而确定被测溶液浓度的一种分析方法。在滴定时,将所用的指示电极和参比电极浸入同一被测溶液中,用规定的标准滴定液进行滴定。在滴定过程中,参比电极的电位保持恒定,指示电极的电位则随着反应中滴定液的加入而增加或减少。在化学计量点前后,溶液中的被测物质的质量的微小变化,会引起指示电极电位的急剧变化,指示电极电位的突跃点即为滴定终点。 称取约0.3g于105℃~1l0℃烘至恒重的邻苯二钾酸氢钾一级标准物质(准确至0.00001g)至滴定瓶中,加l00mL煮沸的无CO2水,充分溶解,用称量了质量的标准滴定溶液进行滴定,在每隔一适当区间后,分别记录加入的标准溶液的质量数和酸度计读数,在接近反应终点时,按电位变化10~15mV加入滴定液,然后,再称量其剩余滴定液的质量。氢氧化钠溶液的质量摩尔浓度按式(2)计算: (2) 式中,c为氢氧化钠标准滴定溶液的质量摩尔浓度,mol/kg;m标物为一级标物邻苯二钾酸氢钾的质量,g;m0为终点时消耗的标准氢氧化钠溶液的质量,g;0.20422为与1.0000g标准氢氧化钠溶液相当的以克表示的邻苯二钾酸氢钾的质量。 随机抽取18个单元,按上述方法进行测定,每个最小单元测定4次,溶液标准物质的定值结果见表3。 表3 氢氧化钠溶液标准物质定值结果 由表3结果计算可得氢氧化钠溶液标准物质的质量摩尔浓度的平均值为0.10047mol/kg,按照修约规则修约为0.1005mol/kg[6]。 用一级标准物质基准邻苯二甲酸氢钾标定氢氧化钠溶液标准物质,定值结果的不确定度主要来源为以下几方面:1)测量重复性和再现性引入的不确定度uA[4];2)一级标准物质纯度引入的不确定度u1;3)一级标准物质分子量的不确定度u2;4)一级标准物质称量引入的不确定度u3;5)滴定称量氢氧化钠溶液质量引入的不确定度u4。6)标准物质的均匀性考察引入的不确定度uH[4];7)准物质稳定性考察引入的不确定度uT[4]。 各分量间互不相关,则合成相对标准不确定度: 在置信概率为95%时,k=2,U=2uc。 各不确定度分量及合成不确定度列于表4。 表4 定值结果相对不确定度汇总 经评定氢氧化钠溶液标准物质定值不确定度为0.1%(k=2),则氢氧化钠溶液标准物质的质量摩尔浓度表示为:c(NaOH)=0.1005mol/kg,U=0.1%(k=2)。 选择二级邻苯二钾酸氢钾标准物质,用定值后的氢氧化钠溶液标准物质测量其纯度,测量结果与证书给定值比较,结果差值小于测量结果的不确定度时,则表明所研制的氢氧化钠溶液标准物质的量值准确。验证结果见表5,由表5可知,验证结果的差值小于不确定度,说明该溶液标准物质量值准确可靠。 表5 定值结果验证 4.6.1邻苯二钾酸氢钾标物质干燥 邻苯二钾酸氢钾分子中含有羧基,是离子活度很大的钾盐,它易溶于水,在长期保存中会吸收空气中的水,如果精确称量未经干燥的该标准物质用于滴定,则会使测定碱的浓度偏高。因此,该标准物质在称量前,必需放入105℃~110℃烘至恒重,但切忌不能超过125℃,否则,该标准物质会部分分解成酸酐,影响溶液标准物质的定值准确度。 4.6.2滴定器的选择 采用滴定管目视滴定时,在调节滴定管的零点及滴定终点读数时,由于人的视觉判断造成读数误差,为避免该误差,选择注射器作为滴定器,并采用了称量滴定法,由于注射器体积小,操作非常方便,便于称量,克服了滴定管法的缺点,提高了测量结果准确度。 4.6.3滴定方法的选择 传统的滴定方法是用滴定管目视滴定,即目视判断滴定终点,由于人的视觉灵敏度有限,判断的滴定终点会滞后,因而产生一定的滴定误差。而采用电位滴定法,操作方便,根据电位突越点判断滴定终点,提高了测量结果的准确度。 氢氧化钠溶液标准物质定值条件选择合理,采用称量电位滴定法定值,提高了定值结果的准确性。该标准物质经过F检验和t检验,证明所研制的标准物质为均匀和稳定性良好,完全符合国家二级标准物质的要求。 该溶液标准物质的研制成功后,可以不仅满足国防科研和生产的需求,还可为我国化工和化学领域的实验室提供参考物质。 [1]GB/T 601—2002化学试剂,滴定分析(容量分析)用标准溶液的配制[S] [2]GB/T 10737—2007 工作基准试剂含量测定通则 称量电位滴定法通则 [3]JJF 1006—1994 一级标准物质技术规范[S] [4]全国标准物质管理委员会.标准物质的管理研制与应用[M].北京:中国计量出版社.2010 [5]JJF 1059.1—2012测量不确定度评定与表示[S] [6]GB/T 8170—2008数值修约规则与极限数值的表示和判定[S]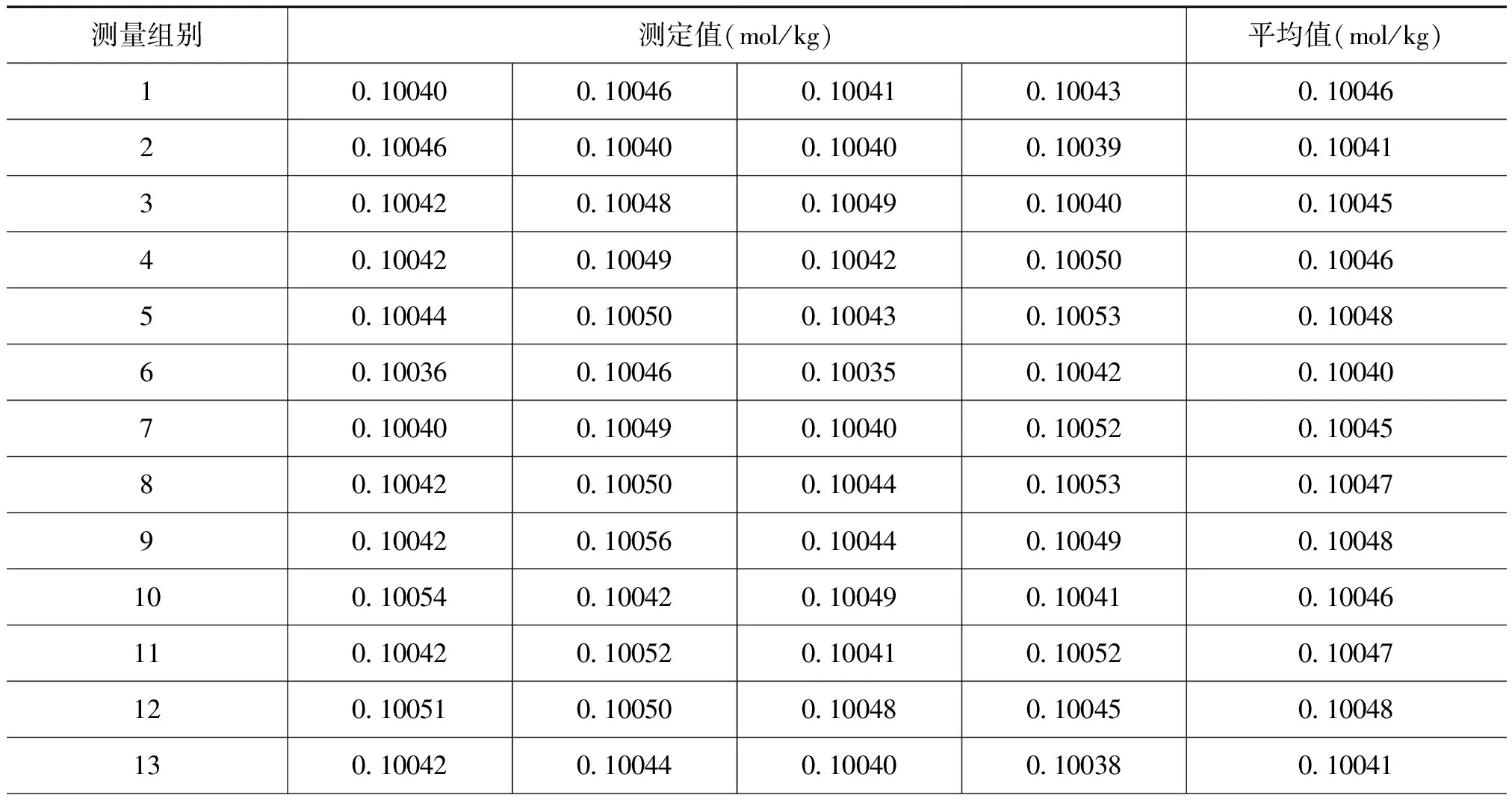
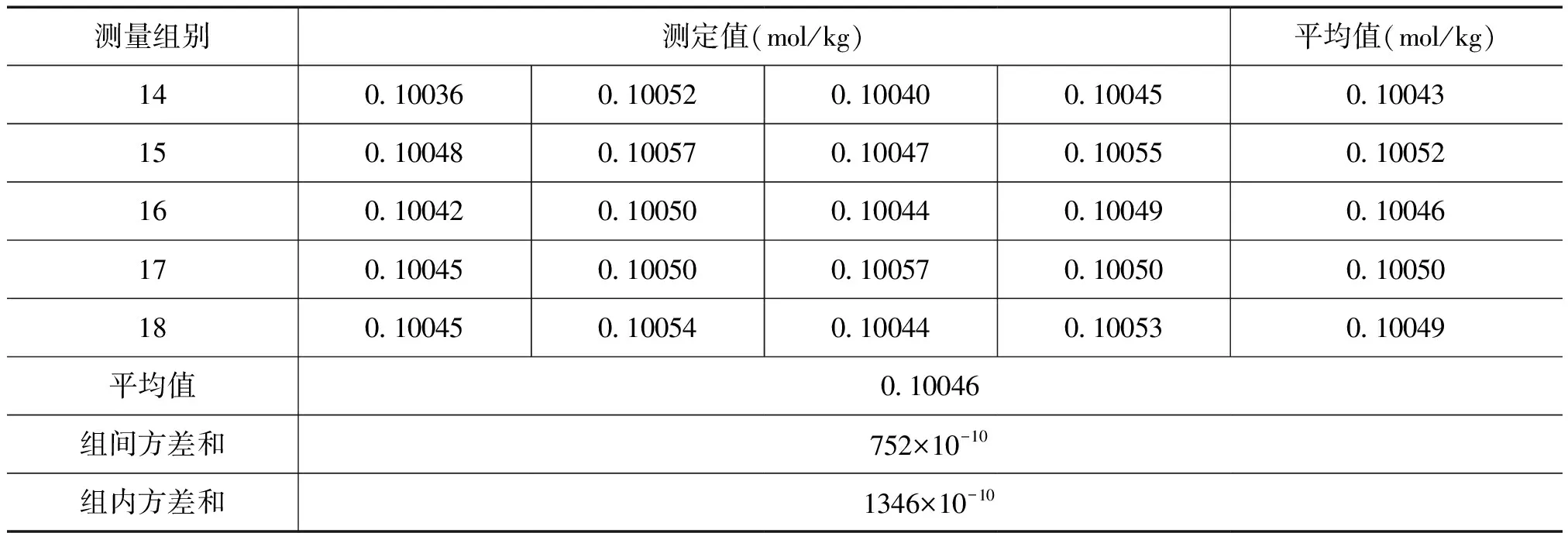
3 氢氧化钠溶液稳定性考察[3-4]
4 氢氧化钠溶液标准物质定值[1-2]
4.1 定值原理[2]
4.2 定值方法[2]
4.3 定值结果

4.4 定值结果不确定度评定[5]
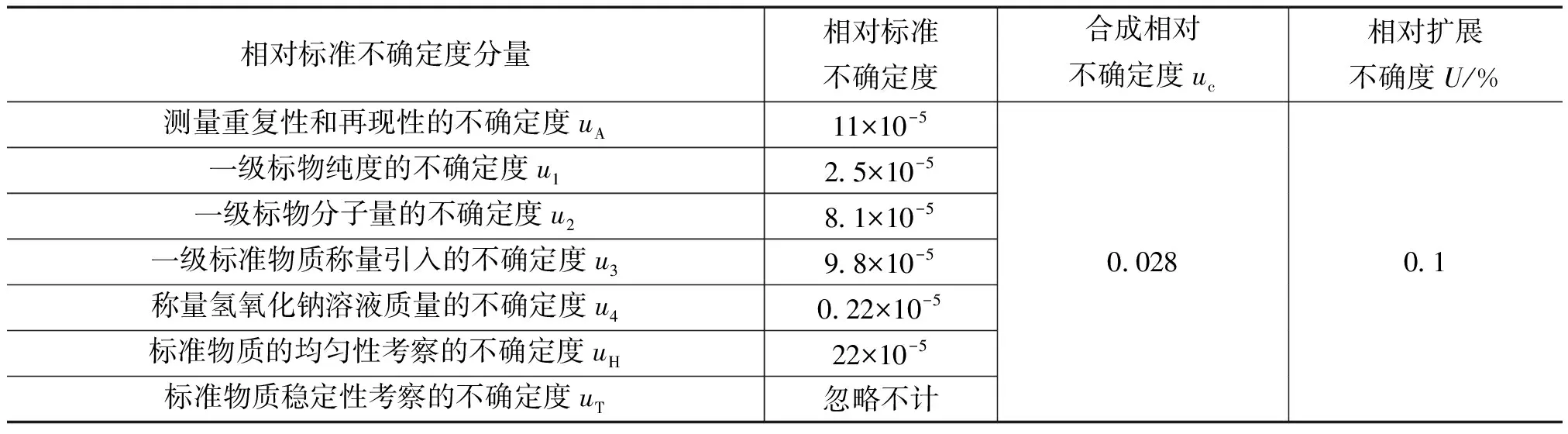
4.5 定值结果的验证

4.6 定值过程的讨论
5 结语

