氧化乐果对小球藻的毒性研究
宋志慧,刘 冰
青岛科技大学 环境与安全工程学院,山东青岛 266042
我国作为一个农业大国,农药被大量大范围使用,农药的污染时时刻刻影响着水生态系统。在过去的几十年中,有机磷农药已经在农业和家庭应用中取代有机氯农药,并被广泛应用于农业和公共卫生,包括杀虫剂,杀线虫剂,杀螨剂,和杀菌剂。基本上都被用作杀虫剂和神经毒剂。自从有机磷农药被人们认识,有机磷的公众暴露水平,职业和非职业性,急性或慢性也引起人们的关注,并且已经严重影响了人类的健康[1]。如今,各式各样的具有多种生物学特性的有机磷农药的广泛使用使得在全世界,特别是在发展中国家,有机磷中毒已经成为发病率和死亡率的一个主要原因[2]。目前国内外已有大量关于有机磷农药对人类健康、无脊椎动物、鱼类、浮游植物的影响及其毒理学研究的报道[3-12],Gama-Flores等[10]研究了农药甲基对硫磷在不同食物密度(小球藻)条件下对角突臂尾轮虫的急性和慢性毒性,研究表明在小球藻密度为(0.75×106) cells·mL-1时,甲基对硫磷对角突臂尾轮虫的24 h-LC50为(2.783±0.316) mg·L-1,在小球藻密度为(3×106) cells·mL-1时,甲基对硫磷对角突臂尾轮虫的24 h-LC50为(6.52±0.77) mg·L-1。
世界卫生组织建议对农药的分类,认为氧化乐果为高度危险(Ib类),对大鼠的LD50为50 mg·kg-1体重。目前国内外学者对于氧化乐果的研究主要集中在氧化乐果的检测方法[13~16]、残留分析[17~18]、毒性研究[19-22]等方面。氧化乐果作为一种广泛使用的有机磷农药,由于它主要作用于乙酰胆碱酯酶,抑制动物的神经传导,对它的毒性研究也主要集中在对动物的研究。杨帆,邹容[19]发现氧化乐果对黄颡鱼幼鱼在静态条件下的安全浓度分别为16.94 μg·L-1,而在半静态条件下的安全浓度为15.78 μg·L-1;E1-Banhawy[20]发现氧化乐果对巴西一种捕食性螨虫的 LC50为1.2 mg·kg-1。这些毒理学研究在一定程度上为环境监测提供了依据,但在农药对水环境的污染越来越严重的今天,随着对有毒物质的生态效应的研究由单一物种向生态系统整体效应的更大关注,农药对生态系统的初级生产者——藻类的毒性及其生态毒理学研究也已经引起了国内外学者的广泛重视。
藻类作为水生生态系统的初级生产者,能通过光合作用,为无脊椎动物、鱼类、水鸟等生物提供O2、食物,其种类多样性和初级生产量直接影响水生态系统的结构和功能。目前国内外关于农药对藻类的毒性研究已有一些报道,但大多数是研究除草剂[23~27]、重金属[28~29]对于藻类的毒性研究,Andrzej等[28]研究发现重金属抑制小球藻生长的作用顺序为:铜>铅>镉;Qian等人[24]研究了除草剂草丁瞵(glufosinate)、阿特拉津(atrazine)和禾草灵(diclofop-methyl)对小球藻基因转录的影响,他们发现这3种供试药物对小球藻光合作用基因psbC和rbcL相对表达量有显著地抑制作用。
目前关于氧化乐果对藻类的毒理学研究还较少,而且我们发现大多数对藻类的毒理学研究集中在抗氧化酶系统的研究,对硝酸还原酶系统的影响却鲜有报道,因此本文研究了氧化乐果对小球藻的毒性研究,通过对硝酸还原酶活性、叶绿素含量的研究,为陆地上农药合理使用提供决策依据,同时也了解了氧化乐果对小球藻的毒害作用。
1 材料和方法(Materials and methods)
1.1 仪器与试剂
仪器:722型分光光度计(上海精密科学仪器有限公司),GXZ型智能培养箱(宁波江南仪器厂),LDZ4-0.8A离心机(北京医用离心机厂)。
试剂:磺胺等化学试剂为国产分析纯试剂。
1.2 实验材料
40%氧化乐果乳油,购于山东大成农药厂。
小球藻,由中国海洋大学海洋生命学院提供。
试验用培养基及所有器皿均经过121 ℃高压灭菌15 min,采用BG-11培养基,藻种在无菌条件下置于250 mL锥瓶中培养,培养液100 mL,温度25±2 ℃,光暗比14:10,光强4 000 Lux,每天振摇4次,每次15 min。培养3代,待镜检细胞正常,选择对数生长期的藻液进行试验。
1.3 实验设计
将达到对数生长期的小球藻5 mL接种于100 mL的HB4培养液中,每个瓶中加入准备好的氧化乐果母液,使其成系列浓度,并设置一个对照组(0 mg·L-1),每个浓度设3个平行。静止培养,每天定时人工摇动3次,每隔24 h取样,取样前充分摇匀藻液。
1.4 预实验
通过查阅相关文献,根据确定的毒性范围配置一系列浓度梯度的染毒液(0.1、1、10、20、30、40、50 mg·L-1),在上述培养条件下隔天测定藻液在660 nm处吸光度,根据测定结果发现氧化乐果对小球藻的96 h-EC0和96 h-EC100分别为为0.5 mg·L-1、30 mg·L-1。
1.5 氧化乐果对小球藻的急性毒性试验
根据预实验结果,设计系列染毒浓度(1、5、10、15、20 mg·L-1),并设置一个对照组(0 mg·L-1),每个浓度设3个平行。在上述测定条件下进行各个指标的测定。
1.5.1 氧化乐果对小球藻的EC50的测定
据实验所设浓度用分光光度计在660 nm处测其初始吸光度,以后每隔天测一次吸光度。通过将氧化乐果浓度的对数(lnC)为横坐标,抑制百分率的概率单位为纵坐标做标准曲线,用概率单位法得到氧化乐果对小球藻的EC50。
1.5.2 硝酸还原酶活性的测定

以μg NaNO2·L-1·Abs作为酶活单位。NaNO2的浓度可根据亚硝酸钠标准曲线计算得到。
1.5.3 叶绿素含量的测定
培养条件不变的前提下,隔天取实验组和空白组5 mL藻液置于离心管中,3 000 r·min-1力离心10 min,弃去上清液,加入5 mL蒸馏水洗涤,3 000 r·min-1力离心10 min,弃去上清液,将沉淀悬浮于5 mL无水乙醇中将提取液放入冷藏室,提取24 h,然后将提取液在3 000 r·min-1力离心10 min,在645 nm和663 nm处测上清液的吸光度。
叶绿素(a + b)含量的计算[31]:
Ca+b=20.2A645+8.02A663
1.5.4 数据分析
数据均用平均值表示,用Origin 8.0对试验的数据进行制图,采用SPSS 19.0在p=0.05的置信水平对硝酸还原酶活性、叶绿素含量的变化情况进行单因素方差分析(One-Way ANOVA)。
2 结果(Results)
2.1 氧化乐果对小球藻生物量的影响
由图1可以看出浓度小于1 mg·L-1时,前6 d小球藻生物量与对照组相比无明显变化,随时间增加到第6天时实验组小球藻生物量出现明显降低,说明低浓度氧化乐果短时间内对小球藻的细胞生长没有影响;氧化乐果浓度大于5 mg·L-1时,细胞的生长从第二天起就受到较强的抑制,实验组的细胞生物量明显小于对照组,说明高浓度氧化乐果在作用初期就抑制了小球藻的细胞生长,而且氧化乐果浓度越高,抑制作用表现越明显,同时我们发现在第6天之后,小球藻生物量出现一定的补偿增长。同时由图2可以看出实验进行到第8天时,总体来说随着受试氧化乐果浓度的增加,小球藻的生物量在降低,氧化乐果浓度和小球藻的生物量的相关性方程为y=0.319-0.0455x,由此可知氧化乐果浓度和小球藻的生物量之间呈负相关,相关系数R2为0.65755。同时由表2还可以看出各处理组之间以及对照组和处理组之间均存在显著性差异(p<0.05)。
2.2 氧化乐果对小球藻EC50的影响
氧化乐果对小球藻的概率单位—浓度对数曲线方程和EC50如表1所示。从表1看出,氧化乐果对小球藻的EC50值随时间增加处于下降状态。

图1 氧化乐果对小球藻生长量的影响(660 nm)Fig. 1 Toxic effects of omethoate on the biomass of Chlorella vulgaris (660 nm)
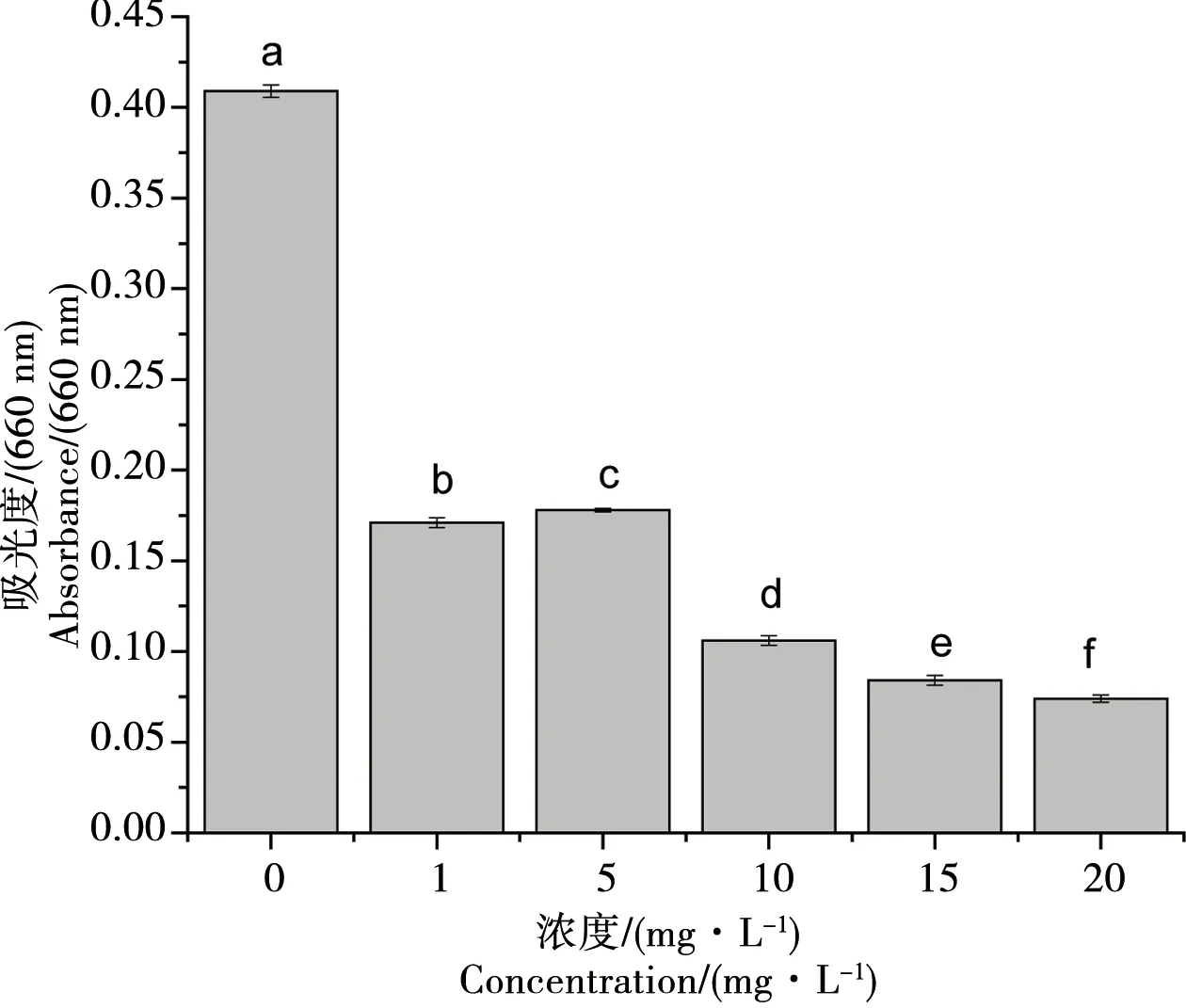
图2 氧化乐果对小球藻生长量的影响(8 d)Fig. 2 Toxic effects of omethoate on the biomass of Chlorella vulgaris (8 d)

表1 氧化乐果对小球藻概率单位—浓度对数曲线方程和EC50Table 1 Regression curve of probit-concentration logarithm and EC50 of omethoate to Chlorella vulgaris
2.3 氧化乐果对小球藻硝酸还原酶活性的影响
由图3可知,1、15、20 mg·L-1处理组之间相比较无显著差异(p>0.05),1、15、20 mg·L-1处理组与1、10 mg·L-1处理组和对照组之间相比均存在显著差异(p<0.05)。实验进行到第8天时,氧化乐果浓度在0~5 mg·L-1范围内,随着氧化乐果浓度的升高,相比于对照组增加了12.7%,小球藻硝酸还原酶活性逐渐上升;当到达5 mg·L-1时,硝酸还原酶活性开始下降,随着氧化乐果浓度的升高,小球藻硝酸还原酶活性逐渐降低,但仍高于对照组。
2.4 氧化乐果对小球藻叶绿素含量的影响
由图4可知,在实验进行到第6天时,氧化乐果对叶绿素b含量的影响实验中,5 mg·L-1处理组与1 mg·L-1和对照组之间无显著性差异(p>0.05),其余各浓度组之间、各浓度组与对照组之间均存在显著差异(p<0.05),并且随氧化乐果浓度的增加,小球藻体内叶绿素的含量整体呈下降趋势,而且空白组藻体内的叶绿素a、叶绿素b、叶绿素总含量都明显高于浓度组。
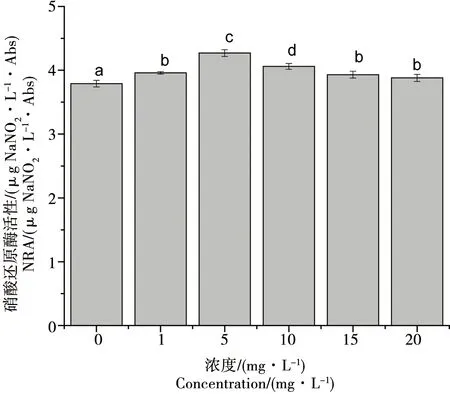
图3 氧化乐果对小球藻硝酸还原酶活性的影响Fig. 3 Toxic effects of omethoateo on nitrate reductase activity of Chlorella vulgaris
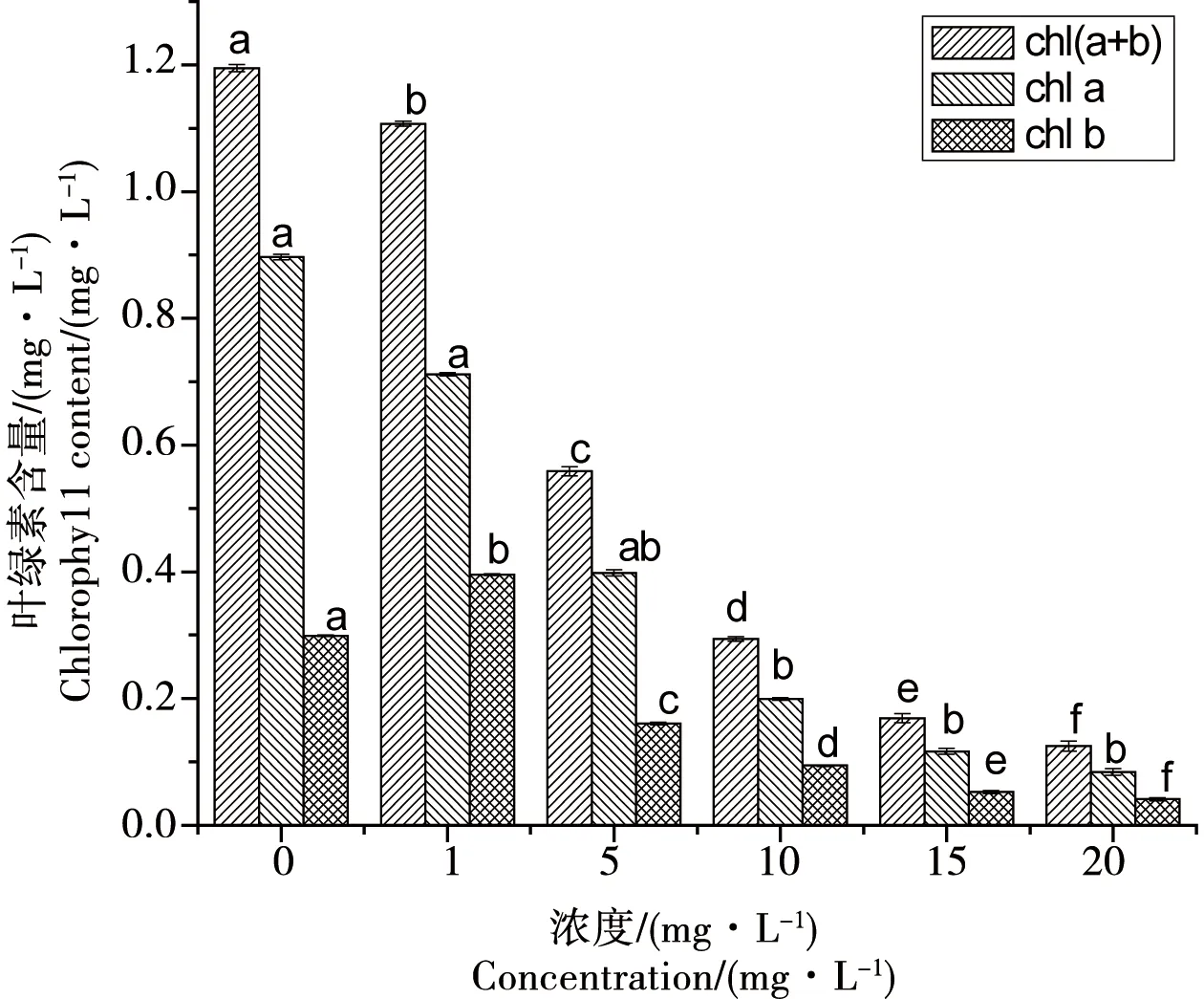
图4 氧化乐果对叶绿素含量的影响(6 d)Fig. 4 Toxic effects of omethoate on chlorophyll content of Chlorella vulgaris(6 d)
3 讨论(Discussion)
方汉孙等[32]人研究发现,在0.001、0.01、0.1 mg·L-1敌敌畏3个质量浓度处理下,赤潮异弯藻第3~5 d的相对增长率显著高于对照组,在1、10 mg·L-1质量浓度处理下,最初微藻增长受抑制,在培养7 d之后出现一定补偿增长现象。由图1我们看出低浓度氧化乐果(1 mg·L-1)在前6 d对小球藻细胞增长影响不大,高浓度(大于5 mg·L-1)则在初期就表现为抑制,氧化乐果浓度与细胞数量之间表现为负相关(R2=0.65755),如方汉孙的研究结果一致,而且在后期也出现一定的补偿增长现象。
裴国凤等[33]研究发现,以生物量计,三聚氰胺抑制近头状伪蹄形藻和斜生栅藻生长的72 h-EC50值分别是537.67 mg·L-1和485.17 mg·L-1,为较低的毒性效应。本实验中氧化乐果对小球藻96 h-EC50值为4.88 mg·L-1,属于中毒,同时由表1可以看出,随着受试氧化乐果浓度的增加,EC50值呈降低趋势,可能是由于随毒物作用时间的延长,藻细胞分裂速度减慢,死亡速度增加,导致细胞密度下降EC50值降低。也可能是由于培养时间的延长,而在此期间又不添加营养物,导致营养的缺乏或其它理化条件的改变,进而藻细胞数减少,EC50下降。

叶绿素的含量水平是植物生长能力大小的直接表现。当一定浓度的有机磷作用于小球藻,会使细胞生理活性降低,从而降低细胞对微量元素的吸收作用,尤其是铁、镁等元素的吸收量大大降低,这就进一步导致了小球藻体内叶绿素含量的降低。方汉孙等[32]同时发现低浓度敌敌畏对赤潮异弯藻叶绿素a的影响表现为促进作用,高浓度则表现为抑制;岳文洁等[37]也通过对氯氰菊酯对海洋卡盾藻Chl.a含量的影响的研究发现,低浓度氯氰菊酯对海洋卡盾藻叶绿素a的影响表现为促进作用,高浓度则表现为抑制,这些研究结果与本实验结果大体一致。图4反映出当氧化乐果浓度高于1 mg·L-1时,随氧化乐果浓度的增加叶绿素含量下降,可能是小球藻叶绿素含量对氧化乐果反应比较灵敏,则总体表现为抑制作用。
硝酸还原酶活性和叶绿素含量分别体现了氮代谢水平的速率和光合作用的大小。这两个指标对于藻细胞的生长都起到关键作用,因此对这两个指标的研究具有一定的代表性。从实验结果我们可以认为氧化乐果对小球藻生长的影响是通过抑制叶绿素的形成,进而抑制光和作用来实现的,这与刘青等[38]人的研究结果一致,且与硝酸还原酶活性相比,叶绿素的含量能更灵敏的反映这种损伤,故而叶绿素含量能够作为一种有效的生物标志物对氧化乐果引起的毒性做出评价。而且目前对于藻类的毒理学研究很多,其研究指标不止包括叶绿素含量、硝酸还原酶活性,还包括各种抗氧化酶活性[39]、叶绿素荧光特征[40]等指标,因此,关于氧化乐果对小球藻细胞的毒理学研究的具体机理还需进一步探究。
参考文献:
[1] Etemad L, Moshiri M, Moallem S A. Basic and Clinical Toxicology of Organophosphorus Compounds [M]. 2014, 79-118
[2] Soltaninejad K, Shadnia S. Basic and Clinical Toxicology of Organophosphorus Compounds [M]. 2014, 25-43
[3] Pavlic M, Haidekker A, Grubwieser P, et al. Fatal intoxication with omethoate [J]. International Journal of Legal Medicine, 2002, 116: 238-241
[4] 姚新民, 周志俊. 长期接触低剂量有机磷农药对人体健康影响的研究进展[J]. 环境与职业医学, 2008, 25(4): 409-412
Yao X M, Zhou Z J. Advances in human health effects of long-term exposure to low doses of organophosphorus pesticides [J]. Journal of Environmental & Occupational Medicine, 2008, 25(4): 409-412
[5] 徐光翠, 鄢珣, 张波. 有机磷农药对雄性生殖系统的损伤作用[J]. 甘肃农业大学学报, 2005, 40(6): 822-826
Xu G C, Yan X, Zhang B. Injury of organophosphorus pesticide on male reproductive system [J]. Journal of Gansu Agricultural University, 2005, 40(6): 822-826
[6] 来有鹏, 刘贤金, 余向阳, 等. 农药对河虾的急性毒性及其谷光甘肽转移酶(GSTs)的影响[J]. 农药, 2008, 47(11): 820-822
[7] 何东海, 孟范平, 朱小山. 有机磷农药对海洋动物乙酰胆碱酯酶(AChE)的毒性效应研究进展[J]. 海洋通报, 2003, 22(6): 71-78
He D H, Meng F P, Zhu X S. Organophosphorus pesticides in marine animals acetylcholinesterase (AChE) toxicity effect research progress [J]. Marine Bulletin, 2003, 22(6): 71-78 (in Chinese)
[8] 陈朝阳, 许淼清, 谢进金. 二种农药对金鱼的急性毒性研究[J]. 泉州师范学院学报(自然科学), 2005, 23(6): 78-81
Chen C Y, Xu M Q, Xie J J. The acute toxicity of two kinds of pesticides on goldfish study [J]. Journal of Quanzhou Normal College: Natural Science, 2005, 23(6) : 78-81 (in Chinese)
[9] 刘梅, 刘赞. 低浓度有机磷农药乐果促进普通小球藻生长的研究[J]. 焦作工学院学报, 1998, 17(5): 396-399
Liu M, Liu Z. Low concentration of organophosphorus pesticide dimethoate promote commonChlorellagrowth research [J]. Journal of Jiaozuo Institute of Technology, 1998, 17(5): 396-399 (in Chinese)
[10] Gama-Flores J L, Sarma S S S, Nandini S. Acute and chronic toxicity of the pesticide methyl parathion to the rotiferBrachionusangularis(Rotifera) at different algal (Chlorellavulgaris) food densities[J]. Aquatic Ecology, 2004, 38: 27-36
[11] Ferrando M D, Sancho E, Andreu-Moliner E. Accumulation of tetradifon in an algae (Nannochlorisoculata) and the cladoceran,Daphniamagna[J]. Bulletin of Environmental Contamination and Toxicology, 1996, 57: 139-145
[12] Kent R A, Caux P Y. Subletthal effect of the insecticide fenitrothion on freshwater phytoplankton [J]. Canadian Journal of Botany-Revue Canadienne de Botanique, 1995, 73: 45-53
[13] Yu G T, Yao M W, Lian B Y, et al. Simultaneous determination of omethoate and dichlorvos by capillary electrophoresis [J]. Bulletin of Environmental Contamination and Toxicology, 2008, 81(2): 210-215
[14] Hollosi L, Mittendorf K, Senyuva H Z. Coupled turbulent flow chromatography: LC-MS/MS method for the analysis of pesticide residues in grapes, baby food and wheat flour matrices [J]. Chromatographia, 2012, 75: 1377-1393
[15] Wang Y, Sun Y S, Huang J H, et al. Determination of omethoate by cathodically sweeping oscillopolarography [J]. Wuhan University Journal of Natural Sciences, 1998, 3(4): 469-472
[16] 鞠芳芳, 张喜轩, 孙体健, 等. 气相色谱和气相色谱/质谱法检测生物样品中氧化乐果[J]. 中国卫生检验杂志, 2009, 19(12): 2729-2730
Ju F F, Zhang X X, Sun T J, et al. Gas chromatography and gas chromatography/mass spectrometry detection in biological samples omethoate [J]. Chinese Journal of health inspection, 2009, 19(12): 2729-2730 (in Chinese)
[17] Smart N A. Organophosphorus pesticide residues in fruits and vegetables in the United Kingdom and some other countries of the European Community since 1976 [J]. Environmental Contamination and Toxicology, 1987, 98: 99-160
[18] 韩梅, 易盛国, 侯雪, 等. 结球甘蓝中氧化乐果残留量的测定[J]. 现代农业科技, 2010, 5: 147-148
Han M, Yi S G, Hou X, et al. Determination of omethoate residues in head cabbage [J]. Modern Agricultural Science and Technology, 2010, 5: 147-148 (in Chinese)
[19] 杨帆, 邹容. 3种有机磷农药对黄颡鱼幼鱼的急性毒性试验[J]. 安徽农业科学, 2010, 38(4): 1872-1873
Yang F, Zou R. Acute toxicity test of three kinds of organophosphorus pesticides onPelteobogrusfulvidracolarvae[J]. Anhui Agricultural Sciences, 2010, 38(4): 1872-1873 (in Chinese)
[20] E1-Banhawy E M. Residual toxicity of some common acaricides in brazil to the predacious miteAmblyseiusbrazilli[J]. , 1976, 21(3): 303-306
[21] 葛士林, 曹传旺, 王志英. 3种农药对红裸须摇蚊体内蛋白质质量分数和AChE活性的影响[J]. 东北林业大学学报, 2011, 39(1): 108-109, 126
Ge S L, Cao C W, Wang Z Y. Three kinds of pesticides onPropsilocerusakamusiTokunagain vivo protein mass fraction and the impact of AChE activity [J]. Journal of Northeast Forestry University, 2011, 39(1): 108-109, 126 (in Chinese)
[22] 徐光翠. 氧化乐果对雄性小鼠生殖系统损伤的研究[D]. 甘肃: 甘肃农业大学, 2005: 1-46
[23] Junghans M, Backhaus T, Faust M, et al. Toxicity of sulfonylurea herbicides to the green algaScenedesmusvacuolatus: Predictability of combination effects [J]. Bulletin of Environmental Contamination and Toxicology. 2003, 71: 585-593
[24] Qian H F, Chen W, Sun L W, et al. Inhibitory effects of paraquat on photosynthesis and the response to oxidative stress inChlorellavulgaris[J]. Ecotoxicology, 2009, 18(5): 537-543
[25] Ma J, Liang W, Xu L, et al. Acute Toxicity of 33 herbicides to the green algaChlorellapyrenoidosa[J]. Bulletin of Environmental Contamination and Toxicology, 2001, 66: 536-541
[26] Ma J, Liang W. Acute Toxicity of 12 herbicides to the green algaeChlorellapyrenoidosaandScenedesmusobliquus[J]. Bulletin of Environmental Contamination and Toxicology, 2001, 67: 347-351
[27] Ma J, Lin F, Wang S, et al. Acute toxicity assessment of 20 herbicides to the green alga scenedesmus quadricauda (Turp.) Breb [J]. Bulletin of Environmental Contamination and Toxicology, 2004, 72: 1164-1171
[28] Andrzej B. Suppression ofChlorellavulgarisgrowth by cadmium, lead, and copper stress and its restoration by endogenous brassinolide [J]. Archives of Environmental Contamination and Toxicology, 2011, 60(3): 406-416
[29] Simona C, Nicola L, Giovanna S, et al. Physiological and morphological responses of lead or cadmium exposedChlorellasorokiniana211-8K (Chlorophyceae) [J]. SpringerPlus, 2013, 2: 147
[30] 宋志慧编. 水生生态毒理学实验[M]. 北京: 化学工业出版社, 2008: 18-19
[31] 杨敏文. 快速测定植物叶片叶绿素含量方法的探讨[J]. 光谱实验室, 2002, 19(4): 478-481
Yang M W. Method of rapid determination of plant leaf chlorophyll content of leafs [J]. Chinese Journal of Spectroscopy Laboratory, 2002, 19(4): 478-481(in Chinese)
[32] 方汉孙, 张磊, 段舜山. 有机磷农药敌敌畏对赤潮异弯藻(Heterosigmaakashiwo)的毒物刺激效应[J]. 生态环境学报, 2010, 19(5): 1025-1029
Fang H S, Zhang L, Duan S S. The stimulating effect of organophosphorus pesticide dichlorvos onHeterosigmaakashiwo[J]. Ecology and Environmental Sciences, 2010, 19(5): 1025-1029 (in Chinese)
[33] 裴国凤, 刘国祥. 三聚氰胺对藻类的毒性效应研究[J]. 水生生物学报, 2010, 34(5): 973-978
Pei G F, Liu G X. Toxic effects of melamine on algae [J]. Acta Hydrobiologica Sinica, 2010, 34(5): 973-978 (in Chinese)
[34] 吴丽. 生物源农药和有机磷农药对铜绿微囊藻生长及生理影响[D]. 南京: 南京师范大学, 2011: 1-37
[35] 孙颖颖, 刘筱潇, 阎斌伦. 对羟基苯甲酸对2种赤潮微藻生长的影响[J]. 环境科学与技术, 2010, 33(7): 36-39
Sun Y Y, Liu X X, Yan B L. Impact of hydroxy acid on two kinds of red tide algae growth [J]. Environmental Science & Technology, 2010, 33(7): 36-39 (in Chinese)
[36] 宋志慧, 黄国兰, 刘新程. 五氯酚对盐泽螺旋藻的毒性研究[J]. 上海环境科学, 2000, 9: 441-443
Song Z H, Huang G L, Liu X C. Toxic studies of pentachlorophenol onMicrocystisaeruginos[J]. Shanghai Environmental Sciences, 2000, 9: 441-443(in Chinese)
[37] 岳文洁, 王朝晖, 王桥军, 等. 氯氰菊酯对海洋卡盾藻的毒性效应[J]. 生态毒理学报, 2009, 4(2): 251-257
Yue W J, Wang Z H, Wang Q J, et al. Toxic effects of cypermethrin on algaeChattonella[J]. Asian Journal of Ecotoxicology, 2009, 4(2): 251-257 (in Chinese)
[38] 刘青, 张晓芳, 李太武. 光照对4种单胞藻生长速率、叶绿素含量及细胞周期的影响[J]. 大连水产学院学报, 2006, 21(1): 24-30
Liu Q, Zhang X F, Li T W. Impact of light on growth rate, chlorophyll content and cell cycle of four kinds ofChlamydomonas[J]. Journal of Dalian Fisheries University, 2006, 21(1): 24-30 (in Chinese)
[39] 聂湘平, 鹿金雁, 李潇, 等. 诺氟沙星(norfloxacin)对蛋白核小球藻(Chlorellapyrenoidosa)生长及抗氧化酶活性的影响[J]. 生态毒理学报, 2007, 2(3): 327-332
Nie X P, Lu J Y, Li X, et al. Growth and antioxidant enzyme activity of norfloxacin onChlorellapyrenoidosa[J]. Asian Journal of Ecotoxicology, 2007, 2 (3) : 327-332 (in Chinese)
[40] 王帅, 梁英, 田传远. Cd2+胁迫对6株微藻生长及叶绿素荧光特性的影响[J]. 海洋湖沼通报, 2009, 3: 155-166
Wang S, Liang Y, Tian C Y. Cd2+stress on six microalgae growth and chlorophyll fluorescence characteristics [J]. Transactions of Oceanology and Limnology, 2009, 3: 155-166

