贝伐珠单抗对HaCaT细胞凋亡及周期的影响
吴 倩魏志平刘彦群陈丹萍
贝伐珠单抗对HaCaT细胞凋亡及周期的影响
吴 倩1魏志平2∗刘彦群2陈丹萍3
目的: 评价贝伐珠单抗对HaCaT细胞凋亡的影响。方法: 体外培养HaCaT细胞,不同浓度贝伐珠单抗分别作用HaCaT细胞48 h后,Hoechst 33258荧光染色法观察贝伐珠单抗诱导HaCaT细胞凋亡的形态学变化;流式细胞术检测贝伐珠单抗HaCaT细胞凋亡及细胞周期的影响。结果: 贝伐珠单抗处理HaCaT细胞48 h后,Hoechst 33258荧光染色显示细胞核染色质凝聚、边集、核裂解;流式细胞术检测结果显示细胞凋亡增加,G0/G1期细胞的比例增加。结论: 贝伐珠单抗可诱导HaCaT细胞凋亡,同时可有效阻滞HaCaT细胞的周期进程,细胞周期被阻滞在G0/G1期。
HaCaT细胞; 贝伐珠单抗; 凋亡; 细胞周期
贝伐珠单抗(Bevacizumab)又叫安维汀(Avastin)、阿瓦斯丁,是重组的人源化IgG1单克隆抗体,靶向作用于肿瘤赖以生存的血管,通过抑制肿瘤血管生成,达到阻止肿瘤生长的目的。体内、外研究证实贝伐珠单抗能与VEGF结合,阻止其与内皮细胞表面受体结合,从而阻断其生物活性发挥抗血管增生作用。贝伐珠单抗目前在临床上已经应用于以联合5-氟尿嘧啶为基础的化疗方案,一线治疗转移性结肠直肠癌。在一些以血管增生为基础的疾病,如视网膜血管增生等疾病的治疗中也进行了临床研究并取得良好效果。1近年的研究表明靶向作用于银屑病病理性血管生成可明显改善银屑病免疫学和表皮的变化,且在临床治疗中也观察到应用贝伐珠单抗治疗癌症的同时患者的银屑病症状可得到明显改善。2但贝伐珠单抗对角质形成细胞的生物学作用及其机制尚未阐明。本实验以HaCaT细胞为角质形成细胞模型,研究贝伐珠单抗对HaCaT细胞凋亡及其周期的影响,为其治疗银屑病提供实验和理论依据,试图为银屑病的临床治疗提供新的思路。
1 材料和方法
1.1 细胞与试验药物 人永生化角质形成细胞株(HaCaT细胞)购于武汉大学中国典型培养物保藏中心。贝伐珠单抗,规格100 mg/4 m L,购于Roche公司。
1.2 试剂 RPMI 1640购于美国Gibco公司;胎牛血清购于杭州四季青生物工程材料有限公司;Hoechst 33258染色液购于Beyotime公司;Annexin V-FITC凋亡检测试剂盒购于北京宝赛生物技术有限公司;细胞周期PI染液购于碧云天生物技术研究所。
1.3 HaCaT细胞培养及实验分组 HaCaT细胞常规培养于含10%胎牛血清的RPMI 1640培养液中,37℃,5%CO2饱和湿度培养箱中培养。实验选用对数生长期细胞。HaCaT细胞分组处理如下:I组:对照组,只加RPMI 1640培养液;II组:50μg/mL贝伐珠单抗组;III组:100μg/m L贝伐珠单抗组;IV组:200 μg/mL贝伐珠单抗组;V组:400μg/mL贝伐珠单抗组;贝伐珠单抗用RPMI 1640培养液稀释至所需浓度。
1.4 方法
1.4.1 Hoechst 33258染色观察细胞凋亡 (1)配制Hoechst 33258工作液取试剂盒中Hoechst 33258原液用蒸馏水稀释10倍,即得Hoechst 33258工作液。(2)调整HaCaT细胞浓度为1×104/mL,以每孔1 mL接种于24孔培养板,待细胞贴壁后加入不同浓度贝伐珠单抗,分组同上,培养48 h后小心吸除上清,用预冷的PBS溶液洗涤细胞两次。(3)加入1 mL的4%甲醛溶液,4℃固定细胞10 min。(4)用预冷的PBS溶液洗涤2次,爬片水纸吸尽周边的水分。(5)每孔滴加100μL Hoechst 33258工作液,室温避光染色10 min,PBS溶液冲净晾干。(6)以340 nm紫外光激发,荧光显微镜下观察细胞凋亡形态并拍照。
1.4.2 流式细胞术检测贝伐珠单抗对HaCaT细胞凋亡的影响 选用对数生长期细胞,以1×105/mL接种于6孔板,每孔2 mL,培养24 h后更换无血清RPMI 1640培养基,细胞分组同上,每组设3个复孔,48 h后收集细胞进行检测,具体步骤如下:(1)弃培养基,用1×PBS清洗1次;(2)每孔加入1 mL 0.25%胰酶消化5 min;(3)每孔加入1 mL含血清培养基终止胰酶消化,微量移液器吹打细胞使其脱落;(4)细胞计数,取5×105或1×106个细胞移至离心管,1000 r/ min,4℃离心10 min,弃上清;(5)加入1 mL 4℃预冷的PBS,轻轻震荡使细胞悬浮;(6)1000 r/min,4℃离心10 min,弃上清;(7)重复步骤(5)(6)洗涤两次;(8)将细胞重悬于200μL Binding Buffer并移至流式管中;(9)加入10μL Annexin V-FITC轻轻混匀,避光室温反应15 min;(10)上机前5 min加入300μL Binding Buffer以及5μLPI;(11)流式细胞仪检测,分析并储存凋亡图。
1.4.3 流式细胞术检测贝伐珠单抗对HaCaT细胞周期的影响 选用对数生长期细胞,以1×105/m L接种于6孔板,每孔2 mL,培养24 h后更换无血清RPMI 1640培养基,细胞分组同上,每组设3个复孔,48 h后收集细胞进行检测,具体步骤如下:(1)PBS洗两次,0.25%胰酶消化;(2)加含血清的培养基终止消化,移液枪吹打细胞使其脱落;(3)将细胞悬液移至离心管内离心1000 r/min,5 min,弃上清;(4)轻拍离心管使细胞脱离管壁,加入2 mL预冷的PBS;(5)1000 r/min,离心5 min,弃上清;(6)重复步骤(5)(6)洗涤两次;(7)轻拍离心管使细胞脱离管壁,加入1 mL预冷PBS,轻轻吹匀;(8)在5个新的离心管内加入3 m L-20℃预冷的无水乙醇;(9)将(8)中的细胞悬液高速震荡下缓慢加入(9)中的离心管中;(10)-20℃冰箱中固定保存,待测;(11)-20℃冰箱取出样本,1000 r/min,离心5 min,弃上清;(12)轻拍试管使细胞脱离管壁,加入3 mL PBS,水合15 min;(13)1000 r/min,离心5 min,弃上清;(14)轻拍离心管使细胞脱离管壁,加1 mL PI染液,震荡混匀5~10 s,室温孵育30 min;(15)流式细胞仪上样检测,分析并储存周期时相图。
1.5 统计学方法 采用SPSS 13.0统计软件进行分析,计量资料用¯x±s表示。多个均数比较采用单因素方差分析(One-way ANOVA)。相关分析用Pearson相关分析,相关性用相关系数r表示。P<0.05为差异有统计学意义。
2 结果
2.1 Hoechst 33258荧光染色结果 见图1。本实验研究结果表明对照组HaCaT细胞的胞核完整,呈圆形或椭圆形,荧光染色较浅且较均匀,未观察到凋亡的形态学改变;50μg/mL、100μg/mL、200μg/mL、400μg/mL贝伐珠单抗处理后,HaCaT细胞核染色质高度凝聚、固缩,部分核染色质边集,或呈碎块状致密染色的凋亡形态学变化。
2.2 贝伐珠单抗对HaCaT细胞凋亡的影响 见表1、图2。贝伐珠单抗作用HaCaT细胞48h后,流式细胞术检测结果表明贝伐珠单抗可诱导HaCaT细胞发生凋亡,与对照组相比差异有统计学意义(P<0.05)。随着贝伐珠单抗浓度的增加HaCaT细胞凋亡率逐渐增加(r=0.954,P<0.05),其中400μg/mL贝伐珠单抗组诱导细胞凋亡的作用最强。

表1 贝伐珠单抗对HaCaT细胞凋亡的影响
2.3 贝伐珠单抗对HaCaT细胞凋亡的影响 见表2、图3。贝伐珠单抗作用HaCaT细胞48 h后,流式细胞术检测结果表明各浓度贝伐珠单抗组G0/G1期的细胞比例不同程度的增加,与对照组相比差异有统计学意义(P<0.05)。实验结果表明贝伐珠单抗可有效阻滞HaCaT细胞的周期进程,细胞周期被阻滞在G0/ G1期,尤以400μg/mL贝伐珠单抗组作用最强。
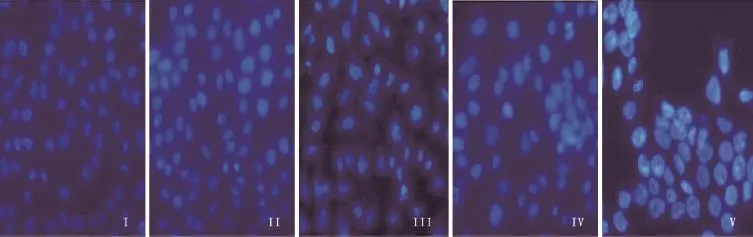
图1 HaCaT细胞凋亡形态学改变(Hoechst 33258荧光染色,×400)

图2 不同浓度贝伐珠单抗对HaCaT细胞凋亡的影响

图3 不同浓度贝伐珠单抗对HaCaT细胞周期变化的影响
3 讨论
银屑病的主要病理学特点是表皮角质形成细胞过度增殖、分化异常(角化不全);表皮与真皮间显著炎细胞浸润;真皮乳头层内微血管迂曲、扩张、增生。3角质形成细胞是表皮的主要构成细胞,数量占表皮细胞的80%以上。银屑病患者皮损处角质形成细胞抵抗细胞凋亡的能力增强,可能是银屑病发病机制中的关键因素之一。4
贝伐珠单抗目前主要作为抗血管增生药物用于肿瘤的临床治疗,主要机制是阻滞VEGF与内皮细胞受体结合,抑制内皮细胞的增殖从而发挥抗血管增生作用。现已证实HaCaT能够自身分泌VEGF并与细胞表面的VEGF受体结合从而发挥其生物学效应。5贝伐珠单抗作为抗VEGF的IgG1单克隆抗体,对角质形成细胞的生物学作用及其机制尚不清楚。

表2 贝伐珠单抗对HaCaT细胞细胞周期变化的影响
本实验采用Hoechst33258荧光染色在光学显微镜下观察细胞凋亡的形态学变化,结果显示贝伐珠单抗作用于HaCaT细胞48 h后细胞开始出现较明显的凋亡形态学表现,HaCaT细胞核染色质高度凝聚、固缩,部分核染色质边集,或呈碎块状致密染色,而对照组无明显变化。本实验采用流式细胞术AnnexinVFITC双染方法检测各实验组HaCaT细胞的凋亡率,结果表明贝伐珠单抗可以促进角质形成细胞的凋亡,且随着药物浓度的增加细胞的凋亡率逐渐升高。
凋亡是细胞在生理或病理条件下,一种由基因调控的主动性自我消亡过程,在不引起有害炎症反应的基础上清除功能失调或衰老的细胞。凋亡这种独特的功能在保持皮肤不断更新的组织稳态中起着关键的作用,控制着角质形成细胞的增殖和角质层的形成。6凋亡的失调在增殖性疾病如癌症或银屑病的发生、维持和发展中起到重要作用,4而细胞凋亡的平衡有助于过度增殖的角质形成细胞恢复稳态并使表皮结构正常化。所以抑制角质形成细胞增殖、诱导其凋亡的药物可能具有治疗银屑病的潜力。
本实验采用流式细胞仪检测细胞周期,结果显示贝伐珠单抗作用细胞48 h后,细胞周期中G0/G1期比例明显增高,各药物浓度组与对照组相比差异具有统计学意义,说明贝伐珠单抗可影响HaCaT细胞细胞周期,把细胞阻滞在G0/G1期,抑制DNA的合成。
一系列的研究证明VEGF的另一个重要作用就是作为一种促存活因子,可以促进角质形成细胞的存活。7,8Zhu等9的研究进一步证实了角质形成细胞的存活主要是VEGF通过激活其受体信号来实现的,并且推测受体的激活在促进细胞的存活上起到部分作用。本实验研究结果表明贝伐珠单抗可诱导HaCaT细胞凋亡,这与Videira等10研究中发现的贝伐珠单抗诱导膀胱癌细胞凋亡的结果相似,我们推测这可能是贝伐珠单抗阻滞VEGF发挥其生物学活性,使得通过激活受体信号的促细胞存活作用无法实现,从而促进了细胞的凋亡。Videira等10研究中发现贝伐珠单抗可以阻滞膀胱癌细胞的细胞周期,同时发现在不同的膀胱癌细胞株中贝伐珠单抗阻滞细胞周期的作用位点有显著的差异,我们推测贝伐珠单抗对细胞周期的阻滞可因细胞的不同而发生变化,杨晓红等11证实贝伐珠单抗可通过抑制内源性VEGF生物学作用抑制HaCaT细胞的增殖,结合前面本实验所得到的结果我们推测,贝伐珠单抗抑制细胞的增殖作用也有可能是通过阻滞细胞周期抑制DNA合成实现的。贝伐珠单抗对HaCaT细胞确切的作用机制还有待于进一步研究。
1 Hernan CF.The role of antiangiogenesis therapy:Bevacizumab and beyond.Clin Transl Oncol,2009,11(6):349-355.
2 Akman A,Yilmaz E,Mutlu H,et al.Complete remission of psoriasis following bevacizumab therapy for colon cancer.Clin Exp Dermatol,2009,34(5):202-204.
3 Nestle FO,Kaplan DH,Barker J.Psoriasis.N Engl JMed,2009,361(5):496-509.
4 Kastelan M,Prpic-Massari L,Brajac I.Apoptosis in psoriasis. Acta Dermatovenerol Croat,2009,17(3):182-186.
5Elias PM,Arbiser J,Brown BE,et al.Epidermal vascular endothelial growth factor production is required for permeability barrier homeostasis,dermal angiogenesis and the developmentof epidermal hyperplasia:implications for the pathogenesis of psoriasis.Am JPathol,2008,173(3):689-699.
6 Bowen AR,Hanks AN,Allen SM,et al.Apoptosis regulators and responses in human melanocytic and keratinocytic cells.J Invest Dermatol,2003,120(1):48-55.
7 Byrne AM,Bouchier-Hayes DJ,Harmey JH.Angiogenic and cell survival functions of vascular endothelial growth factor (VEGF).JCell Mol Med,2005,9(4):777-794.
8 Sanchez A,Wadhawani S,Grammas P.Multiple neurotrophic effects of VEGF on cultured neurons.Neuropeptides,2010,44: 323-331.
9 Zhu JW,Wu WJ,Luo D,etal.Activation of VEGFR-2 signaling in response tomoderate dose of ultraviolet B promotes survival of normal human keratinocytes.Int J Biochem Cell Biol,2012,44(1):246-256.
10 Videira PA,Piteira AR,Gabral MG,et al.Effects of bevacizumab on autocrine VEGF stimulation in bladder cancer cell lines.Urol Int,2011,86(1):95-101.
11杨晓红,满孝勇,蔡绥勍,等.VEGF在HaCaT细胞中的自分泌作用.浙江大学学报,2009,38(4):338-342.
(收稿:2013-09-05 修回:2013-11-15)
Effect of Bevaiczumab on apoptosis and proliferation of HaCaT cells
WU Qian,WEIZhi-ping,LIU Yan-qun,et al.Xuzhou Children'sHospital,Xuzhou,221006
Objective:To investigate the effects of Bevacizumab on apoptosis of HaCaT cells.Methods: HaCaT cells were cultured and treated with Bevacizumab in different concentration(50μg/m l、100μg/m l、200μg/m l、400μg/m l).Themorphological change of HaCaT cells was tested by Hoechst 33258 fluorescent staining.The effects of Bevacizumab on apoptosis of HaCaT cells were detected by flow cytometry.Results: After treated with Bevacizumab for 48 h,the HaCaT cells showed typicalmorphological changes of apoptosis such as chromatin condensation,chromatin margination and nuclei fragments.The results of flow cytometry showed an increase in apoptosis of the cells and the ratio of G0/G1 phase cells was also increased.Conclusion:Bevacizumab can induce apoptosis of HaCaT cells in vitro,and block cell cycle process effectively and arrest the cell cycle at G0/G1 phase.
HaCaT cells;Bevacizumab;apoptosis;proliferation
1徐州市儿童医院,江苏徐州,221006
2徐州医学院附属医院皮肤科,江苏徐州,221000
3靖江市人民医院皮肤科,江苏泰州靖江,214500
∗通信作者

