L-氨基胍对体外培养退变椎间盘细胞中炎性因子水平的影响
符 俏,虞乐华
(1.重庆医科大学附属第二医院康复医学科,重庆 404100;2.海南省人民医院康复医学科,海南 海口 570311)
椎间盘组织退行性改变是脊椎疾病最基本的病理变化,是导致腰腿痛常见的原因之一。椎间盘发生退行性变时,髓核组织暴露可导致机体免疫炎性反应,导致退变的椎间盘组织中有大量免疫炎性细胞因子的表达[1-4],炎症因子白细胞介素1(IL-1)、白细胞介素6(IL-6)和肿瘤坏死因子α(TNF-α)在椎间盘退变的发生发展过程中发挥极其重要的作用[2-5],而一氧化氮合成酶(NOS)可以调控炎性因子表达[6]。NOS抑制剂L-氨基胍(L-AG)具有显著的消炎、抗渗出和改善微循环等药理作用,临床应用广泛,但目前少见NOS抑制剂用于椎间盘退变治疗的相关报道。基于此,本实验对L-AG的体外抑制退变椎间盘细胞炎性反应的效果进行了研究,以期为椎间盘退变的临床治疗提供新思路。
1 材料与方法
1.1 主要试剂 L-AG购于中国药品生物制品检定所;胎牛血清、达尔伯克必需基本培养基(DMEM)购于Invitrogen公司,NO、NOS试剂盒购于南京建成公司,IL-1、IL-6、TNF-α和GAPDH一抗为武汉博士德公司生产,辣根过氧化物酶(HRP)标记的抗小鼠IgG二抗为Promega公司生产,增强化学发光试剂盒(ECL)购于Millipore公司,Bradford法蛋白定量试剂盒购自北京中杉金桥公司。
1.2 椎间盘细胞分离培养 椎间盘组织样本取自重庆医科大学附属第二医院住院病例,男性及女性各3例,年龄26~38岁,病史5~16个月。MR检查显示:突出物明显压迫神经根,标本均在手术中切取,其中L2-32例,L3-44例,椎间盘突出组织中均含不同比例的髓核和纤维环。椎间盘组织标本在无菌条件下反复冲洗数遍,以去除其表面血细胞,之后将纤维环和髓核剪成约1mm×1mm×1mm大小组织块,胰蛋白酶(0.25%)和Ⅱ型胶原酶(0.2%)交替消化,D-Hank’s液冲洗,离心,加入适量的DMEM培养液,计数后将细胞以(1~2)×105浓度接种于培养板,置于37℃、5%CO2的细胞培养箱中培养,隔日更换10%胎牛血清培养液,细胞达到60%铺满瓶底后,各组中加入用DMEM培养液稀释配成的0、0.5%、1.0%、1.5%的L-AG工作液,分别为对照组和0.5%、1.0%、1.5%L-AG组,共同孵育72h,收取上清液,离心后-20℃保存待测。
1.3 分光光度法检测NO和NOS水平 按照NOS活性检测试剂盒和NO检测试剂盒说明书进行操作,检测各组椎间盘细胞中NOS活性和NO水平。
1.4 免疫印迹法检测IL-1、IL-6和TNF-α蛋白表达 分别用溶剂(对照组)和上述各浓度L-AG(药物组)处理椎间盘细胞24h后,免疫印迹法检测IL-1、IL-6和TNF-α蛋白表达水平,GAPDH作为内参蛋白,按照如下步骤进行操作:处理后收集细胞,4℃预冷PBS液洗3次,加入细胞蛋白提取液(50mmol·L-1This-HCl,pH=7.4;1%Triton X-100,0.2mmol·L-1PMSF,1mmol·L-1EDTA),4℃、12000r·min-1离心10min,吸取上清,10%聚丙烯酰胺凝胶电泳进行蛋白分离,上样量为每孔10μL,之后将蛋白从聚丙烯酰胺凝胶转到PVDF膜上,封闭,不同浓度稀释一抗IL-1(1∶500)、IL-6(1∶500)、TNF-α(1∶500)或GAPDH(1∶2500)孵育,4℃过夜,HRP标记抗鼠/兔IgG二抗常温孵育1h,经ECL孵育,暗室内X光胶片成像,GelPro软件进行图像分析,原始结果为蛋白条带光密度(A)值,应用内参蛋白GAPDH进行标准化,最后以对照组为1,计算各浓度L-AG组相对于对照组的表达水平(最后结果为相对值)。每组重复6次。
1.5 统计学分析 采用SPSS 18.0软件进行统计分析。NOS、NO、IL-1、IL-6和TNF-α检测结果以表示,多组间的比较采用单因素方差分析,两两比较采用SNK检验。
2 结 果
2.1 各组椎间盘细胞中NOS活性和NO水平 与对照组比较,各浓度L-AG组NOS活性和NO水平明显降低,差异均有统计学意义(P<0.01)。见表1。
表1 各组椎间盘细胞NOS活性和NO水平Tab.1 NOS activities and NO levels in intervertebral disc cells in various groups(n=6,)

表1 各组椎间盘细胞NOS活性和NO水平Tab.1 NOS activities and NO levels in intervertebral disc cells in various groups(n=6,)
*P<0.01compared with control group.
GroupNOS[λB/(U·mL-1)]NO[cB/(μmol·L-1)]Control 7.6±0.7156.1±9.2 L-AG 0.5%6.1±0.5*128.3±7.2*1.0%5.5±0.6*116.5±6.9*1.5%4.2±0.5*97.7±6.6*
2.2 各组椎间盘细胞中IL-1、IL-6和TNF-α表达水平 24h后与对照组比较,0.5%、1.0%和1.5%L-AG组椎间盘细胞中IL-1、IL-6和TNF-α表达水平明显下降,差异有统计学意义(P<0.01),且L-AG作用后椎间盘细胞中IL-1、IL-6和TNF-α表达变化均呈现明显的剂量-效应关系,随L-AG浓度升高,IL-1、IL-6和TNF-α表达水平呈下降趋势。见图1及表2。
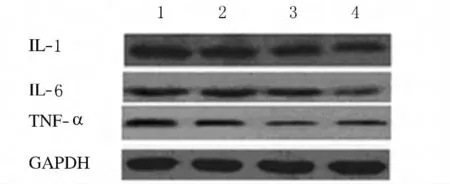
图1 各组椎间盘细胞中IL-1、IL-6和TNF-α的表达Fig.1 Expressions of IL-1,IL-6,and TNF-αin intervertebral disc cells in various groups
表2 各组椎间盘细胞中IL-1、IL-6及TNF-α表达水平Tab.2 Expression levels of IL-1,IL-6,and TNF-αin intervertbral disc cells in various groups(n=6,)

表2 各组椎间盘细胞中IL-1、IL-6及TNF-α表达水平Tab.2 Expression levels of IL-1,IL-6,and TNF-αin intervertbral disc cells in various groups(n=6,)
*P<0.01compared with control group.
GroupIL-1[ρB/(μg·L-1)]IL-6[ρB/(μg·L-1)]TNF-α[cB/(pmol·L-1)]Control 2.3±0.61.2±0.25.7±1.0 L-AG 0.5%1.8±0.3*0.9±0.1*4.3±0.7*1.0%1.4±0.2*0.7±0.1*2.9±0.6*1.5%0.9±0.1*0.4±0.1*2.2±0.4*
3 讨 论
NOS是NO合成中的关键酶及限速酶,目前研究发现其共有3种同工酶:神经元型合成酶(nNOS)、诱导型合成酶(iNOS)及内皮型合成酶(eNOS)。iNOS通过催化L-精氨酸与氧分子反应生成NO,NO可通过自分泌或旁分泌方式作用于椎间盘细胞,参与椎间盘退行性改变发生发展过程。L-AG是胍类的NOS抑制剂,能够选择性且持续性地抑制iNOS。研究[6]表明:IL-1、IL-6和TNF-α与iNOS活性密切相关。另外,L-AG具有显著的消炎、抗渗出和改善微循环等药理作用,临床应用广泛。基于此,本研究探讨了L-AG对体外退变椎间盘组织中炎性因子水平的影响。
退变椎间盘细胞可产生IL-1、IL-6和TNF-α等多种炎性因子,炎性因子又可进一步加剧椎间盘退变的进程,二者互为因果[7]。机体中IL-1、IL-6和TNF-α介导的炎症反应是创伤、感染反应的基本部分,但在炎症免疫反应过程中炎性因子的过量释放,可导致组织损伤[8-9]。阻断炎性细胞因子的过量产生,则能阻止损害性炎症反应的发生和发展。椎间盘退行性改变主要表现为髓核蛋白多糖以及胶原强度的降低。研究[1,10]发现:炎性因子在椎间盘退行性病变中发挥着关键作用。IL-1和IL-6可由单核-巨噬细胞、纤维母细胞及软骨细胞等多种细胞合成分泌,在退变椎间盘组织中可见以巨噬细胞为主的炎性细胞浸润[11-12],通过刺激椎间盘组织金属蛋白酶(MMPs)分泌及抑制基质中蛋白多糖的产生,促进椎间盘组织退变的发生发展过程[13]。TNF-α是一种主要由激活的单核-巨噬细胞分泌的炎性细胞因子。研究[14-15]证明:TNF-α参与椎间盘退变过程,且在椎间盘退变过程中扮演关键性角色,TNF-α可导致蛋白多糖和胶原的降解,并减少其合成,进而加剧了椎间盘退变进展过程。本研究结果表明:L-AG可显著抑制退变椎间盘细胞中NOS活性与NO水平,并且还对退变椎间盘细胞中IL-1、IL-6和TNF-α等炎性介质的释放具有明显抑制作用。
综上所述,NOS抑制剂L-AG具有显著抑制退变椎间盘细胞炎性反应的作用,有临床治疗椎间盘退变潜在价值,其作用机制及在体应用效果值得深入探索。细胞因子相互之间有复杂的关系,在椎间盘退变发生发展的过程中,L-AG所致的NO水平下降是否起着最关键的主导作用仍然有待进一步深入研究。
[1]Yoshida M,Nakamura T,Sei A,et al.Intervertebral disc cells produce tumor necrosis factor alpha,interleukin-1beta,and monocyte chemoattractant protein-1immediately after herniation:an experimental study using a new hernia model[J].Spine,2005,30(1):55-61.
[2]彭宝淦,贾连顺,侯树勋,等.颈椎病发病机制的研究[J].颈腰痛杂志,2001,22(1):1-4.
[3]唐 田,谢 林.颈椎间盘退变机制研究进展[J].中医学报,2013,28(5):747-749.
[4]吴鹏波,胡振武,马卫华,等.椎间盘退变机制研究进展[J].咸宁学院学报:医学版,2011,24(2):175-177.
[5]俞海明,李毅中,林金矿,等.环氧化酶2与血管内皮生长因子在突出腰椎间盘中的表达及意义[J].中国脊柱脊髓杂志,2007,17(10):777-780.
[6]Yang J,Hu XH,Liu Cw,et al.Inhibition of nuclear factor kappa B attenuates multiple organ injury following ruptured abdominal aortic aneurysm:an experiment with rats[J].Zhonghua Yi Xue Za Zhi,2006,86(4):237-241.
[7]Kallg JD,Racic MS,Mclntyre LA,et al.Torward a biochemical understanding of human intervertebral disc degeneration and herniation[J].Spine,1997,22(10):1065-1073.
[8]Kim SD,Park JM,Kim IS,et al.Association of IL-1beta,IL-1ra,and TNF-alpha gene polymorphisms in childhood nephrotic syndrome[J].Pediatr Nephrol,2004,19(3):295-299.
[9]Zachwieja J,Bobkowski W,Dobrowolska Zachwieja A,et al.Intracellular cytokines of peripheral blood lymphocytes in nephrotic syndrome[J].Pediatr Nephrol,2002,17(9):733-740.
[10]Haro H,Shinomiya K,Komori H,et al.Upregulated expression of chemokines in herniated nucleus pulposus resorption[J].Spine,1996,21(14):1647-1652.
[11]Akyol S,Eraslan BS,Etyemez H.Catabolic cytokine expressions in patients with degenerative disc disease[J].Turk Neurosurg,2010,20(4):492-499.
[12]Lee S,Moon CS,Sul D,et al.Comparison of growth factor and cytokine expression in patients with degenerated disc disease and herniated nucleus pulposus[J].Clin Biochem,2009,42(15):1504-1511.
[13]Richardson SM,Doyle P,Minogue BM.Increased expression of matrix metalloproteinase-10,nerve growth factor and substance P in the painful degenerate intervertebral disc[J].Arthritis Res Ther,2009,11(4):R126.DOI:10.1186/ar2793.
[14]唐 淼,陈惠德,张文芽.TNF-α、IL-1β在退变颈椎间盘的表达和意义[J].安徽医药,2011,15(2):192-194.
[15]赵太茂,刘 淼,赵 文,等.TNF-α、IL-1β在腰椎间盘突出症中致痛作用的研究[J].颈腰痛杂志,2010,31(3):174-176.
