1株具有抗根结线虫活性的红树林土壤放线菌的分离与鉴定
陈雨晴黄惠琴刘敏鲍时翔
(1.海南大学环境与植物保护学院,海口 570228;2.中国热带农业科学院热带生物技术研究所 农业部热带作物生物学与遗传资源利用重点实验室,海口 571101)
1株具有抗根结线虫活性的红树林土壤放线菌的分离与鉴定
陈雨晴1,2黄惠琴2刘敏2鲍时翔2
(1.海南大学环境与植物保护学院,海口 570228;2.中国热带农业科学院热带生物技术研究所 农业部热带作物生物学与遗传资源利用重点实验室,海口 571101)
采用平板稀释法,从海南省东寨港红树林根际土壤中分离得到110株放线菌;利用24孔板液体筛选模型,筛选出具有抗线虫活性的放线菌菌株HA10401。该菌株发酵液在稀释20倍和40倍时,抗根结线虫校正死亡率分别为58.2%和52.6%。通过16S rDNA基因序列分析,菌株HA10401与链霉菌属菌株 Streptomyces variabilis同源性最高(99.8%),在系统发育树上聚在同一分支内,亲缘关系最近。二者在形态特征、培养特征以及生理生化特征方面也基本一致,因此,鉴定菌株HA10401为变异链霉菌(Streptomyces variabilis)。本研究首次报道了其抗根结线虫活性,值得进行更为深入的研究。
红树林 放线菌 鉴定 根结线虫
根结线虫是一类固着型内寄生植物病原线虫,在很多国家和地区均有发生,每年给全世界的农林、园艺等产业带来巨大的经济损失[1]。根结线虫病害在我国发生极为普遍,粮食作物、蔬菜、果树、花卉等2 000多种植物几乎均可受到侵染[2],温带、亚热带和热带地区遭受病害尤为严重,有时作物的减产量可达到70%以上[3]。根结线虫的防治非常困难,传统的轮作、抗病育种方法并不能稳定、高效地抵抗根结线虫,而常使用的化学方法则会造成严重的环境污染[4]。因此,寻找一种比较科学的方法来防治根结线虫极为重要,人们希望探索一些高效、低毒、低残留并具有高选择性的杀线剂。近年来,
生物防治越来越受到重视[5],从微生物的代谢产物中分离具有抗线虫活性物质已成为最具有潜力的防治途径之一。
放线菌在自然界中广泛分布,且是抗生素的主要来源,近几十年来具有生物活性的天然产物中,45%来自于放线菌[6],它们能有效抑制某些危害农作物的细菌、病毒和真菌等,被大量用于生物防治[7],其中由放线菌产生的阿维菌素(Avermectins)已经在抗线虫方面得到了广泛的应用[8]。利用放线菌的次生代谢产物制备无污染、无残留、可再生、难以使线虫产生抗药性的新型杀线虫药剂,已经成为未来农药的重点发展方向[9]。红树林作为一种分布于热带和亚热带的特殊海岸潮间带生态系统,周期性受潮水侵蚀,具有高水分、高盐分、寡营养等特点,蕴含极为丰富且极具特色的微生物资源[10],近年来关于红树林抗线虫放线菌资源的开发已取得了广泛的进展。魏华等[11]从海南东寨港红树林采集的土壤样品中分离得到具有杀线虫活性的放线菌Saccharopolyspora jiangxiensis,在菌株发酵液稀释20倍后,抗根结线虫校正死亡率高达70.5%;黄惠琴等[12]从该环境土壤样品中筛选出一株具有较强抗根结线虫放线菌Streptomyces aculeolatus,其抗根结线虫活性也是首次被报道;Zeng等[13]从放线菌Streptomyces albogriseolus中分离得到新型活性化合物制霉色基素(Fungichromin B),进一步研究显示该化合物具有广泛的抗虫谱。这些研究均表明了红树林抗根结线虫放线菌资源的丰富性,大量潜在的高效抗线虫资源还有待开发。本试验从海南文昌东寨港红树林根际土壤中分离并筛选出具有高效抗根结线虫活性的放线菌菌株,并对其进行形态、生理生化和分子鉴定,旨为新型抗线虫药剂的进一步开发提供依据。
1 材料与方法
1.1 材料
1.1.1 土样的采集 于2012年11月从海南东寨港的几种不同红树根际采集土壤样品,按照五点采样法,分别采集0-5、5-10、10-20 cm深处的土壤样品,混匀后装入无菌袋内,并置入冰盒中于4 h内带回实验室处理。
1.1.2 培养基[14]分离培养基:腐植酸-维生素(HV)培养基、高氏一号培养基、淀粉-天门冬素培养基,倒平板前向培养基中加入过滤除菌的100 μg/mL制霉菌素和100 μg/mL重铬酸钾,以抑制细菌和真菌的生长;发酵培养基:酵母粉-淀粉液体培养基(玉米粉1.0%、酵母粉0.1%、黄豆粉1.0%、淀粉0.5%、KH2PO40.05%,pH7.2)。形态特征鉴定培养基:高氏一号合成培养基、酵母粉-淀粉培养基、燕麦汁培养基(ISP3)、土豆汁培养基、无机盐淀粉培养基(ISP4)和甘油天门冬素培养基(ISP5)。培养基使用70%陈海水与30%蒸馏水配制。
1.1.3 供试线虫 初筛时使用松材线虫,将松材线虫接种于长有镰刀菌的PDA培养基上,28℃恒温培养5 d;复筛时使用根结线虫,将含有卵块的胡椒根冲洗干净,使用灭菌牙签挑取卵块置于无菌水中28℃培养孵化,收集备用。
1.2 方法
1.2.1 放线菌的分离 使用3种预处理方法(1)风干:将采集的土壤样品自然风干1周;(2)干热:风干样品120℃干热处理1 h;(3)湿热:风干样品55℃水浴6 min。称取处理样品5 g,加入灭菌陈海水45 mL,180 r/min恒温震荡30 min制成水悬液,室温静置10 min使土壤沉淀,使用无菌陈海水将上清液稀释至10-1、10-2、10-3倍,各吸取100 μL稀释液涂布到分离培养基上,每个稀释度3次重复。将平板于28℃下恒温培养2-4周,待长出明显菌落,挑取菌落在高氏一号培养基上进行纯化,纯化菌株用20%甘油冻存于-80℃冰箱。
1.2.2 菌株的发酵培养 将纯化后的菌株挑取单菌落接种于液体发酵培养基中,置于28℃摇床中200 r/min培养约7 d,10 000 r/min离心2 min后,吸取上清液备用。
抗线虫放线菌的筛选 线虫的初筛和复筛均采用24孔板液体筛选模型[15]。初筛时,在每孔中加入400 μL(约200条)松材线虫液、550 μL无菌水和50 μL发酵液,混合均匀,置于28℃恒温培养箱中培养24 h 后用倒置显微镜观察,僵直或卷曲不动的线虫视为被击倒,以发酵培养基为对照,每个试验重复3次,计算校正击倒率和校正死亡率。向24孔
板中加入清水观察线虫恢复情况,不能恢复活性的视为死亡。
3.1 PBL和CBL基于MOOC概念的混合开放在线课程(MOOC)是指通过MOOC,使得不过在哪里都可以共享丰富的学习资源,包括关于超声医学相关课程内容的文本以及重要知识点的归纳。所谓MOOC概念的混合式教学法是指网络教学、LBL、问题学习PBL、CBL等在MOOC平台上的汇集成一个整体。它分为基础理论阶段和实践阶段。激发学生的兴趣爱好是第一阶段的侧重点。虽然LBL非计算机专业仍是目前教育模式的主体,但是在利用动态图像及视频等相关技术手段时,应当注意适度添加教师面部特征以及教师适中的语速,不仅能够提高学生对学习知识的积极性和兴趣,也可以让学生充分利用业余时间进行预习、自学和实践。
校正击倒率(%)=(处理击倒率-对照击倒率)/(1-对照击倒率)×100%
校正死亡率(%)=校正击倒率×(1-恢复率)
对初筛中校正死亡率80%以上的菌株使用根结线虫进行复筛,方法同上,并将活性菌株继代培养5代,测试菌株发酵液的抗线虫遗传稳定性。
1.2.3 发酵液处理时间对线虫活性的影响 在不同的时间内(2、4、8、12 和 24 h)观察活性菌株的发酵液对线虫的影响,计算校正击倒率和校正死亡率。
1.2.4 菌株的形态和培养特征观察 形态特征:采用插片培养法[16]观察菌株的形态特征,28℃培养14 d,取出盖玻片分别在光学显微镜和电子显微镜下观察菌株形态特征。培养特征:将菌株接种于放线菌形态特征鉴定培养基上,28℃培养7-15 d,并记录菌株的气生菌丝、基内菌丝及色素产生情况等特征。
1.2.5 菌株的生理生化鉴定 分别对菌株的碳源利用、纤维素分解、H2S产生、黑色素产生、硝酸盐还原等方面进行生理生化测试[17],并分别在4、10、15、20、28、37、40、45℃条件下进行温度耐受性试验,分别在4.0、5.0、6.0、7.0、8.0和9.0的pH值下进行pH耐受性试验。以上测试均培养20 d,每5 d观察1次。
1.2.6 16S rDNA序列分析和进化树的构建 使用细菌基因组DNA 提取试剂盒提取菌株的总DNA,通用引物27f(5'-AGAGTTTGATCMTGCCTCAG-3')和1492r(5'-TACGGYTACCTTGTTACGACTT-3')用于进行PCR扩增菌株16S rDNA序列,PCR反应为50 μL体系:模板DNA 1 μL,2×Es Taq MasterMix 25 μL,正向引物1 μL,反向引物1 μL,ddH2O 22 μL。PCR反应条件为:94℃ 5 min,94℃ 1 min,55℃ 30 s,72℃ 1 min,30个循环,72℃ 10 min。PCR扩增产物使用1%凝胶电泳检测后,送至生工生物工程(上海)有限公司测序。测序结果提交至EzTaxon核酸序列库(http://eztaxon-e.ezbiocloud.net/)进行比对,使用MEGA5.0软件进行多序列比对,用Neighbor-Joining 法构建系统发育树[18]。
2 结果
本研究共分离得到110株放线菌,初筛时获得27株线虫校正死亡率在80%以上放线菌;复筛试验中将发酵液稀释40倍、处理时间24 h时,获得根结线虫校正死亡率在50% 以上的菌株 2株,其中菌株HA10401校正击倒率为58.4%,校正死亡率为52.6%;在发酵液稀释20倍时,校正死亡率上升到58.2%。对该菌株连续继代培养 5 次,发现其发酵液抗虫活性稳定。将稀释40倍的发酵液在不同的时间段内处理根结线虫,观察发酵液对线虫活性的影响情况。由图1可以看出,随着时间的延长,线虫校正死亡率表现出增长的趋势。

图1 处理时间对线虫死亡率的影响
2.2 活性菌株形态和生理生化特征
菌株HA10401在6种形态鉴定培养基上均生长良好,形成发达的气生菌丝和基内菌丝,气生菌丝呈灰色或灰白色,基内菌丝呈棕色或者黄色。孢子丝螺旋形,孢子卵形,表面带短刺。在6种培养基上均不产生明显的可溶性色素。
菌株HA10401能利用D-果糖、L-阿拉伯糖、L-鼠李糖、肌醇等,不能利用蔗糖、棉籽糖,不产生黑色素,淀粉水解、明胶液化、硝酸盐不还原,具体情况,见表1。
2.3 16S rDNA系统发育分析
将菌株HA10401的16S rDNA经PCR扩增后进行测序,得到长度为1 332 bp的序列(GenBank登录号KJ523176),将该序列与EzTaxon核酸序列库的相关菌株进行相似性比对,结果发现该菌株与Streptomyces variabilis NRRL B-3984T同源性最高,
为99.8%。选取9株同源性高的模式菌株,利用MEGA5.0软件构建系统发育树,结果如图2所示,菌株HA10401与菌株Streptomyces variabilis NRRL B-3984T在系统发育树上处于同一分支,亲缘关系最近。

表1 菌株 HA10401 的生理生化特征
2.4 菌株的鉴定结果
菌株HA10401与Streptomyces variabilis同源性最高(99.8%),且在发育树上处于同一个分支。HA-10401可以水解淀粉、纤维素,液化明胶,但不能还原硝酸盐;可以利用D-甘露醇、L-鼠李糖和L-肌醇,但不能利用蔗糖和棉籽糖。将菌株HA10401与Streptomyces variabilis的形态和生理生化特征进行比较[19],除了Streptomyces variabilis的最高生长温度为45℃,二者在各方面基本一致。综合以上形态、生理生化特征和16S rDNA序列分析[20],将菌株HA10401鉴定为Streptomyces variabilis。
3 讨论
松材线虫和根结线虫均为植物寄生性线虫,在生理结构、代谢规律和生活习性等方面有一定的相似性。根结线虫要从植物病根中获取,目前尚不能人工培养,不能满足大量的筛选需求[3],而松材线虫培养技术比较成熟,使用镰刀菌来培养松材线虫,繁殖时间短,易培养,可在短时间内(3-5 d)获得大量供试线虫,因此,本试验中使用松材线虫为初筛线虫,而根结线虫在复筛试验中才采用。
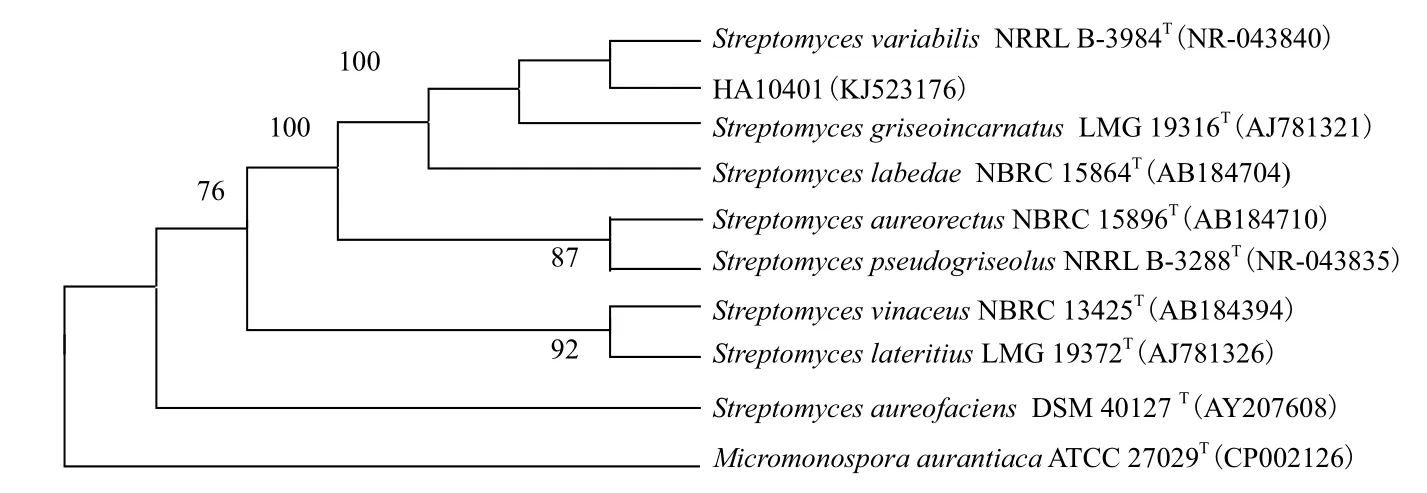
图2 基于16S rDNA的菌株HA10401与相关菌株的系统发育树
红树林由于生境的特殊性,具有丰富而独特的生物多样性和天然产物资源[21],在陆地天然产物的开发趋于饱和的状态下[22],具有更大的发现新型抗线虫产物的潜力。根据菌株HA10401的形态特征、生理生化特征和16S rDNA 系统发育分析结果,将其鉴定为Streptomyces variabilis。曾有报道从该菌发酵液中分离到新型抗生素variapeptin,该复合物能有效对抗革兰氏阳性菌,并对哺乳动物显示有细胞毒性[23];Pan等[24]从Streptomyces variabilis中分离的天然产物ammosamide D也对MIA PaCa-2胰腺癌细胞系有一定的细胞毒性。而关于该菌株的抗根结线虫活性在本研究中进行了首次报道,具有进一步开发的潜能。
4 结论
本试验从海南东寨港红树林植物根际土壤中分离放线菌,采用24孔板液体筛选模型筛选出具有较高抗线虫活性的放线菌菌株HA10401。该菌株发酵液在稀释40倍、处理时间24 h时,线虫校正击倒率为58.4%,校正死亡率为52.6%,在发酵液稀释20倍时,校正死亡率为58.2%。对菌株HA10401的形态学和生理生化鉴定结果显示,其孢子丝螺旋形,孢子卵形,表面带短刺,能利用D-甘露醇、L-
鼠李糖和L-肌醇等,但不能利用蔗糖和棉籽糖,能水解淀粉、纤维素,明胶液化。菌株的16S rDNA序列与Streptomyces variabilis NRRL B-3984T同源性最高(99.8%),在系统发育树上处于同一分支。综合形态、生理生化特征及16S rDNA序列分析,将菌株HA10401鉴定为变异链霉菌(Streptomyces variabilis)。
[1]史学群, 宋海超, 刘柱. 海南省土壤拮抗放线菌分离方法初探[J]. 中国农学通报, 2006, 22(10):431-435.
[2]曾庆飞. 根结线虫拮抗放线菌的筛选及菌株HA10002和DA09202活性物质的研究[D]. 海口:海南大学, 2011.
[3]刘维志. 植物病原线虫学[M].北京:中国农业出版社, 2000:56-58.
[4]汪来发, 杨宝君, 李传道. 根结线虫生物防治研究进展[J].南京林业大学学报:自然科学版, 2002, 26(1):64-68.
[5]孔祥义, 陈绵才. 根结线虫病防治研究进展[J]. 热带农业科学, 2006, 26(2):83-88.
[6]Davies J. Specialized microbial metabolites:functions and origins[J]. The Journal of Antibiotics, 2013, 66(7):361-364.
[7]Berdy J. Bioactive microbial metabolites[J]. The Journal of Antibiotics, 2005, 58(1):1-26.
[8]蒋琳, 马承铸. 生物农药研究进展[J]. 上海农业学报, 2000, 16(增刊):73-77.
[9]Kruger GR, Xing L, LeRoy AR, et al. Resistance in soybean under midwest conditions[J]. Crop Science, 2008, 48(2):716-726.
[10]Rodrigues KF, Petrini O. Biodiversity of endophytic fungi in tropical region[M]//Hyle KD. Biodiversity of tropical microfungi. Hong Kong:Hong Kong University Press, 1997:57-69.
[11]魏华, 刘敏, 鲍时翔, 等. 1 株抗根结线虫红树林放线菌的筛选与鉴定[J]. 微生物学杂志, 2012, 32(4):13-16.
[12]黄惠琴, 袁维道, 魏华, 等. 一株抗根结线虫放线菌的筛选与鉴定[J]. 生物技术通报, 2013(11):176-180.
[13]Zeng Q, Huang H, Zhu J, et al. A new nematicidal compound produced by Streptomyces albogriseolus HA10002[J]. Antonie Van Leeuwenhoek, 2013, 103(5):1107-1111.
[14]魏华. 根结线虫红树林放线菌的分离、筛选及三株活性菌株的鉴定[D]. 海口:海南大学, 2012.
[15]雷敬超. 杀线虫海洋放线菌的筛选及菌株 HA110711 的分类鉴定[D]. 儋州:华南热带农业大学, 2007.
[16]徐丽华, 李文均, 刘志恒, 等. 放线菌系统学:原理, 方法及实践[M]. 北京:科学出版社, 2007.
[17]阮继生, 黄英. 放线菌快速鉴定与系统分类[M].北京:科学出版社, 2011:69-82.
[18]田鹏, 刘占林. 分子系统发育树构建的简易方法[J]. 生物信息学, 2009, 7(3):232-233.
[19]Meleigy MA, Mokhtar MM, Mohamed HF, Salem M. Morphological, biochemical and sequence-based identification of some selenium tolerant actinomycetes[J]. New York Science Journal, 2011;4(8):20-26
[20]王意敏, 刘志恒. 放线菌的多相分类[J]. 微生物学通报, 1999, 26(2):137.
[21]Costanza R, d’Arge R, De Groot R, et al. The value of the world’s ecosystem services and natural capital[J]. Nature, 1997, 387(6630):253-260.
[22]Koehn FE, Carter GT. The evolving role of natural products in drug discovery[J]. Nature Reviews Drug Discovery, 2005, 4(3):206-220.
[23]Nakagawa M, Hayakawa Y, Adachi K, et al. A new depsipeptide antibiotic, variapeptin[J]. Agricultural and Biological Chemistry, 1990, 54(3):791-794.
[24]Pan E, Jamison M, Yousufuddin M, et al. Ammosamide D, an oxidatively ring opened ammosamide analog from a marine-derived Streptomyces variabilis[J]. Organic Letters, 2012, 14(9):2390-2393.
(责任编辑 李楠)
Isolation and Identification of an Actinomycetes Strain Against Rootknot Nematode from Mangrove Soil
Chen Yuqing1.2Huang Huiqin2Liu Min2Bao Shixiang2
(1. College of Environment and Plant Protection,Hainan University,Haikou 570228;2. Key Laboratory of Biology and Genetic Resources of Tropical Crops of Agriculture Ministry,Institute of Tropical Bioscience and Biotechnology,CATAS,Haikou 571101)
110 Actinomycetes strains were isolated by plate dilution method and anti-root-knot nematode strain HA10401 was screened by 24-well plate fluid model from mangrove soil in Dongzhaigang National Nature Reserve, Hainan Province. While the fermentation broth was diluted by 20 times and 40 times, the mortality rates against nematode were 58.2% and 52.6%, respectively. Phylogenetic analysis based on the 16S rRNA gene sequence showed that strain HA10401 was closely related to Streptomyces variabilis with the highest similarity of 99.8%, and the two strains formed a cluster in the phylogenetic tree. The morphological, cultural and biochemical characteristics were basically accorded with Streptomyces variabilis. As a result, strain HA10401 was identified as Streptomyces variabilis, and its anti-root-knot nematode activity was first reported in this study and worth further research.
Mangrove Actinomycetes Identification Root-knot nematode
2014-03-10
国家“973”计划项目(2013CB127500),国家自然科学基金项目(31170062),国家“948”项目(2011-G25),公益性行业科研专项(201403075),海南省重大科技项目(ZDZX2013023-1),中央级公益性科研院所基金项目(ITBB11-0302)
陈雨晴,女,硕士研究生,研究方向:微生物资源与利用;E-mail:chenyuqingmz@126.com
鲍时翔,男,研究员,博士生导师,研究方向:微生物资源与利用;E-mail:bsxitbb@ 163.com

