一个棉花微管结合蛋白基因GhSP1L5的克隆及表达分析
李榕寇伟谭兰贺怡梁卓李鸿彬,2
(1.石河子大学生命科学学院,石河子 832003;2.石河子大学农业生物技术重点实验室,石河子 832003)
一个棉花微管结合蛋白基因GhSP1L5的克隆及表达分析
李榕1寇伟1谭兰1贺怡1梁卓1李鸿彬1,2
(1.石河子大学生命科学学院,石河子 832003;2.石河子大学农业生物技术重点实验室,石河子 832003)
利用RT-PCR技术从处于快速伸长发育时期的棉花纤维组织中克隆得到Spiral1-Like(SP1L5)基因(GhSP1L5),其开放读码框为315 bp,编码105个氨基酸的蛋白质,生物信息学分析表明,GhSP1L5蛋白N端和C端较为保守,并含有SCOP结构域,是典型的微管结合蛋白。进化树分析表明该基因与SP1L5家族基因的亲缘关系较近。构建原核表达载体pET28a-GhSP1L5,转化大肠杆菌BL21(DE3)并进行体外诱导表达,通过SDS-PAGE检测目的蛋白的表达,获得分子质量约为12 kD的重组蛋白。QRTPCR结果分析表明GhSP1L5基因在开花后15和20 dpa的纤维组织中表达量较高,在棉纤维发育的其他时期及根、茎、叶组织中表达量较低。
棉花纤维 Spiral1-Like5基因 微管结合蛋白 表达
棉花纤维是全球重要的纺织原料之一,是第一大产天然纤维的作物,具有重要的经济价值,在世界及我国国民经济中均占有十分重要的地位[1,2]。近年来由于我国纺织技术的发展以及国民需求的日益增长,对棉花纤维的品质提出了更高要求,亟待在纤维品质方面进行改良以满足生产生活的需求。纤维的强度和长度是棉花纤维品质中重要的参考指标,细胞的伸长或膨大发育与纤维品质形成密切相关[3]。
微管是构成细胞骨架的重要成分,在维持细胞形态、细胞分裂、细胞运动与运输以及信号转导等方面都发挥着重要的作用[4]。微管的形成发育
与细胞的伸长发育密切相关,在棉纤维伸长发育过程中发挥着重要作用。微管结合蛋白(Microtubule associated proteins,MAPs)是一类结合于微管骨架上的蛋白,能够促进微管成束,帮助微管形成不同列阵。Spiral1(SPR1)是植物特有的能与微管正端相互作用的蛋白[5,6],其同源蛋白Spiral1-Like(spiral 1 like,SP1L)结构上与SPR1相似,都有几乎相同的重复序列[7,8],暗示了它们在功能上的相似性。从拟南芥中鉴定出5种SPR1的同源蛋白编码基因,命名为SP1L1-SP1L5,它们在不同的器官中以不同的水平表达。周质微管能调节细胞延伸的方向,SPR1与周质微管共定位,并且快速伸长的细胞中SPR1的表达水平上升。SPR1突变能引起根轴旋转、下胚轴变白、内胚层和皮层细胞各向异性生长降低,SPR1和SP1L均可以恢复由突变引起的细胞生长异常的表型,这也暗示了SP1L在细胞生长方向发育中的重要功能[6]。许多研究表明[6,9-11],在棉纤维伸长发育过程中微管的形成与发育发挥着重要作用,微管的形成和发育离不开微管结合蛋白。目前对于微管结合蛋白参与棉纤维发育的相关研究鲜有报道。
对棉花纤维中GhSP1L5基因的克隆及表达分析,将有助于解析微管结合蛋白参与棉纤维发育的重要功能并有助于解析棉花纤维发育的分子机制。因此本研究从棉花纤维组织中克隆得到GhSP1L5基因,分析该基因编码的蛋白质结构和序列特征并预测可能的功能,体外重组表达GhSP1L5蛋白,使用qRTPCR方法进行半定量分析研究该基因在棉花纤维发育中的表达特征,旨在研究GhSP1L5基因参与棉花纤维发育的可能功能。
1 材料与方法
1.1 材料
陆地棉徐142由本实验室培养,纤维细胞经液氮速冻后于-80℃保存。E. coli Top10由本实验室保存,原核表达载体pET-28a购自大连宝生物公司。
凝胶回收试剂盒、质粒提取微量试剂盒购自TIANGEN公司;RNA反转录试剂盒、TaKaRa LA Taq DNA 聚合酶、T4 DNA 连接酶、EcoRⅠ、BamHⅠ、XhoⅠ等相关酶购自大连宝生物公司;其他相关试剂均为国产分析纯,购自上海生工生物工程公司。
PCR仪(Biomotra Tpersonal)、电泳仪(Tannon Epson100型 )、 高 压 蒸 汽 灭 菌 锅(HVE-50)、Eppendorf 5417 R型台式冷冻离心机、凝胶成像系统和恒温摇床(HWY-100B)等。
1.2 方法
1.2.1 棉花总RNA的提取 所使用的研钵经高压灭菌和酒精灼烧,其他器皿均经DEPC处理,根据改良的CTAB法提取棉花总RNA[12]。
1.2.2 GhSP1L5基因的克隆 从GenBank EST数据库中所获得的完整cDNA ORF基因片段进行保守性分析后,利用Primer Premier5.0进行引物设计。用Prime-ScriptTM反转录试剂盒以总RNA为模板合成cDNA[13],通过PCR扩增获得全长的GhSP1L5基因。
在GhSP1L5和表达载体pET-28a两端设计BamHⅠ和XhoⅠ的酶切位点(下划线)和保护性碱基:正向引物:5'-CGGGATCCATGAGTAGAGGTGGGAGCT-3';反向引物:5'-CCGCTCGAGCTTCTCACCAAACAGGTAACC-3'。
PCR反应条件为:94℃预变性4 min;94℃预变性45 s,57℃退火45 s,72℃延伸60 s,30个循环;72℃延伸10 min;4℃存放。
1.2.3 蛋白质序列比对和结构域分析 蛋白质序列比对通过Clustalx1.81软件和NCBI网站在线完成,通过MEGA软件完成进化树构建。
1.2.4 重组GhSP1L5蛋白的诱导表达及SDS-PAGE分析 原核表达载体pET28a-GhSP1L5的构建、鉴定、重组蛋白的诱导表达及SDS-PAGE分析参考实验室常规方法完成[14,15]。
1.2.5 棉花GhSP1L5基因QT-PCR分析 样品采集:徐142野生型棉花幼苗根、茎、叶的准备:用自来水浸泡棉种1-2 dpa,待露出培根后移栽入土中进行培养,约7 dpa左右待幼苗长出真叶后可进行采样;棉纤维胚珠混合样的准备:将棉花花朵授粉当天命名为0 dpa,标记授粉当天的花朵若干,之后试验需要分别采取授粉后-3、0、3、5、10、15和20 dpa(Days post anthesis授粉后天数)的纤维和胚珠组织混合材料、10 dpa无长绒无短绒突变体胚珠材料、棉花根、茎、叶材料,以液氮速冻后于-80℃保存备
用。根据改良的CTAB法提取各材料总RNA[16],反转录成cDNA,并以其为模板,使用TaKaRa公司生产的SYBR Premix Ex TaqTM试剂盒,运用LightCycler 480 System对GhSP1L5基因的表达量进行QT-PCR分析。选择UBQ7为内参基因,引物序列为:上游:5'-AGAGGTCGAGTCTTCGGACA-3';下游:5'-GGGCTTGGCTTGATCTT-3'。
GhSP1L5的QT-PCR的引物序列为:上游:5'-CCTTGGGCTACCTCTTTGG-3';下游:5'-TGAATTCTGTCCTTGAGCCC-3'。
PCR反应条件为:95℃预变性5 min;95℃预变性45 s,57℃退火45 s,72℃延伸30 s,30个循环;72℃延伸7 min,4℃保存。
2 结果
2.1 棉花GhSP1L5基因克隆
使用CTAB法提取棉花纤维组织中的总RNA:所提取的总量RNA呈现28S、18S完整条带,同时28S的含量约为18S的2倍,所提取的RNA质量较好,可以继续进行后续反转录及基因克隆的试验(图1-A)。以反转录获得的cDNA作为模板,经过PCR扩增得到特异性条带,经测序正确后获得GhSP1L5基因的全长开放读码框(图1-B),包含315个碱基对的核苷酸,编码含有105个氨基酸的蛋白质。
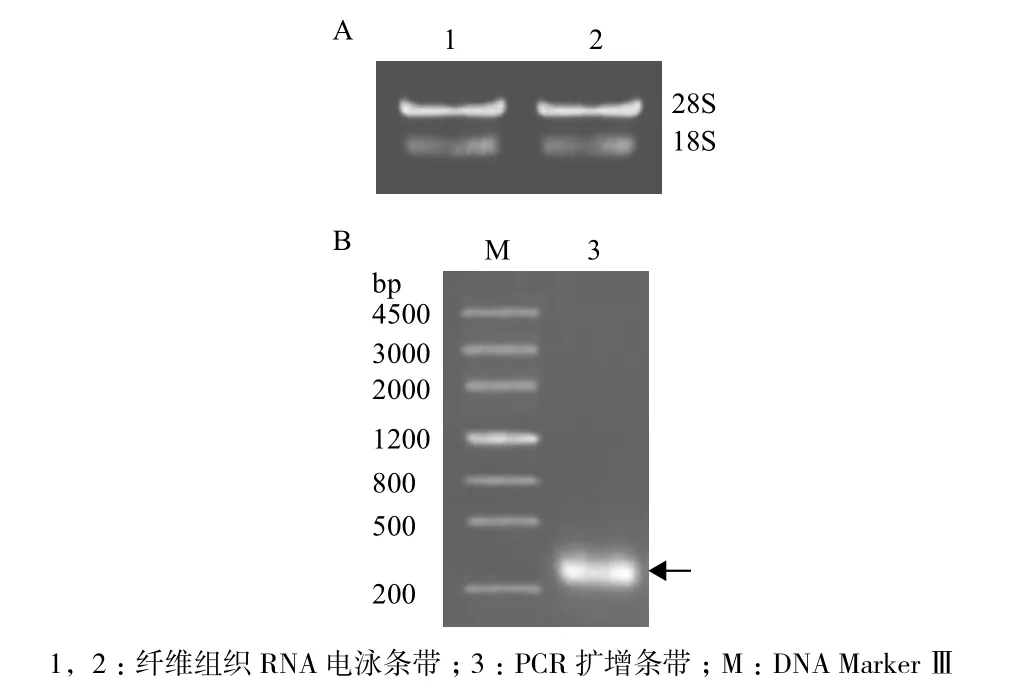
图1 棉花纤维组织总RNA提取(A)及GhSP1L5基因的克隆(B)
2.2 序列比对与进化树分析
将GhSP1L5基因的cDNA序列翻译为氨基酸序列,并与以下几种微管结合蛋白基因的氨基酸序列进行对比:拟南芥AtSPR1、拟南芥AtSP1L1-5、野草莓FvSP1L5、黄瓜CsSP1L5、玉米ZmSPR1、番茄SlSP1L、蓖麻RcSP1L。结果显示,植物中的GhSP1L5蛋白质在N端和C端的氨基酸序列相似性较高,GhSP1L5蛋白质具有保守的结构域,黑色部分为保守的氨基酸序列,灰色部分为保守性一般的序列。GhSP1L5蛋白包含多个微管蛋白结合位点(图2-A虚线所示)和与蛋白相互作用相关的SCOP结构域(图2-A实线所示)。进化树分析结果(图2-B)表明GhSP1L5与黄瓜CsSP1L5在进化亲缘关系上较近。
2.3 原核表达载体pET28a-GhSP1L5的构建与鉴定
经测序后比对正确的重组质粒pGEM-TGhSP1L5和pET-28a原核表达载体同时用BamHⅠ和XhoⅠ进行双酶切,回收目的基因小片段和原核表达载体大片段,连接后转化大肠杆菌Top10感受态细胞,挑取转化成功的单克隆做菌落PCR鉴定(图3-A),PCR鉴定为阳性单菌落的摇菌提取其质粒进一步做双酶切鉴定(图3-B),成功构建pET28a-GhSP1L5原核表达载体。
2.4 重组GhSP1L5蛋白的诱导表达
将构建成功的pET28a-GhSP1L5重组子转入大肠杆菌表达菌株BL21(DE3)中,经PCR筛选鉴定后,进行扩大培养,利用IPTG诱导菌体表达,提取蛋白质后进行SDS-PAGE电泳(图4)分析,获得了大小约为12 kD左右的重组蛋白GhSP1L5。
2.5 棉花GhSP1L5基因的表达特征分析
通过定量PCR分析GhSP1L5基因在棉花幼苗根、茎、叶,棉花开花前-3、0 dpa和开花后3、5、10、15、20 dpa的纤维和胚珠组织,以及无长绒无短绒突变体(fl)开花后10 dpa的胚珠中的表达情况。结果(图5)表明,GhSP1L5基因野生型棉花开花后15和20 dpa的纤维组织中表达较高,在根、茎、叶中及其他发育时期的纤维组织中表达较低。说明GhSP1L5基因的表达可能与棉花纤维伸长及次生壁发育有关。
3 讨论
微管在细胞发育、形态建成和物质运输等过程中发挥着重要作用,通过参与细胞各种生理活动
而发挥调控植物生长的作用,如细胞分裂、胞间运输、染色体分离、和信号转导等[17-20]。植物细胞生长和发育过程中,微管列阵会依次转换,这一过程离不开微管结合蛋白的参与,微管结合蛋白通过影响植物细胞骨架形成进而参与细胞伸长与膨大过程。SP1L是植物特有的一种微管结合蛋白,作用于微管的正端,与微管的聚合密切相关[9,10]。
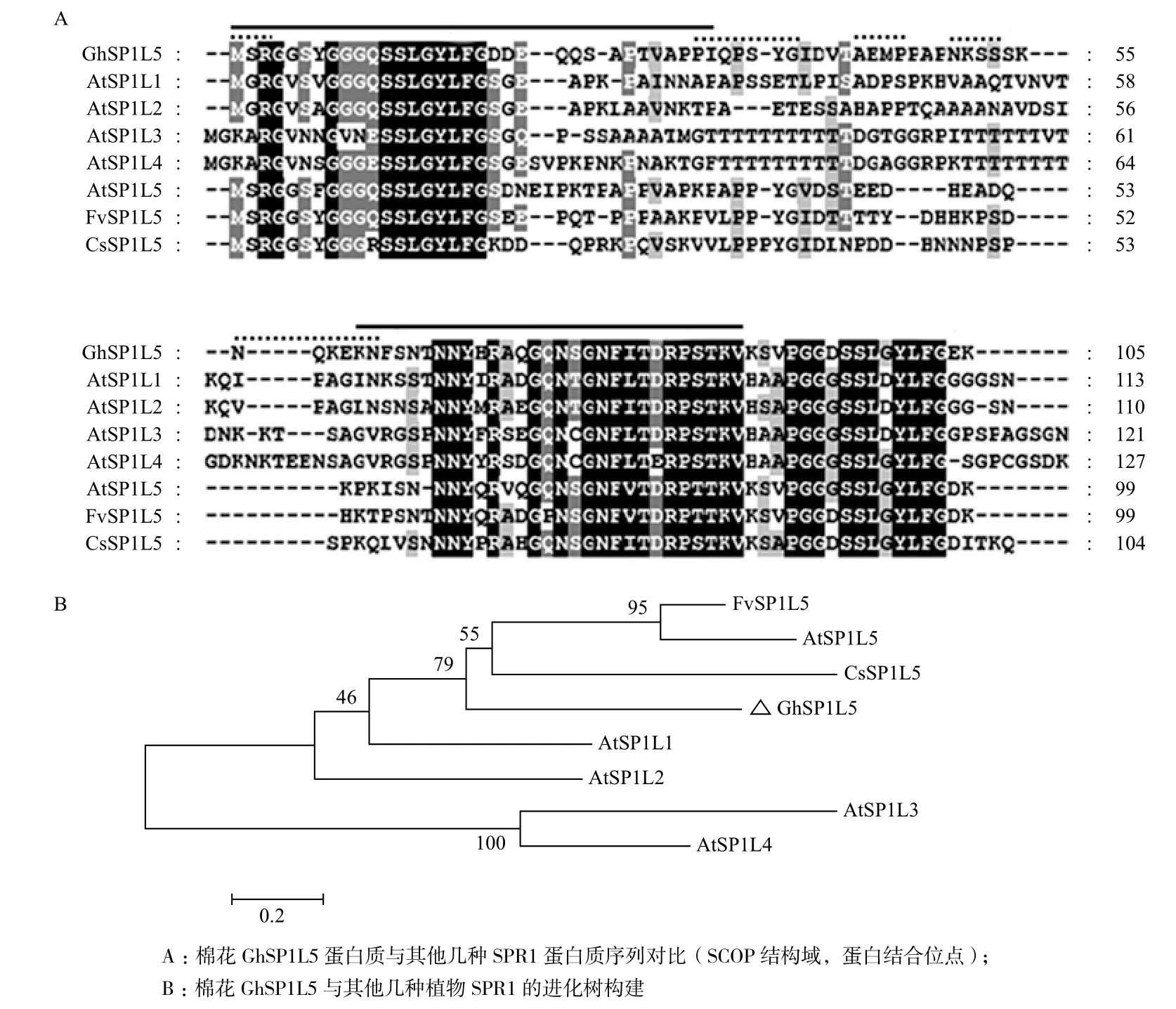
图2 GhSP1L5的氨基酸序列比对(A)及进化树分析(B)

图3 pET28a-GhSP1L5原核表达载体构建(A)及双酶切鉴定(B)

图4 GhSP1L5重组蛋白的诱导表达与SDS-PAGE分析
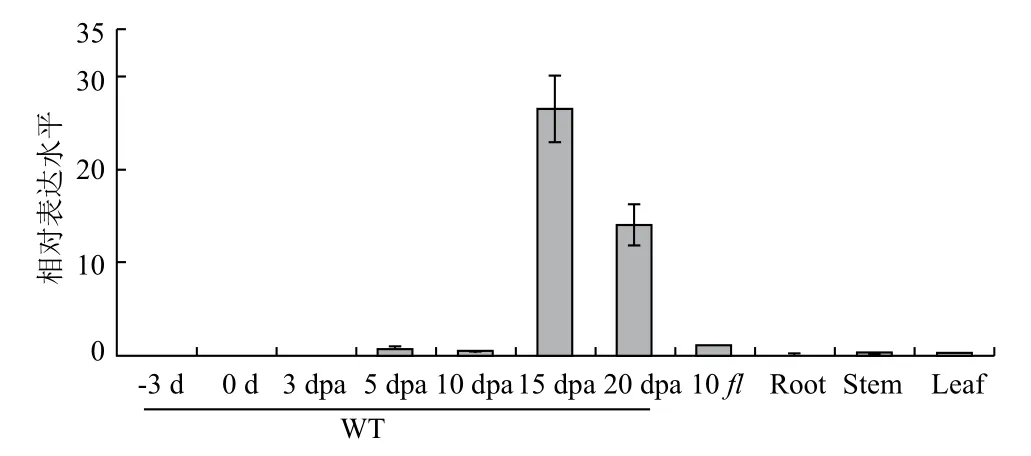
图5 GhSP1L5在棉花纤维发育过程中的表达分析
棉纤维细胞是由胚珠外珠被表皮层分化而来的单细胞,在纤维发育过程中周质微管的排列发生活跃的变化,微管骨架的形成及发育与棉纤维细胞的伸长发育密切相关[9,21]。本研究从棉花纤维组织中克隆获得一个微管结合蛋白基因GhSP1L5,该蛋白属于典型的SP1L家族,具有多个微管结合位点和功能结构域,暗示了其可能与微管结合相互作用并参与纤维细胞的发育过程。植物微管结合蛋白可以调控植物微管骨架的动态和组织,以及微管与其他细胞结构间的连接,从而在植物细胞的形态、分化和发育等生理过程中起作用[22-28]。spr1突变体中的周质微管排列表现异常,SPR1可以通过调节周质微管进而调节细胞延伸的方向[6,8,16]。
GhSP1L5基因在开花后15-20 dpa的纤维组织中表达量较高,可能与棉花纤维伸长发育和次生壁形成有关。微管的形成与发育在棉纤维伸长发育过程中发挥着重要作用[29]。微管作用的发挥离不开微管结合蛋白的参与。周质微管骨架的排列方式与细胞壁纤维素微纤丝的排列极为相似,在纤维发育过程中,二者总是发生同样的阵列改变,利用秋水仙素等抑制剂能够破坏微管结构导致纤维素微纤丝发生相似的损坏,SP1L可能通过与微管相互作用对纤维细胞壁微纤丝的结构和排列起控制作用[30,31]。
许多研究结果表明微管结合蛋白在植物生长发育中发挥着重要的功能。棉花微管结合蛋白GhSP1L5可能参与了棉花纤维发育过程,后期将进一步开展GhSP1L5蛋白质相互作用研究、转化拟南芥同源基因突变体研究、转化裂殖酵母研究等工作,进一步验证GhSP1L5基因在植物细胞发育中的重要功能。本试验为深入研究GhSP1L5基因调控植物生长发育的生物学功能及其参与细胞伸长发育的分子机制提供一定的参考。
4 结论
本研究从发育的棉花纤维组织中克隆得到GhSP1L5基因,GhSP1L5蛋白具有多个微管蛋白结合位点和SCOP结构域,构建了原核表达载体pET28a-GhSP1L5并通过诱导表达和SDS-PAGE分析获得了大小约为12 kD左右的重组蛋白质,定量PCR分析显示GhSP1L5基因在开花后15和20 dpa的纤维组织中表达量较高。
[1]刘进元, 赵广荣, 李骥.棉花纤维品质改良的分子工程[J].植物学报, 2000, 42(10):991-995.
[2]韩志国, 张天真.棉纤维发育相关EST-SSR的特征功能及其定位[J].南京农业大学学报, 2006, 9(3):101-121.
[3]钱雯婕, 王斐, 李鸿彬, 等.棉花单脱氢抗坏血酸还原酶基因的克隆及原核表达[J].西北农业学报, 2012, 21(5):118-122.
[4]Mann SS, Hammarback JA. Molecular characterization of light chain3:a microtubule binding subunit of MAP1A and MAP1B[J]. J Biol Chem, 1994, 269:11492-11497.
[5]Sedbrook JC, Ehrhardt DW, Fisher SE, et al. The Arabidopsis SKU6/ SPIRAL1 gene encodes a plus end-localized microtubule-interacting protein involved in directional cell expansion[J]. Plant Cell, 2004, 16:1506-1520.
[6]Nakajima K, Furutani I, Tachimoto H, et al. SPIRAL1 encodes a plant-specific microtubule localized protein required for directional control of rapidly expanding Arabidopsis cells[J]. Plant Cell, 2004, 16:1178-1190.
[7]Smertenko AP, Chang HY, Wagner V, et al. The Arabidopsis microtubule-associated protein AtMAP6 5 -1:molecular analysis of its microtubule bundling activity[J]. Plant Cell, 2004, 16:2035-2047.
[8]Mao G, Chan J, Calder G, et al. Modulated targeting of GFPAtMAP65-1 to central spindle microtubules during division[J]. Plant J, 2005, 43(4):469-478.
[9]Whittaker D, Triplett B. Gene-specific changes in α-tubulin transcript accumulation in developing cottton fibers[J]. Plant Physiol, 1999, 121:181-188.
[10]Quader H, Herth W, Ryser U, et al. Cytoskeletal elements in cotton
seed hair development in vitro:their possible regulatory role in cell wall organization[J]. Protoplasma, 1987, 137:56-62.
[11]Seagull R. The effects of microtubules and microfilament disrupting agents on cytoskeletal arrays and wall deposition in developing cotton fibers[J]. Protoplasma, 1990, 159:44-59.
[12]蒋建雄, 张天真.利用CTAB/酸酚法提取棉花组织总RNA[J].棉花学报, 2003, 15:166-167.
[13]田大鹏, 葛娟, 石峰, 李鸿彬.棉花GhDHAR2基因的克隆、功能序列分析及原核表达[J].生物技术通报, 2012(7):65-69.
[14]李学宁, 杜军伟, 李鸿彬.棉花脱氢抗坏血酸还原酶基因的克隆、原核表达与纯化[J].石河子大学学报:自然科学版, 2010, 28:542-545.
[15]王芳, 王斐, 孙辉, 李鸿彬.棉花GhDHAR3基因克隆、功能序列分析及烟草的遗传转化[J].西北农业学报, 2011, 20(5):88-93.
[16]Nakajima K, Kawaura T, Hashimoto T. Role of the SPIRAL1 gene family in anisotropic growth of Arabidopsis thaliana[J]. Plant Cell Physiol, 2006, 47:513-522.
[17]Myaer U, Jugrnes G. Microtubule cytoskeleton:a track record[J]. Curr Opin Plant Biol, 2002, 5:494-501.
[18]Smith LG. Cytoskeletal control of plant cell shape:getting the fine points[J]. Curr Opin Plant Biol, 2003, 6:63-73.
[19]Hashimoto T. Dynmaics and regulation of plant interphase microtubule:a comparative view[J]. Curr Opin Plant Biol, 2003, 6:568-576.
[20]Lloyd C, Chna J. Microtubule and the shape of plants to come[J]. Nat Rev Mol Cell Biol, 2004, 5:13-22.
[21]Kim H, TriPlett B. Cotton fiber growth in Planta and in vitro. Models for plant cell elongation and cell wall biogeneses[J]. Plant Physiology, 2001, 127:1361-1366.
[22]Yuan M, Shaw PJ, Warn RM, Lloyd CW. Dynamic reorientation of cortical microtubules, from transverse to longitudinal, in living plant cells[J]. Proc Natl Acad Sci, 1994, 91:6050-6053.
[23]Whittington AT, Vugrek O, Wei KJ, et al. MOR1 is essential for organizing cortical microtubules in plants[J]. Nature, 2001, 411:610-613.
[24]Müller S, Smertenko A, Wagner V, et al. T he pla nt microtu bu le-a ssocia ted protein AtMAP65? /PLE is essential for cytokinetic phragmoplast function[J]. Curr Biol, 2004, 14(5):412-417.
[25]Chan J, Mao G, Smertenko A, et al. Identification of a MAP65 isoform involved in directional expansion of plant cells[J]. FEBS Lett, 2003b, 534:161-163.
[26]Caillaud MC, Lecomte P, Jammes F, et al. MAP65-3 microtubuleassociated protein is essential for nematode-induced giant cell ontogenesis in Arabidopsis[J]. Plant Cell, 2008, 20(2):423-437.
[27]Bibikova TN, Blancaflor EB, Gilroy S. Microtubules regulate tip growth and orientation in root hairs of Arabidopsis thaliana[J]. Plant J, 1999, 17:657-665.
[28]Wang C, Li J, Yuan M. Salt tolerance requires cortical microtubule reorganization in Arabidopsis[J]. Plant Cell Physiol, 2007a, 48(11):1534-1547.
[29]Okamura S, Okahara K, Lida T, et al. Isotype-specific changes in the amount of beta-tubulin RNA in synchronized tobacco BY2 cells[J]. Cell Struct Funct, 1999, 29(3):117-220.
[30]Smertenko A, Saleh N, Igarashi H, et al. A new class of microtubule-associated proteins in plants[J]. Nat Cell Biol, 2000, 2:750-753.
[31]Ehrhardt DW, Shaw SL. Microtubule dynamics and organization in plant cortical array[J]. Annu Rev Plant Biol, 2006, 57:859-875.
(责任编辑 马鑫)
Cloning and Expression Analysis of a Cotton Microtubule Associated Protein Gene of GhSP1L5
Li Rong1Kou Wei1Tan Lan1He Yi1Liang Zhuo1Li Hongbin1,2
(1. College of Life Sciences of Shihezi Universtiy,Shihezi 832003;2. Key Laboratory of Agrobiotechnology of Shihezi University,Shihezi 832003)
A cotton Spiral1-Like5(GhSP1L5)full-length open reading frame(ORF)cDNA was cloned from fast elongating fiber tissue by RT-PCR method, The GhSP1L5 gene contains 315 bp necleotides and codes a protein of 105 amino acids. Through sequence function analysis and homology sequence alignment, GhSP1L5 protein includes several microtubule associated protein binding sites and SCOP domains. Phylogenetic tree analysis showed that GhSP1L5 has a similar relationship with SP1L5 protein family. Prokaryotic expression vector pET28a-GhSP1L5 was constructed and transformated into E.coli BL21(DE3). Recombinant GhSP1L5 protein was obtained after induction by IPTG and SDS-PAGE analysis with a MW of ~12 kD. Quantitative RT-PCR analysis showed that the GhSP1L5 gene expresses highly at 15 dpa and 20 dpa fiber tissues compared with the expressions in root, stem, leaf and fiber tissuse of other development stages. GhSP1L5 cloning and expression analysis establish a basis for its further functions in cotton fiber development.
Cotton fiber Spiral1-Like5 gene Microtubule associated protein Expression
2014-03-03
国家自然科学基金项目(31260339),兵团创新项目(2012BB050,2013CB010),石河子大学杰青项目(2012ZRKXJQ03)
李榕,女,硕士研究生,研究方向:植物基因工程;E-mail:782348048@qq.com
李鸿彬,男,博士,教授,硕士生导师,研究方向:植物分子生物学与基因工程;E-mail:lihb@shzu.edu.cn
——水芹主要害虫识别与为害症状

