KLF10、Smad7与上皮性卵巢癌发生发展关系的研究
郑乐,张颐,郭科军
(中国医科大学附属第一医院妇科,沈阳110001)
KLF10、Smad7与上皮性卵巢癌发生发展关系的研究
郑乐,张颐,郭科军
(中国医科大学附属第一医院妇科,沈阳110001)
Correlation Study between KLF10,Smad7 Expression and the DevelopmentofEpithelialOvarian Cancer
应用免疫组化S-P法染色检测60例上皮性卵巢癌、15例交界性卵巢肿瘤、30例上皮性良性卵巢肿瘤、10例正常卵巢组织的石蜡切片中Krüpple样因子10(KLF10)及母系DPP同源物(Smad7)的表达情况。结果发现与正常卵巢组织及卵巢良性组织中的表达比较,KLF10在上皮性卵巢癌中低表达,Smad7在上皮性卵巢癌中高表达;KLF10、Smad7与上皮性卵巢癌病理分级、临床分期有关,2者在上皮性卵巢癌中表达呈负相关(r=-0.303,P=0.018)。因此认为KLF10和Smad7与上皮性卵巢癌的发生发展有关。
上皮性卵巢肿瘤;Krüpple样因子10;母系DPP同源物
卵巢癌在女性生殖器官肿瘤中的发生率占第三位,但死亡率居第一位。由于卵巢居盆腔深处,一旦发生恶性肿瘤,症状十分隐蔽,当患者出现不适就诊时,绝大多数病变已进入晚期,肿瘤已发生转移,手术及化疗的效果不佳。
Krüpple是果蝇分节基因“间隙基因”类的一个成员,它因编码包含1个DNA结合序列的蛋白质,一群与Krüpple的锌指结构高度同源的蛋白质被发现,命名为Krüpple样因子(Krüpple-like factor,KLFs),它们是参与广泛的细胞进程的转录调节蛋白。Krüpple样因子10(Krüpple-like factor 10,KLF10)在转化生长因子β(transforming growth factor-β,TGF-β)介导的细胞生长控制和分化中发挥着重要作用。TGF-β结合到其跨膜受体激酶来起始独特的细胞内信号级联,包括Smads信号、转录因子以及独立于Smads的信号途径。TGF-β在不同的条件下对不同类型的细胞产生不同的生物学作用:诱导上皮细胞凋亡,抑制免疫功能,调节细胞的生长分化,刺激间质细胞增殖,产生细胞外基质,诱导体内各种组织纤维化反应等[1]。Smad7是TGF-β信号传导通路的抑制型Smad,可通过阻止Smad2、Smad3的磷酸化和Smad2、3、4异源复合物的形成,从而阻断TGF-β信号在胞质内的传导[2],KLF10在正常的上皮细胞通过终止Smad7加强的负反馈回路来强化Smad的信号活性,诱导细胞凋亡[3]。有研究表明[4],在胰腺癌细胞中,KLF10的表达水平低于正常胰腺组织,提示其在肿瘤生成中具有重要作用。本实验通过检测上皮性卵巢癌中KLF10及Smad7的表达,旨在明确KLF10、Smad7在卵巢癌发生发展中的作用及2者相关性,从而为卵巢癌的生物治疗提供新的实验依据。
1 材料与方法
1.1 材料
1.1.1 标本来源:本实验石蜡标本取自2005年1月至2011年1月在中国医科大学附属第一医院妇科住院行手术治疗,术前未行化疗和放疗,术后均经病理检查确诊的患者(全部患者均知情同意并经中国医科大学附属第一医院伦理委员会批准)。甲醛固定石蜡包埋的组织切片常规进行HE染色,分别由2名病理诊断医师确定肿瘤的病理类型以及组织学分级。包括正常卵巢组织10例、上皮性卵巢良性肿瘤30例(浆液性囊腺瘤20例,黏液性囊腺瘤10例),上皮性卵巢交界性肿瘤15例(浆液性交界性肿瘤8例,黏液性交界性肿瘤7例),上皮性卵巢癌60例(浆液性囊腺癌32例,黏液性囊腺癌18例,子宫内膜样癌10例)。60例上皮性卵巢癌中,中位年龄45岁;按组织分化程度分为:高-中分化40例,低分化20例;采用国际妇产科联盟(FIGO)2009年制定的分期标准,临床分期:Ⅰ期+Ⅱ期30例,Ⅲ期+Ⅳ期30例。
1.1.2 主要试剂:浓缩型兔抗人KLF10多克隆抗体(工作浓度1∶100)购自Bioss公司;浓缩型兔抗人Smad7多克隆抗体(工作浓度1∶100)购自Bioss公司;S-P免疫组化试剂盒及DAB(二氨基联苯胺)显色剂购自北京中杉金桥生物技术有限公司。
1.2 实验方法
组织蜡块行4 μm厚连续切片,采用免疫组化S-P法。
1.3 结果判定
KLF10、Smad7阳性表达主要位于细胞质,呈棕黄色颗粒分布。在200倍显微镜下观察每张切片,随机选定10个视野,每个视野通过彩色CCD摄像机将图像输入计算机病理图像分析系统MPIAS2000,将阳性细胞的染色强度转变为量化指标,计算积分光密度(integral optical density,IOD)值,用表示,取图像测量结果的平均值,定量分析蛋白表达。
同时结合传统的免疫组化分析方法打分对结果进行进一步验证:KLF10、Smad7以肿瘤细胞胞质和(或)细胞膜中出现棕黄色颗粒为阳性判定标准。随机选择10个视野,每个视野计数100个细胞。按染色强弱及阳性细胞数两个方面来计算评分。a:染色强度(不着色0分,浅棕色1分,棕黄色2分,棕褐色3分);b:阳性细胞数(无阳性细胞0分,阳性细胞数<25%1分,阳性细胞数25%~50%2分,阳性细胞数>50%3分),计算a+b的值即为得分,得分≤1分为(-),2~3分为(+),4~5分(++),>5分为(+++),本组实验结果阳性是指(+~+++)。
1.4 统计学分析
2 结果
2.1 KLF10、Smad7的表达
KLF10、Smad7阳性表达主要位于细胞质,呈棕黄色颗粒分布,见图1~4。KLF10在上性卵巢癌中的表达低于在正常卵巢组织及卵巢良性组织中的表达,Smad7在上皮性卵巢癌中的表达水平高于在正常卵巢组织及卵巢良性组织中的表达,各实验组差异均有统计学意义(P<0.05),见表1。
2.2 KLF10、Smad7与病理分级的关系
KLF10在上皮性卵巢癌高-中分化组中的表达水平高于低分化组中的表达水平,Smad7在上皮性卵巢癌高-中分化组中的表达水平低于低分化组中的表达水平,2者差异有统计学意义(P<0.05),见表2。
2.3 KLF10、Smad7与临床分期的关系
KLF10在上皮性卵巢癌Ⅰ+Ⅱ期组中的表达水平高于Ⅲ+Ⅳ期组中的表达水平,Smad7在上皮性卵巢癌Ⅰ+Ⅱ期组中的表达水平低于Ⅲ+Ⅳ期组中的表达水平,2者差异有统计学意义(P<0.05),见表3。
2.4 KLF10、Smad7在上皮性卵巢癌中表达的相关性
经Spearman相关分析显示KLF10与Smad7阳性表达呈负相关(r=-0.303,P=0.018)。

图1 KLF10在卵巢癌中的阴性表达SP×200
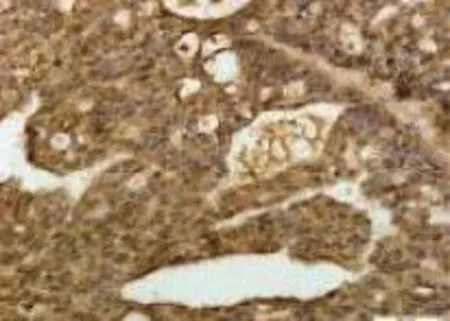
图2 KLF10在正常卵巢组织中的阳性表达SP×200

图3 Smad7在正常卵巢组织中的阴性表达SP×200
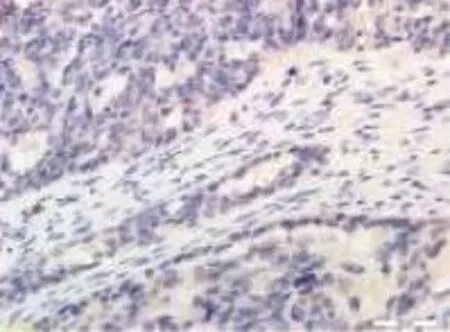
图4 Smad7在卵巢癌中的阳性表达SP×200

表1 KLF10、Smad7在各组的表达比较

表2 KLF10、Smad7在不同病理分级中的表达

表3 KLF10、Smad7在不同临床分期中的表达
3 讨论
国内外研究显示,作为转录调控因子的一种,Krüpple样C2H2型锌指蛋白参与细胞的生长、增殖、分化的基因调控,在胚胎发育及许多疾病的发生发展过程中都起着重要的作用。到目前为止,至少发现20种KLFs,它们通过调控多种富含GC或CACCC的启动子的基因表达,参与细胞增殖、分化、凋亡和肿瘤发生、发展等多种生理、病理过程[3]。
TGF-β是一类具有多种生物学活性的多肽生长因子,TGF-β在正常细胞中,通过阻断细胞从G1期进入S期而抑制细胞增殖,诱导细胞凋亡,在肿瘤发生发展的过程中,TGF-β可延续其基态下的促凋亡功能,抑制肿瘤细胞增殖。李莹莹等[5]研究表明,TGF-β1能抑制人子宫内膜癌Ishikawa细胞的增殖,促进细胞凋亡,阻滞细胞周期。余星平等[6]通过检测Smad7在子宫颈癌组织中表达,结果显示Smad7的阳性率明显高于对照组(P<0.05),同时Smad7的表达与子宫颈癌的临床分期及淋巴结转移密切相关(P<0.05)。本组实验通过检测Smad7在各实验组中的表达水平,Smad7在分化成熟,处于非增殖期的上皮性卵巢细胞中表达较弱。说明Smad7作为转化生长因子β信号传导通路的抑制型Smad,促进细胞增殖,抑制细胞凋亡。
KLF10在TGF-β介导的细胞生长控制和分化中发挥着重要作用。作为抑癌基因[7],KLF10在正常的上皮细胞通过终止Smad7加强的负反馈回路来强化Smad的信号活性,诱导细胞凋亡[3]。KLF家族的几个成员包括KLF4[8]、KLF5[9]、KLF6[10]、KLF8、KLF9[11]、KLF10[3]、KLF11[12]参与多种癌症的病理过程,有研究显示:KLF4作为一种抑癌基因,其表达的缺失会促进细胞的增殖,在结肠腺瘤和结肠癌的组织里KLF4mRNA水平相对正常组织是显著减少的[8];KLF5在前列腺癌、乳腺癌中表达缺失[9,13]。冯洁等[10]研究表明KLF6、SP1蛋白在肝癌组织表达率高于癌旁肝硬化组织,正常组织中全部呈阴性表达,癌组织中KLF6的高表达可能是在癌症形成过程中被激活而发生的代偿作用。
本组实验KLF10在上皮性卵巢癌中低表达,正常卵巢组织中高表达,且卵巢癌组与其他各组差异有统计学意义。提示KLF10在分化不成熟,处于增殖期的上皮性卵巢细胞中表达较弱,作为一种抑癌基因,可诱导细胞凋亡。实验结果中出现的KLF10、Smad7在正常卵巢组织及上皮性卵巢良性肿瘤中的表达水平差异有统计学意义,可能由于Smad7、KLF10是在上皮性卵巢肿瘤中早期出现的、快速的、选择性上调或下调的基因。KLF10和Smad7在上皮性卵巢癌中表达与肿瘤病理分级、临床分期有关。KLF10、Smad7可能在上皮性卵巢癌的发生发展中起到重要作用。
[1]Ellenrieder V.TGF beta regulated gene expression by Smads and Sp1/KLF-like transcription factors in cancer[J].Anticancer Res,2008,28(3A):1531-1539.
[2]Jeremy N,Anita J,Xiao FW.Transforming growth factor-β signaling in cancer[J].Microscopy Res Tech,2001,52(4):363-373.
[3]Ellenrieder V,Harth A,Jungert K,et al.KLF11 mediates a critical mechanism in TGF-Beta signaling that is inactivated by Erk-MAPK in pancreatic cancer cells[J].Gastroenterology,2004,127(2):607-620.
[4]Chang VHS.Krüppel-like factor 10 expression as a prognostic indicator for pancreaticadenocarcinoma[J].Am J Pathol,2012,181(2):423-430.
[5]李莹莹,刘贵鹏,王东娇,等.转化生长因子β1对子宫内膜癌细胞系Ishikawa体外增殖、细胞周期、凋亡的影响[J].中国医科大学学报,2010,39(4):255-257.
[6]余星平,黄利鸣,黄益玲,等.P16、P15、Smad7及TGF-β1在宫颈癌中的表达及意义[J].中国妇幼卫生保健,2011,26(18):2813-2815.
[7]Song KD,Kim DJ.KLF10,transforming growth factor-β-inducible early gene 1,acts as a tumor suppressor[J].Biochem Biophy Res Commun,2012,419(2):388-394.
[8]Yu TX,Chen X,Zhang W,et al.Regulation of the potential marker for intestinal cells,Bmi1,by β-catenin and the zinc finger protein KLF4:implications for colon cancer[J].Biol Chem,2012,287(6):3760-3768.
[9]Xia HJ,Wang CY,Chen WL,et al.Krüppel-like factor 5 transcription factor promotes microsomal prostaglandin E2 synthase 1 Gene transcription in breast cancer[J].Biol Chem,2013,288(37):26731-26740.
[10]冯洁,汤正好,臧国庆,等.KLF6、SP1蛋白在肝癌、肝硬化组织中的表达及意义[J].胃肠病学和肝病学杂志,2008,17(2):148-151.
[11]Wang X,Zhao J.KLF8 transcription factor participates in oncogenic transformation[J].Oncogene,2007,26(3):456-461.
[12]Lomberk G,Grzenda A,Mathison A,et al.Krüppel-like factor 11 regulates the expression of metabolic genes via an evolutionarily conserved protein interaction domain functionally disrupted in maturity onset diabetes of the young[J].Biol Chem,2013,288(24):17745-17758.
[13]Guo P,Dong XY,Zhang XH,et al.Pro-proliferative factor KLF5 becomes anti-proliferative in epithelial homeostasis upon signalingmediated modification[J].Biol Chem,2009,284(10):6071-6078.
(编辑武玉欣)
R737.31
A
0258-4646(2014)03-0277-03
郑乐(1987-),女,博士研究生.
郭科军,E-mail:guokejuncmu@163.com
2013-12-04
网络出版时间:

