法螺(Chanoria tritonis)染色体核型分析*
蔡 岩 周永灿 冯永勤 吴开畅 谢珍玉 郭伟良 王世锋①
(1. 海南省热带生物资源可持续利用重点实验室 海南大学 海口 570228;2. 中国水产科学研究院南海水产研究所 广州 510300)
法螺(Chanoria tritonisLinnaeus)隶属于软体动物门Mollusca、腹足纲Gastropoda、中腹足目Mesogastropoda、嵌线螺科Cymatiidae、法螺属Charonia, 为大型珊瑚礁单壳贝类, 因其贝壳具有美丽的孔雀羽毛状的花纹, 又名凤尾螺, 是世界著名的四大观赏贝类之一,具有很高的经济价值(张素萍等, 2004)。此外, 由于法螺是珊瑚礁敌害生物长棘海星的天敌, 因而在热带珊瑚礁生态系统中还扮演着珊瑚保卫者的重要角色。然而近年来巨额的经济利润吸引人们大量捕捞法螺,加之环境污染、珊瑚礁栖息地的破坏等因素, 致使法螺自然资源受到严重破坏, 很多世界著名的热带珊瑚礁海域法螺已难觅踪迹(Endean, 1982; Antonelliet al, 1984; Bellwoodet al, 2004)。为了保护法螺这一独特而美丽的物种, 开展法螺生物资源的保护及繁育工作迫在眉睫。核型分析是开展杂交育种、多倍体诱导和雌核发育等遗传育种工作的基础, 对生物分类和系统演化研究也具有重要意义。然而由于法螺的活体样本的获得较为困难, 迄今为止, 法螺染色体数目与核型的研究尚未见报道。本文以法螺的面盘幼体为材料, 对法螺染色体数目与核型进行了研究, 以期为法螺细胞遗传学、遗传育种学提供基础资料, 并为最终法螺生物资源的保护与可持续利用提供科学依据。
1 材料与方法
1.1 实验材料
法螺亲螺采自南海西沙附近海域, 于三亚水产技术推广站室内水池中饲养数月后, 于繁殖季节收集法螺卵囊, 在实验室经人工孵化得到法螺面盘幼体。
1.2 实验方法
收集法螺面盘幼虫放入含有0.5g/L的秋水仙素海水中处理2—3h, 用0.075mol/L的KCl溶液低渗45min, 以500转/min离心5min; 弃上清液, 轻轻弹散沉淀, 缓慢加入低渗液, 37°C水浴20—40min; 500转/min离心5min, 去上清液, 打散沉淀, 缓慢加入适量新配制的卡诺氏固定液, 室温固定20min, 之后重复此步骤两次(即固定3次); 然后置于冰箱(–20°C)内过夜备用。制备染色体标本前, 弃去上清后, 在幼虫悬液中加入体积分数为50%的冰醋酸吹打均匀, 热制片自然风干。以双蒸水︰Giemsa原液 = 20︰1的比例配制Giemsa染液, 对玻片进行染色, 时长为15—20min, 染色完成后即用双蒸水将玻片冲洗干净, 自然晾干后置于显微镜下观察, 初步保留分裂较好的中期分裂相标本, 以便在油镜下观察、拍照。
染色体的形态分组以对10个中期分裂相测定结果的统计值为依据, 参照Levan等(1964)的建议标准,将染色体分为中部着丝粒染色体(m)、亚中部着丝粒染色体(sm)、亚端部着丝粒染色体(st)和端部着丝粒染色体(t)。染色体的臂数按中部和亚中部着丝粒染色体(m组和sm组)作为双臂, 亚端部和端部着丝粒染色体(st组和t组)作为单臂计算。
2 结果
2.1 法螺染色体的二倍体数目
在显微镜下对法螺分散良好的100个中期分裂相进行观察、计数, 并经过拍照和数据统计, 确定其二倍体数目。结果表明, 法螺染色体的二倍体数目2n=70 (表1), 非众数部分的染色体数目可能是由于制片处理过程中药品的处理与人为因素导致的染色体数目的丢失, 或者是细胞重叠造成的。
2.2 法螺的染色体核型分析
本实验所获得的法螺细胞的中期分裂相形态较清晰, 着丝点部位较为突出。通过测量计算, 获得法螺的染色体的相对长度(RL)和臂比(AR), 如表2所示。根据Levan等(1964)的染色体分类标准, 以着丝点的位置确定染色体类型。可以得出法螺亚端部着丝粒染色体(st)为10对; 亚中部着丝粒染色体(sm)为9对; 中部着丝粒染色体(m)为16对。
通过对10个中期分裂相进行测量、统计和分析,选取一个最好的中期分裂相(图1), 利用测量的数据结果对中期分裂相中的同源染色体进行配对, 获得染色体配对对数为35对, 经过图片剪贴, 构建出法螺的核型, 见图2。图2中2号和16号染色体缺失部位可能为染色体次缢痕。另外在一定比例的法螺核型中出现了一对异形染色体, 推测可能为性染色体, 有待进一步实验验证。

表1 法螺二倍体染色体计数结果Tab.1 The counting results of diploid chromosome numbers in C. tritonis
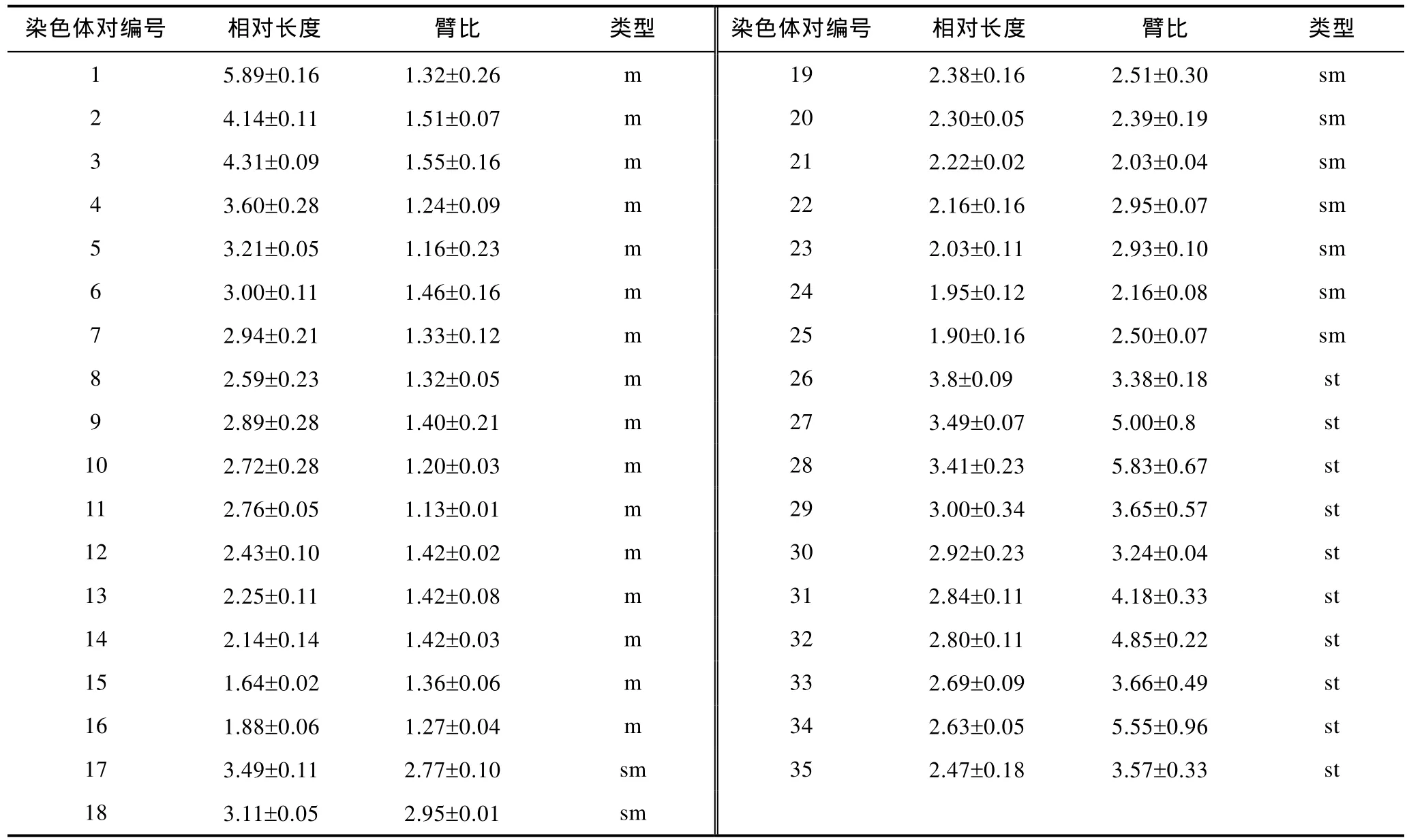
表2 法螺染色体的核型指数Tab.2 Karyotype indices of C. tritonis
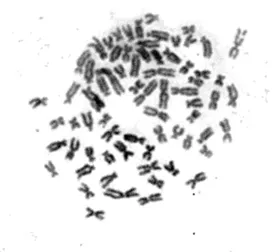
图1 法螺染色体中期分裂相Fig.1 The metaphase of chromosomes of C. tritonis

图2 法螺核型图Fig.2 The karyotype of C. tritonis
3 讨论
全世界现存软体动物约11.5万种, 其中腹足纲约88000种(周暾等, 1988), 已知染色体数目的腹足类仅291种(Thiriot-quiévreux, 2003)。已记载分布于我国的软体动物约4000余种(孙振兴, 2004), 其中相当一部分是腹足纲贝类, 但有染色体研究报道的腹足纲贝类仅10科17属27种(表3), 仅占我国贝类总数的0.68%。而中国鱼类中仅淡水种类已知核型的就达200余种(余先觉等, 1989)。可见相比于其他物种, 我国贝类染色体研究还相对滞后。这与贝类本身染色体较小, 贝类成体染色体制备技术尚不完善, 贝类幼体及胚胎染色体制备受繁殖季节限制等制约因素有关。
从表3归纳的情况来看, 中国腹足纲贝类染色体2n数目类型变异较多, 而且不连续。如, 蛾螺科内4个属就有4个2n数: 30、34、60、66; 田螺科的3个属有3个2n数: 16、18、24。这表明同一科不同属或种之间的染色体数目存在较大差异。但从染色体数目同样可以看出, 同一个属的种类染色体数目相同的居多, 如角螺属、荔枝螺属、东风螺属、环棱螺属、圆田螺属等。这又在一定程度上体现了同属腹足纲贝类在其生物进化过程中染色体数目的保守性。
早期研究认为, 贝类染色体数和系统分类有着显著的关系, 分类地位越原始, 其染色体数越少, 分化越高, 其染色体数就越多(稻叶明彦, 1985; 王梅林等, 2004; 曹伏君等, 2008)。目前, 较多研究结果也都印证了这一理论(王先志等, 1990; 叶冰莹等, 1995;陈菲等, 2011)。如Nishikawa(1962)研究显示原始腹足目染色体单倍体数多在9—21之间, 而中腹足目染色体的单倍体数多在15—18之间, 新腹足目染色体单倍体数多在在28—36之间。近年来, 我国发表的贝类染色体研究成果中, 染色体数最多的种类(香螺,2n=60; 细角螺, 管角螺, 2n=60; 泥东风螺, 方斑东风螺, 2n=66)也都隶属于新腹足目(王先志等, 1990;曹伏君等, 2008; 陈菲等, 2011)。然而本研究对我国已进行过染色体核型研究的腹足纲贝类(表3)进行统计表明, 染色体数目最少的田螺科三种环棱螺(角形环棱螺Bellamya angularis, 铜锈环棱螺Bellamya aeruginosa, 方形环棱螺Bellamya quadrata, 2n=16)和染色体数目最多的嵌线螺科的法螺(2n=70)同属于分类地位居中的中腹足目。Thiriot-quiévreux(2003)对全世界291种腹足纲贝类染色体核型统计亦显示, 原始腹足目染色体单倍体数范围为8—18之间, 中腹足目染色体的单倍体数范围在7—36之间, 新腹足目的单倍体数范围在13—36之间, 即中腹足目染色体数变化范围最大。由此可见, 若依据最新的腹足纲贝类研究成果, 至少在目的级别上, 染色体数越多进化地位越高的理论是不完全适用的。然而, 笔者同时也注意到, 若比较Thiriot-quiévreux(2003)研究中各目染色体数的平均值, 则原始腹足目<中腹足目<新腹足
目, 即原有的染色体数增加与进化相关的理论将依然成立。在腹足纲贝类中, 究竟是染色数较多的种类较为进化, 还是染色体较少的种类较为进化, 在科学界还有一定争论。如王先志等(1990)在观察了蛾螺科三种螺的核型后认为, 染色体数相近的种类,也可能染色体数较少的种类较为进化。因为不能排除染色体减少形成新物种的可能。笔者认为, 究竟贝类染色体数目与进化是何关系现在下结论还为时过早, 毕竟已知染色体数的腹足类还不到腹足类总数的1%, 大量数据还有待补充。另外, 在不同生物类群中核型的演化方式和方向可能不同, 应根据实际情况加以分析, 不能一概论之。最后, 探讨染色体与进化的关系亦不能简单停留在染色体数目和组成上, 还应包括染色体形态, 结构等多方面特征来综合判断。

表3 我国若干腹足纲贝类的染色体组型Tab.3 The karyotype of some Chinese Gastropoda
马庆惠, 王先志, 王桂云, 1988. 锈凹螺染色体制备及核型研究. 海洋科学, (3): 62—63
王先志, 王桂云, 马庆惠等, 1990. 蛾螺科三种螺的核型观察.动物学研究, 11(3): 259—262
王国棠, 1989. 湖北钉螺两个亚种核型的初步研究. 遗传,11(5): 21—23
王桂云, 1995. 玉螺科四种螺类核型的观察. 贝类学论文集(Ⅴ—Ⅵ). 青岛: 青岛海洋大学出版社, 77—80
王桂云, 马庆惠, 王先志, 1988. 皱纹盘鲍的染色体研究. 动物学研究, 9(2): 171—174
王梅林, 郑家声, 朱丽岩等, 2004. 我国海洋鱼类和贝类染色体组型研究进展. 青岛海洋大学学报, 30(2): 277—284
叶冰莹, 齐秋贞, 邱文仁, 1995. 大瓶螺(Ampullaria gigasSpix)的核型分析. 福建师范大学学报(自然科学版), 11(1):95—99
孙振兴, 2004. 中国海洋贝类染色体研究进展. 海洋通报,23(6): 77—83
余先觉, 周 暾, 李渝成等, 1989. 中国淡水鱼类染色体. 北京: 科学出版社, 1—29
张素萍, 马绣同, 2004. 中国动物志 无脊椎动物 第三十四卷腹足纲 鹑螺总科. 北京: 科学出版社, 108—109
陈 菲, 骆 轩, 沈明辉等, 2011. 两种东风螺的染色体核型.厦门大学学报(自然科学版), 50(4): 789—793
陈元晓, 张迺光, 张 闻等, 1996. 阳宗海螺蛳和螺蛳的核型研究. 动物学研究, 17(1): 94—96
陈昌生, 严正凛, 刘国柱等, 2003. 九孔鲍二倍体与三倍体核型的研究. 集美大学学报(自然科学版), 8(4): 291—294
周 暾, 周 密, 吴振东, 1988. 田螺科五种螺的核型研究.动物学报, 34(4): 364—369
曹伏君, 李长玲, 罗 杰等, 2008. 管角螺、细角螺的核型研究.广东海洋大学学报, 28(1): 15—18
管云雁, 韩雅莉, 2004. 两种荔枝螺染色体核型以及性畸变个体染色体研究. 海洋环境科学, 23(3): 21—23
稻叶明彦, 1985, 陈德牛译. 软体动物的染色体和系统分类.动物学杂志, (4): 44—48
Antonelli P L, Kazarinoff N D, 1984. Starfish predation of a growing coral reef community. Journal of Theoretical Biology, 107(4): 667—684
Bellwood D R, Hughes T P, Folke Cet al, 2004. Confronting the coral reef crisis. Nature, 429(6994): 827—833
Endean R, 1982. Crown-of-thorns starfish on the great barrier reef. Endeavour, 6(1): 10—14
Levan A, Fredga K, Sandbergm A A, 1964. Nomenclature for centrometric position on chromosomes. Hereditas, 52: 201—220
Nishikawa S, 1962. A comparative study of the chromosomes in marine gastropods, with some remarks on cytotaxonomy and phylogeny. J Shimonoseki Coll Fish, 11(3): 149—186
Thiriot-quiévreux C, 2003. Advances in chromosomal studies of Gastropod molluscs. Journal of Molluscs Studies, 69: 187—201

