精制抗副溶血弧菌卵黄抗体的制备与纯化
闫茂仓 胡伟丽 张赛乐 柴雪良 谢起浪 王雪鹏
(①浙江省海洋水产养殖研究所 浙江省近岸水域生物资源开发与保护重点实验室 浙江 温州 325005 ②温州医科大学生命科技学院 浙江 温州 ③宁波大学海洋学院 浙江 宁波 ④山东农业大学动物科技学院 山东 泰安)
近年来,随着海水养殖规模的不断扩大,病害频繁发生,成为制约养殖业健康发展的主要瓶颈之一,其中尤以弧菌病最为严重。业已证实,副溶血弧菌等是因起海水养殖动物主要致病性弧菌[1,2];目前,国内外已经开展了大量弧菌病免疫检测技术的研究,但是大多是采用多克隆抗体或多克隆抗体而建立的快速检测方法[3-5],而以卵黄抗体为免疫手段等方法建立的快速检测方法,因其具有较高的专一性和特异性,受到更大的推崇。基于此,本研究以副溶血弧菌全菌苗为免疫原制备特异性卵黄抗体,旨在为开展海水养殖动物致病性弧菌的早期快速检测和防控提供技术支持。
1 材料与方法
1.1 材料 副溶血弧菌(Vibrio parahaemolyticus),为本试验自行分离并鉴定;试验用蛋鸡,为SPF蛋鸡。
1.2 抗原的制备 将副溶血弧菌标准菌株接种于LB培养基上,28℃培养24h后,用0.65%的生理盐水将其洗脱下来,加0.3%甲醛灭活24h后,用TCBS培养基检测。用0.65%生理盐水将其洗涤3次。比浊法配置浓度为108CFU/ ml,备用。
1.3 蛋鸡的免疫 取备用的灭活浓度为108cfu/ml副溶血 弧菌悬液,加入等体积的弗氏完全佐剂或弗氏不完全佐剂,充分乳化,免疫健康海兰蛋鸡。免疫采取胸、颈、翼下4点皮下注射,首次免疫注射含弗氏完全佐剂的抗原,1.0ml/只。10d后第1次加强免疫,1.5ml/只;20d后进行第2次加强免疫,2.0ml/只。;第2次加强免疫后1周开始收集鸡蛋,根据具体效价确定是否进行进行第3次加强免疫。加强免疫时注射含弗氏不完全佐剂的抗原。同时设未免疫对照组。
1.4 初步分离、提取和纯化IgY 鸡蛋在除去蛋白后用蒸馏水漂洗得到纯卵黄液,加入9倍体积的蒸馏水,调pH5.2,4℃静置12h后10000r/min离心20min,收集上清液得到粗提物即WSF。然后滴加等体积饱和硫酸铵溶液使其饱和度达50%,4℃静置过夜后离心得到沉淀物,用等体积蒸馏水溶解后滴加饱和硫酸铵溶液使其饱和度达33%,4℃静置1h后离心得到沉淀物,用原1/2体积PBS缓冲液溶解,并用透析袋除盐。Sephadex G-200凝胶层析柱进一步纯化,冷冻干燥,-20℃保存,并通过SDS-PAGE电泳检测样品纯化效果。
2 结果
2.1 硫酸铵法粗提IgY的性状和总蛋白质含量 用硫酸铵法提取的IgY 为无气味残留,经测定,蛋白浓度为0.911±0.09mg/ml。通过SDS-PAGE电泳图谱(图1)可知,IgY的重链分子量为67 kD,轻链分子量为23kD。卵黄WSF的蛋白条带很多,硫酸铵法纯化的条带也比较清晰,杂蛋白减少很多。
2.2 SDS-PAGE检测IgY纯度 以抗副溶血弧菌特异性IgY的水溶液组分、第一次硫酸铵后溶液、第二次硫酸铵后溶液、凝胶层析后溶液为样品,用SDS-PAGE电泳检测IgY纯化情况,结果见图2。

图1 硫酸铵沉淀纯化后 IgYSDS-PAGE电泳图 m 蛋白mark;1 卵黄WSF;2 硫酸铵法粗提卵黄抗体

图2 不同纯化阶段IgY凝胶电泳图m mark;1 WSF;2第一次硫 酸铵后;3第二次硫酸铵后; 4凝胶层析后
2.3 凝胶层析纯化IgY 将硫酸铵二次盐析后PEG-6000浓缩后的样品通过Superdex G-75凝胶柱,自动收集,绘制洗脱曲线。结果见图3。
3 讨论
(1)鸡卵黄中含水48%,蛋白质17.8%,脂肪30.5%。卵黄水溶性蛋白主要由α活性蛋白、β活性蛋白、IgY(γ活性蛋白)和底密度脂蛋白组成。从卵黄中获取卵黄抗体要经过IgY的分离、提取和纯化。首先分离要去除卵黄中含量较高的脂肪和脂蛋白,获得水溶性组分(WSF)。
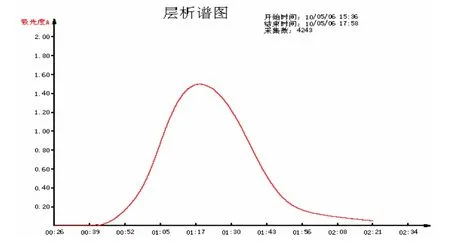
图3 IgY的凝胶洗脱图谱
目前认为水稀释法是一种简便、高效、易于大规模生产的方法。是根据相似相溶的原理,卵黄水溶性蛋白能溶于水中,初步将不溶于水的颗粒首先分离出来,然后在酸(pH5.2~ 5.3)作用下,颗粒和水溶性组分彻底分离。(2)提取纯化的目的是将IgY从水溶性蛋白混合物中分离。郑立勇[6]得出水-辛酸法优于单独酸化水提取法的结论;宋宏新[7]对其进一步研究得出水-辛酸-硫酸铵方法较好的结论。本研究应用单纯的硫酸铵纯化的方法,得到较纯的卵黄抗体,且操作简单、快速,适用于卵黄抗体的大规模纯化。(3)通过硫酸铵法提取的IgY抗体纯度较低,但如果是用来添加在饲料中预防疾病,这种纯度已达到要求;如果用来做免疫检测试剂,则还需要再通过其他方法来进一步提纯,如离子交换、凝胶层析、亲和层析等。本实验在硫酸铵沉淀后采用采取Sephadex G-200凝胶层析,制备的IgY抗体纯度较高,纯度明显高于水提和硫酸铵沉淀的样品;但凝胶层析产率较低,IgY耗损较大。
[1]鄢庆枇, 方恩华, 苏永全等.大黄鱼溶藻弧菌LPS的间接ELISA检测[J].台湾海峡, 2004, 23(1): 56-61.
[2]Sarkar B, Chowdhury N R, Nair G B, et al.molecular characterization of Vibrio parahaemolyticus of similar serovars isolated from sewage and clinical cases of diarrhoea in Calcutta, India[J].World Journal of microbiol.& Biotechnol., 2003, 19: 771-776.
[3]Davey m L, Hancock R E W, mutharia L m.Influence of culture conditions on expression of the 40 kilodolton porin protein of Vibrio anguillarum serotype O2[J].Appl.Enciron.microbiol., 1998,64: 138-146.
[4]吴后波, 潘金培.海水养殖真鲷弧菌病病原菌外毒素的点酶法检测[J].水产学报, 2003, 27(6): 606-609.
[5]樊景凤, 梁玉波, 王斌等.凡纳滨对虾红体病病原菌间接ELISA快速检测方法的研究[J].水产学报, 2006, 30(1): 13-117.
[6]郑立勇, 乔彦良, 马凤龙等.卵黄抗体不同提取方法的比较[J].动物保健品, 2009, 1: 106-107.
[7]宋宏新, 高栋, 薛海燕.卵黄免疫球蛋白的分离提取与鉴定[J].食品科技, 2003(5): 99-101.

