神经坏死病毒在赤点石斑鱼组织中的分布
刘晓丹胡先勤黄剑南翁少萍王文文陈文捷秦真东董星星周 洋刘小玲姬 伟张学振郭志勋何建国林 蠡,,
(1. 华中农业大学水产学院水生动物医学系, 武汉 430070; 2. 中山大学生命科学学院, 广州 510275;
3. 农业部淡水生物繁育重点实验室, 武汉 430070; 4. 中国水产科学研究院南海水产研究所, 广州 510300; 5. 淡水水产健康养殖湖北省协同创新中心, 武汉 430070)
神经坏死病毒在赤点石斑鱼组织中的分布
刘晓丹1胡先勤1黄剑南2翁少萍2王文文1陈文捷1秦真东1董星星1周 洋1刘小玲1姬 伟1张学振3郭志勋4何建国2林 蠡1,3,5
(1. 华中农业大学水产学院水生动物医学系, 武汉 430070; 2. 中山大学生命科学学院, 广州 510275;
3. 农业部淡水生物繁育重点实验室, 武汉 430070; 4. 中国水产科学研究院南海水产研究所, 广州 510300; 5. 淡水水产健康养殖湖北省协同创新中心, 武汉 430070)
研究采用地高辛原位杂交和免疫荧光检测技术分别检测病毒 RNA2和衣壳蛋白在患病赤点石斑鱼Epinephelus akaara稚鱼中分布。地高辛检测结果表明病毒RNA2主要分布在脑、脊髓、视网膜和鳃上; 免疫荧光检测结果和地高辛检测结果一致, 表明病毒靶器官主要也是脑、脊髓、视网膜和鳃。肠道中几乎检测不到阳性信号, 可能不是病毒的靶器官。因此可以推测神经坏死病毒感染赤点石斑鱼的主要途径是鳃, 而不是肠道。
神经坏死病毒; 赤点石斑鱼; 地高辛原位杂交; 免疫荧光; 组织分布
病毒性疾病严重危害我国水产养殖业的健康发展, 近年来我国学者报道了不少新生病毒性疾病[1—4], 其中病毒性神经坏死症(Viral nervous necrosis virus, VNN)是一种在世界范围内流行的鱼类疾病。VNN流行在中国、日本、澳大利亚、英国、加拿大、挪威等国家, 可造成30多种重要经济鱼类的大规模死亡, 严重危害着鱼类养殖业[5], 因此该病毒是国际水产病害研究的热点。神经坏死病毒分类上属于野田病毒科(Nodaviridae), 乙型野田病毒属(Betanodavirus)。病毒粒子直径约30—40 nm, 二十面体, 无囊膜, 由衣壳和两条正单链 RNA基因组RNA1和RNA2组成[6]。其中RNA1编码病毒RNA聚合酶和非结构蛋白B2。RNA2编码病毒唯一的衣壳蛋白。在光学显微镜下, 患病鱼类在脑部和视网膜有明显空泡, 故又称病毒性脑膜炎和视网膜病[7,8]。在透射电镜下可观察到患病鱼脑、视网膜细胞质中存在大量病毒粒子[7,8]。
神经坏死病毒严重危害我国经济鱼类, 特别是石斑鱼的养殖。2001年中国率先报道了赤点石斑鱼Epinephelus akaara病毒性神经坏死症[9], 随后开展组织病理[10]、流行病学[11]、衣壳蛋白的克隆和表达[12—14]、全基因组测定[15]等研究。我国其他学者也做大量研究, 主要包括病理学[16], RT-PCR检测方法[17—19]、全基因组测定[20]、流行病学[21,22]、免疫保护[23]、致病性[24,25]、新细胞株建立[26]、基因干扰载体等[27]。地高辛杂交和免疫荧光检测技术可分别检测病毒核酸和蛋白在患病组织中的分布, 为病毒的感染和复制提供重要信息。至今为止国内还缺乏此类基础资料。我们团队曾建立地高辛标记DNA探针原位杂交技术[28]; 本文采用地高辛标记 DNA探针和NNV衣壳蛋白特异性抗体, 研究NNV核酸和蛋白在患病赤点石斑鱼稚鱼组织中分布, 探讨了此病毒的感染途径和复制位点, 为防治此病提供基础资料。
1 材料与方法
1.1 试验材料
赤点石斑稚鱼为广东省大亚湾水产试验中心所生产, 全长0.3—0.5 cm, 孵化后20d—30d。患病鱼苗体弯曲、体色较黑、身体失衡、浮于水面、间或螺旋状游动, 为典型病毒性神经坏死病症状(图1)。用赤点石斑神经坏死病毒特异性引物对稚鱼脑部总RNA做 RT-PCR检测, 患病鱼样品呈阳性, 健康鱼样品呈阴性。

图1 患病赤点石斑稚鱼(示体色异常)Fig. 1 Juveniles of red-spotted grouper with abnormal body color
1.2 组织切片
用10%中性福尔马林固定稚鱼。鱼苗先经透蜡固定, 然后在70%的酒精中处理2h, 80%酒精中2h, 90%酒精中2h, 95%酒精中1h, 100%酒精中1h, 100%酒精中3次每次0.5h, 酒精和二甲苯比例为3︰1溶液中0.5h, 纯二甲苯中2次每次0.5h, 58℃石蜡中透蜡 2h, 然后将样品和石蜡置于冰上, 降温凝固。将透蜡固定后的组织进行切片, 厚度为 0.4—0.5 μm,自然风干。
1.3 PCR 引物名称和序列
根据神经坏死病毒衣壳蛋白基因序列(NC 008041.1)设计三条引物: F1 (5′-GGATTTGGACGTG CGACCAA-3′), R3 (5′-CGAGTCAACACGGGTGAA GA-3′), F2 (5′-CGTGTCAGTCATGTGTCGCT-3′)。其中F1和R3用于扩增RNA2编码衣壳蛋白的T2片段(875 bp), F2和R3用于扩增RNA2编码衣壳蛋白的T4片段(426 bp)[29]。T2片段的3′和T4片段完全重叠。
1.4 地高辛探针制备
取患病鱼苗的头部(包括眼睛), 用 TRIZOL (Life Technologies) RNA抽提试剂盒, 按照使用说明进行RNA抽提。用F2-R3引物合成T4片段来制备地高辛探针。先将提纯的 RNA在沸水中煮 5min, 然后置于冰上5min。取1 μL上述RNA, 加入事先配制好的逆转录反应液中, 每一反应液含有(5×First strand buffer 2 μL, 0.1 mol/L DDT 1 μL, 2.5 mmol/L dNTP mixture 4 μL, R3引物(20 pmol) 0.5 μL, 核酸酶抑制剂(Life Technologies) 0.1 μL, SUPERSCRIPTTMⅡ逆转录酶(Life Technologies) 0.2 μL, 焦碳酸二乙酯(DEPC)处理过的蒸馏水 1.2 μL), 在 42℃中反应30min, 99℃中10min灭活逆转录酶。将上述逆转录反应产物稀释70倍, 采用Boehringer Mannheim 公司生产的地高辛试剂盒(DIG DNA Labeling and Detection Kit )生产探针。PCR反应液: vial3 buffer 5 μL, vial2 buffer 5 μL,引物F2 (20 pmol)0.5 μL, 引物R3 (20pmol) 0.5 μL, vial1(聚合酶)0.75 μL, 稀释的逆转录产物 5 μL, 加蒸馏水到 50 μL, 先 95 ℃, 2min, 然后30个循环, 循环条件为95 ℃, 10s; 60 ℃, 30s; 72 ℃ , 3min;最后在72℃延长7min, 4℃中10min。反应产物在 1.5%琼脂糖胶中电泳, 溴化乙锭染色, 照相记录结果。
1.5 地高辛探针特异性检测
采用神经坏死病毒衣壳蛋白基因引物F1和R3扩增T2片段(875 bp), F2和R3扩增T4片段(426 bp)。用地高辛标记探针对上述产物进行杂交, 以确认其特异性。取神经坏死病毒特异性扩增PCR片段T2和T4, 在2%琼脂糖胶中120 V电泳1h。对电泳胶用蒸馏水泡洗 3次, 每次 30s。在摇床上(50 r/min)将电泳胶置于变性液中处理 30min, 再用蒸馏水浸泡3次, 每次30s。在中性缓冲液中浸泡15min, 然后用湿法将DNA片段转移到尼龙膜。随后用2×SSC浸泡 10min, 在 80℃中处理 2h。将尼龙膜浸泡于9.5 mL预杂交液中68 ℃ , 1h。将地高辛探针在沸水中热变性10min, 置于冰上5min, 取2 μL探针加到1 mL杂交液中, 充分混合。将尼龙膜浸泡于含有探针的杂交液中, 密封避光 68℃杂交 6h。随后用2×SSC, 0.1% SDS (w/v) 25 mL洗2次, 每次5min。用0.1×SSC, 0.1%SDS (w/v) 20 mL洗2次, 每次15min。将尼龙膜置于空气中干燥。用地高辛核酸检测试剂盒进行检测如下。用 Buffer I (1 mol/L Tris·HCl, 1.5 mol/L NaCl, pH 7.5), 0.3% Tween20 (w/v) 洗1min, 然后用25 mL Buffer II (0.5% 阻断剂溶解于Buffer I中)洗30min, 用5 mL Buffer2按1︰5000的比例稀释vial3(抗地高辛耦联抗体), 在室温中培育30min。然后用15 mL Buffer1洗2次, 每次15min, 用 5 mL Buffer III (0.1 mol/L Tris·HCl, 1.5 mol/L NaCl, pH 9.5, MgCl250 mmol/L)浸泡2min。在新鲜配制的显色液2.5 mL处理12h, 然后用10 mL Buffer IV (100 mmol/L Tris·HCl, 10 mmol/L EDTA, pH8.0), 洗5min, 显色、照相记录结果。
1.6 组织切片的地高辛检测
切片先在 60℃中烘 45min, 然后进行脱蜡和复水: 在纯二甲苯中处理2次, 每次10min; 50%二甲苯、50% 酒精混合液中处理5min; 依次在100%和95% 乙醇中各处理2次, 每次2min; 在80%、70%和 50% 酒精中各处理一次, 每次 3min, 最后在蒸馏水中复水3min。用蛋白酶K在37℃中消化2min,用0.4%甲醛固定5min。将地高辛探针在沸水中热变性10min, 立即置于冰上5min, 然后混合在1 mL杂交液中。将杂交液加到切片上, 密封避光于 42℃杂交 12h。漂洗与显色: 在 2×SSC 溶液[0.05% N-lauroylsarcosine (w/v), 0.01 % SDS (w/v), 0.4%封闭液]中 37℃处理2次, 每次5min; 1×SSC溶液中37℃处理2次, 每次5min; 0.5×SSC溶液中37℃处理2次, 每次5min; 0.1×SSC溶液中37℃处理2次,每次5min, Buffer I 中25℃处理5min; Buffer II 中37℃处理 15min; 在 37℃中, 用地高辛耦联抗体培育1h(Buffer II按1︰3000倍稀释抗体); 在25℃用Buffer I洗2次, 每次5min; 用Buffer III在25℃中洗5min; 用 Buffer III稀释 NBT/BCIP显色液(浓度为 20 μL/mL), 在 25℃中避光杂交过夜。随后在Buffer IV中25 ℃ 洗15min; 蒸馏水洗3min, 封片。用光学显微镜观察结果, 拍照。
1.7 免疫荧光检测
切片先在纯二甲苯中处理2次, 每次5min; 然后依次在100%、90% 和70% 酒精中各处理2min,最后在蒸馏水中复水 2次, 每次 1min。用 1×PBS (137 mmol/L NaCl, 2.7 mmol/L KCl, 10 m mol/L Na2HPO4, 1.8 mmol/L KH2PO4, pH 7.4)洗3次, 每次5min; 用0.1%的蛋白酶K在37℃中处理10min, 用0.4%甲醛固定5min, 用1×PBS洗3次, 每次5min,用兔抗拟 鲹神经坏死病毒衣壳蛋白血清(日本森广一郎博士惠赠)1︰100稀释, 在37℃孵育30min, 用1× PBS洗3次, 每次5min。用山羊抗兔Ig G耦联FITC血清抗体(1︰36), 在 37℃中孵育 30min, 用1×PBS洗3次, 每次5min, 用60% 封片专用甘油进行封片, 荧光显微镜观察, 拍片。
2 结果
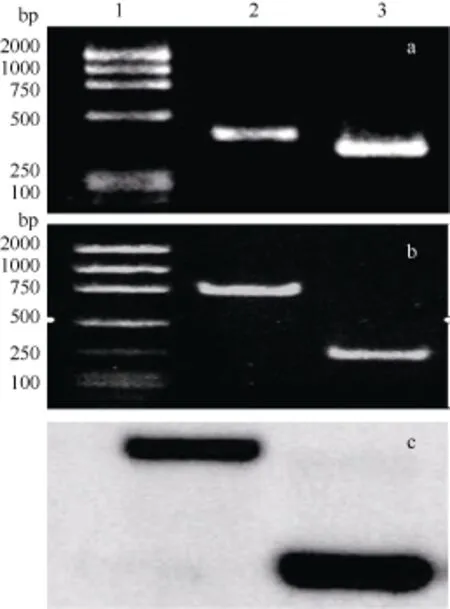
图2 地高辛探针的制备和特异性检测Fig. 2 Preparation of DNA probe labeled with digoxigenin (DIG) and its specificity
2.1 探针的制备和特异性检测
采用RT-PCR法, 扩增病毒衣壳蛋白T4片段。因为反应中用DIG-dUTP代替TTP来制备地高辛探针, DIG-dUTP分子量比TTP大, 因此地高辛探针的分子量也比T4 (426 bp)大(图2a)。为了检验探针的特异性, 对病毒衣壳蛋白T2 和T4 两段DNA进行杂交。结果表明探针和2个片段都有杂交。从图中可以看出, 虽然PCR条带T2在溴化乙锭染色的信号强于T4 (图2b), 但是地高辛信号T4强于T2(图2c), 这是因为地高辛探针序列和 T4完全一致, 和T2只有49%的同源。另外, DNA 标准分子没有和探针杂交, 这些结果表明地高辛探针具有很高的特异性(图2 c)。
2.2 组织切片的地高辛检测

图 3 赤点石斑鱼稚鱼的地高辛原位杂交检测 (箭头示阳性反应, a-e 为感染稚鱼; f为健康鱼)Fig. 3 DIG-in situ hybridization results of the juvenile of redspotted grouper (positive signal was shown by arrow, a-e were from infected juvenile; f was from non-infected juvenile)
根据碱基互补配对原则, 标记有 DIG的 DNA片段可以和病毒基因组RNA2杂交。因此地高辛探针可以检测病毒在体内的复制、转录状况。杂交阳性显色为黄色到紫褐色, 颜色越深, 病毒RNA含量越高。根据图 3结果, 患病石斑鱼稚鱼的脑部、脊髓、视网膜和鳃上皮细胞内可以观察黄色到紫褐色,其中以脑部和视网膜内层脉络膜细胞颜色最深, 甚至连成一片。在肝细胞内也可观察分散的褐色颗粒,但是在肠道中几乎没有检测到阳性信号。作为阴性对照, 健康石斑鱼稚鱼相应的组织没有明显的黄褐色, 图3f显示阴性对照视网膜的检测结果。因此, 病毒主要在脑部、视网膜和鳃上皮细胞内复制或转录。
2.3 免疫荧光法检测
免疫荧光的第一抗体为兔抗神经坏死病毒衣壳蛋白血清, 因此其检测信号代表病毒衣壳蛋白在组织中的分布。衣壳蛋白可以来自病毒粒子, 也可以来自没有组装成病毒粒子的蛋白。阳性反应呈绿色荧光, 衣壳蛋白越多, 绿色荧光越强。图4表示, 患病石斑鱼稚鱼的脑部、脊髓、视网膜和鳃上皮细胞内可以观察到强绿色荧光, 在肝细胞内只是较弱荧光, 在肠道几乎没有检测到阳性信号。作为阴性对照, 健康石斑鱼稚鱼相应的组织没有明显的绿色荧光, 图4G显示阴性对照视网膜的检测结果。因此, 病毒粒子主要分布在感染稚鱼的脑部、视网膜和鳃上皮细胞内, 或者在这些器官内进行病毒蛋白的翻译。
3 讨论
本文采用地高辛探针和免疫荧光法分别检测病毒核酸和衣壳蛋白在感染稚鱼中的分布。两种检测方法检测到病毒在感染稚鱼体内的分布一致。病毒核酸和衣壳蛋白在脑、脊髓、视网膜、鳃上都有大量的分布, 肝脏中有少量分布, 在肠道组织中几乎没有分布。虽然病毒在肝脏中有少量分布, 但是其分布是分散点状, 没有连成一片, 而且并不导致肝脏细胞的空泡化坏死。为什么病毒感染只导致神经和视网膜的空泡化坏死, 其机理还不清楚, 需要进一步探索。Chi等[30]采用地高辛探针对石斑鱼苗进行组织分布检测, 结果表明, 脑、视网膜、鳃、肝、肠和心脏的血细胞中均有分布, 并认为鳃和肠道可能是病毒的入侵途径。根据本实验的结果, 肠道中几乎没有检测到病毒的核酸和衣壳蛋白信号, 因此肠道是否为传播途径, 值得探讨。鳃上皮可以检测到强的阳性信号, 有理由认为鳃是病毒的主要感染途径。当然, 本文的研究结果也不能排除还有其他的传播途径, 比如通过皮肤等, 这需要进一步研究。有趣的是, Chi等[30]采用RT-PCR法血检测到病毒存在于石斑鱼幼鱼的血液中, 并认为病毒在体内可以通过血液传播到其他器官, 在疾病的发生上具有重要意义。由于稚鱼的血液采集比较困难, 本文无法提供这方面的信息, 需要进一步探讨。
神经坏死病毒的感染途径和复制研究是重要的基础信息[31]。各国学者对病毒的聚合酶、衣壳蛋白、B2蛋白的功能进行了研究[32—34], 为病毒的致病机理提供了基础资料。此外, 最近研究认为病毒可以存在于受精卵的卵膜内, 碘试剂只能消毒受精卵表面, 无法彻底切断病毒的垂直传播[35]。因此, 对于神经坏死病毒的有效防治还需要更多的研究积累。

图4 赤点石斑鱼稚鱼的免疫荧光检测 (箭头示阳性反应, A-F 为感染稚鱼; G为健康鱼)Fig. 4 Immunofluorescent results of the juvenile of red-spotted grouper (positive signal was shown by arrow, A-F were from infected juvenile; G was from non-infected juvenile)
[1] Luo X, Deng G C, Zhao C C, et al. Isolation and preliminary identification of rhabdovirus from Channa maculata cultured in pond [J]. Acta Hydrobiologica Sinica, 2013, 37(4): 620—625 [罗霞, 邓国成, 赵长臣, 等. 池塘养殖斑鳢弹状病毒的分离与初步鉴定. 水生生物学报, 2013, 37(4): 620—625]
[2] Zeng W W, Wang Q, Liu Y K, et al. Isolation and identification of new GCRV strain and primary study on its immunogenicity [J]. Acta Hydrobiologica Sinica, 2011, 35(5): 790—795 [曾伟伟, 王庆, 刘永奎, 等. 一株草鱼呼肠孤病毒弱毒株的分离、鉴定及免疫原性初步分析. 水生生物学报, 2011, 35(5): 790—795]
[3] Xiao F, Zhang Q Y. Molecular biology of Iridoviruses from aquatic animals [J]. Acta Hydrobiologica Sinica, 2004, 28(2): 202—206 [萧枫, 张奇亚. 水生动物虹彩病毒的分子生物学. 水生生物学报, 2004, 28(2): 202—206]
[4] Gui L, Li Z Q, Zhang Q Y. Isolation and charaterization of a rhabdovirus from diseased flounder Paralichthys olivaceus [J]. Acta Hydrobiologica Sinica, 2007, 31(3): 345—353 [桂朗, 李正秋, 张奇亚. 牙鲆一株弹状病毒病原的分离与鉴定. 水生生物学报, 2007, 31(3): 345—353]
[5] Munday B L, Wang J K, Moody N. Betanodavirus infections of teleost fish: a review [J]. Journal of Fish Diseases, 2002, 25(3): 127—142
[6] Mori K, Nakai T, Muroga K, et al. Properties of a new virus belonging to nodaviridae found in larval striped jack (Pseudocaranx dentex) with nervous necrosis [J]. Virology, 1992, 187(1): 368—371
[7] Yoshikoshi K, Inoue K. Viral nervous necrosis in hatchery-reared larvae and juveniles of Japanese parrotfish, Oplegnathus fasciatus (Temminck & Schlegel) [J]. Journal of Fish Diseases, 1990, 13(1): 69—77
[8] Glazebrook J S, Heasman M P, Beer S W. Picorna-like viral particles associated with mass mortalities in larval barramundi, Lates calcarifer Bloch [J]. Journal of Fish Diseases, 1990, 13(3): 245—249
[9] Lin L, He J G, Mori K, et al. Massmortalities associated withviral nervous necrosis in hatchery-reared groupers in the People’s Republic of China [J]. Fish Pathology, 2001, 36(3): 186—188
[10] Lin L, Huang J N, Weng S P, et al. Histopathological examination and electron microscopy observation of viral nervous necrosis in red-spotted grouper, Epinephelus akaara [J]. Journal of Fisheries of China, 2005, 29(4): 519—523 [林蠡, 黄剑南, 翁少萍, 等. 赤点石斑鱼病毒性神经坏死症的组织病理和电镜观察. 水产学报, 2005, 29(4): 519—523]
[11] Huang J N, Lin L, Weng S P, et al. Genotypic Analysis of nervous necrosis virus isolate from red spotted grouper (Epinephelus akaara) in Dayawan Bay, People’s Republic of China [J]. High Technology Letters, 2004, 14(11): 75—80 [黄剑南, 林蠡, 翁少萍, 等. 中国大亚湾赤点石斑鱼神经坏死病毒分离株的基因型分析. 高技术通讯, 2004, 14(11): 75—80]
[12] Huang J N, Lin L, Weng S P, et al. Molecular cloning and sequence analysis of complete coat protein gene of nervous necrosis virus from Epinephelus akaar [J]. Journal of Fisheries of China, 2005, 29(3): 429—432 [黄剑南, 林蠡,翁少萍, 等. 赤点石斑神经坏死病毒外壳蛋白全基因克隆与序列分析. 水产学报, 2005, 29(3): 429—432]
[13] Huang J N, Lin L, Weng S P, et al. High expression of capsid protein of red-spotted grouper nervous necrosis virus in an avian cell line requires viral RNA2 non-coding regions [J]. Journal of Fish Diseases, 2007, 30(7): 439—444
[14] Huang J N, Lin L, Weng S P, et al. Purification and Western-blot assay of the capsid protein of red-spotted grouper nodavirus [J]. South China Fisheries Science, 2005, 1(5): 33—36 [黄剑南, 林蠡, 翁少萍, 等. 赤点石斑鱼诺达病毒的纯化及其衣壳蛋白的Western-blot分析. 南方水产, 2005, 1(5): 33—36]
[15] Chen X Y, Weng S P, Lü L, et al. Sequences of RNA1 and RNA2 from orange- spotted grouper (Epinephelus coioids) nervous necrosis virus, China strain [J]. Journal of Sun Yatsen University, 2005, 44(1): 73—77 [陈晓艳, 翁少萍,吕玲, 等. 斜带石斑神经坏死病毒基因组RNA1和RNA2序列测定及分析. 中山大学学报, 2005, 44(1): 73—77]
[16] Song Z R. Intercross infection and spread of nervous necrosis virus in Pseudocaranx dentex [J]. Journal of Fishery Sciences of China, 2003, 10(6): 462—468 [宋振荣.神经坏死症病毒对长缟 鲹仔鱼的感染及在体内的传播.中国水产科学, 2003, 10(6): 462—468]
[17] Chen X Z, Su Y L, Gong Y Q, et al. Detection of nervous necrosis virus from five cultured groupers (Epinephelus spp.) using RT-PCR [J]. Journal of Fishery Sciences of China, 2004, 11(3): 202—207 [陈信忠, 苏亚玲, 龚艳清, 等. 逆转录聚合酶链式反应(RT-PCR)检测 5种养殖石斑鱼的神经坏死病毒. 中国水产科学, 2004, 11(3): 202—207]
[18] Luo W, Li H F, Liu H, et al. Development and application of a real-time RT-PCR assay for fish viral nervous necrosis virus [J]. Journal of Fishery Sciences of China, 2008, 15(3): 506—510 [罗卫, 李惠芳, 刘荭, 等. 鱼类神经坏死病毒实时荧光 RT-PCR检测方法的建立和应用. 中国水产科学, 2008, 15(3): 506—510]
[19] Xu H D, Feng J, Guo Z X, et al. Detection of red-spotted grouper nervous necrosis virus by loop-mediated isothermal amplification [J]. Journal of Virological Method, 2010, 163(1): 123—128
[20] Liu H, Teng Y, Zheng X C, et al. Complete sequence of a viral nervous necrosis virus (NNV) isolated from red-spotted grouper (Epinephelus akaara) in China [J]. Archives of Virology, 2012, 157(4): 777—782
[21] Jiang F J, Gao L Y, He J Q, et al. Isolation and characterization of viral nervous necrosis virus (VNNV) [J]. Journal of Huazhong Agricultural University, 2008, 27(3): 409—413 [蒋方军, 高隆英, 何俊强, 等. 鱼类病毒性神经坏死病毒的分离和部分特性研究. 华中农业大学学报, 2008, 27(3): 409—413]
[22] Su Y L. Epidemiologic investigation of viral nervous necrosis in cage-cultured rockfishes in Xiamen [J]. Marine Sciences, 2008, 32(9): 52—56 [苏亚玲. 网箱养殖石斑鱼病毒性神经坏死病流行调查. 海洋科学, 2008, 32(9): 52—56]
[23] Su Y L, Guo Z X, Feng J, et al. Protective efficacy of recombinant mcp of viral nervous neccrosis virus vaccine on Rachycentron canadum juveniles [J]. Biotechnology Bulletin, 2009, (S1): 228—241 [苏友禄, 郭志勋, 冯娟, 等. 神经坏死病毒MCP重组疫苗对军曹鱼稚鱼的免疫保护. 生物技术通报, 2009, (S1): 228—241]
[24] Xu H D, Qu Y J, Guo Z X, et al. The pathogenicity of nervous necrosis virus to Trachinotus ovatus and sequence analysis of the coat protein gene [J]. Journal of Shanghai Ocean University, 2010, 19(4): 482—488 [许海东, 区又君,郭志勋, 等. 神经坏死病 毒对卵形鲳鲹 的致病性及外壳蛋白基因序列分析. 上海海洋大学学报, 2010, 19(4): 482—488]
[25] Yan Y F, Su Y L, Guo Z X, et al. The research on pathogenicity of fish nervous necrosis virus to Rachycentron canadum juvenile [J]. Marine Sciences, 2010, 34(4): 6—10 [闫云锋, 苏友禄, 郭志勋, 等. 鱼类神经坏死病毒对军曹鱼仔鱼的致病性. 海洋科学, 2010, 34(4): 6—10]
[26] Qin Q W, Wu T H, Jia T L, et al. Development and characterization of a new tropical marine fish cell line from grouper (Epinephelus coioides) susceptible to iridovirus andnodavirus [J]. Journal of Virological Methods, 2006, 131(1): 58—64
[27] Huang G J, Chen J G, Yu D H. Construction and evaluation of short hairpin RNA interference vector targeting CP gene of Epinephelus coioides nervous necrosis virus [J]. Journal of Fisheries of China, 2012, 36(3): 343—349 [黄桂菊, 陈健光, 喻达辉. 斜带石斑鱼神经坏死病毒CP基因shRNA干扰载体的构建及效果评价. 水产学报, 2012, 36(3): 343—349]
[28] Chen X Y, He J G. Application of in situ hybridization in testing orange-sported grouper nervous necrosis virus [J]. Marine Sciences, 2008, 32(6): 1—4 [陈晓艳, 何建国. 原位杂交技术在斜带石斑鱼神经坏死病毒检测中的应用. 海洋科学, 2008, 32(6): 1—4]
[29] Nishizawa T, Mori K, Nakai T, et al. Polymerase chain rection (PCR) amplification of RNA of striped jack nervous necrosis virus (SJNNV) [J]. Disease of Aquatic Organisms, 1994, 18: 103—107
[30] Chi S C, Lo C F, Lin S C. Characterization of grouper nervous necrosis virus [J]. Journal of Fish Diseases, 2001, 24(1): 3—13
[31] Huang J N, Guo Z X, Feng J, et al. Piscine nodavirus and its pathogenesis [J]. Journal of Fisheries of China, 2006, 30(6): 831—836 [黄剑南, 郭志勋, 冯娟, 等. 鱼类诺达病毒及其所导致的疾病. 水产学报, 2006, 30(6): 831—836]
[32] Guo Y X, Chan S W, Kwang J. Membrane association of greasy grouper nervous necrosis virus protein A and characterization of its mitochondrial localization targeting signal [J]. Journal of Virology, 2004, 78(12): 6498—6508
[33] Guo Y X, Wei T, Dallmann K, et al. Induction of caspase-dependent apoptosis by betanodaviruses GGNNV and demonstration of protein alpha as an apoptosis inducer [J]. Virology, 2003b, 308(1): 74—82
[34] Fenner B J, Goh W, Kwang J. Dissection of double-stranded RNA binding protein B2 from betanodavirus [J]. Journal of Virology, 2007, 81(11): 5449—5459
[35] Kuo H C, Wang T Y, Hsu H H, et al. Nervous necrosis virus replicates following the embryo development and dual infection with iridovirus at juvenile stage in grouper [J]. PloS One, 2012, 7: e36183
DISTRIBUTION OF NERVOUS NECROSIS VIRUS IN THE JUVENILE RED-SPOTTED GROUPERS (EPINEPHELUS AKAARA) BY IN SITU HYBRIDIZATION AND IMMUNOFLUEORESCENT ASSAYS
LIU Xiao-Dan1, HU Xian-Qin1, HUANG Jian-Nan2, WENG Shao-Ping2, WANG Wen-Wen1, CHEN Wen-Jie1, QIN Zhen-Dong1, DONG Xing-Xing1, ZHOU Yang1, LIU Xiao-Ling1, JI Wei1, ZHANG Xue-Zhen3, GUO Zhi-Xun4, HE Jian-Guo2and LIN Li1,3,5
(1. Department of Aquatic Animal Medicine, College of Fisheries, Huazhong Agricultural University, Wuhan 430070, China; 2. School of Life Sciences, Sun Yat-Sen University, Guangzhou 510275, China; 3. Key Lab of Freshwater Animal Breeding, Ministry of Agriculture, Wuhan, 430070, China; 4. South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China; 5. Hubei collaborative Innovation Center for Freshwater Aquaculture, Wuhan, 430070, China)
Nervous necrosis virus (NNV) is a pathogen that infects more than 30 species of economically important fish worldwide. It causes high mortality among juveniles, larvae and even adult fish, and results in significant threat to aquaculture industry. Studying the distribution of NNV in the infected fish may help to understand the pathogenicity. In the present study, we used DIG-in situ hybridization and immunofluorescent assays to evaluate NNV distribution in the infected red-spotted grouper juveniles. The results of DIG-in situ hybridization showed that viral RNA2 was mainly detected in the brain, spinal cord, retina and gill. The immunofluorescent staining results indicated that viral capsid protein was mainly observed in the same tissues. However, both RNA2 and capsid protein were barely detected in the intestine, which indicated that the virus infection may go through the gills instead of the intestine.
NNV; Epinephelus akaara; DIG-in situ hybridization; Immunofluorescent assay; Tissue distribution
S941.4
A
1000-3207(2014)05-0876-07
10.7541/2014.131
2013-08-09;
2014-03-02
国家自然科学基金面上项目“ 鱼类神经坏死病毒B2蛋白线粒体定位对病毒的复制调控”; 中央高校基本科研业务费专项资金项目“水生经济动物病毒性疾病的综合防治研究”; 中央高校基本科研业务费专项资金项目“鱼类感染与免疫学研究”联合资助
刘晓丹(1989—), 女, 河南巩义人; 硕士研究生; 主要从事病毒的分子生物学与免疫学研究。E-mail: l910110526@ 126.com; 胡先勤(1978—), 女, 安徽舒城人; 博士研究生; 主要从事病毒的分子生物学与免疫学研究。E-mail: huxianqin@163.com. *刘晓丹和胡先勤对此文有同等贡献
林蠡, E-mail: linli@mail.hzau.edu.cn; 何建国, E-mail: lsshjg@mail.sysu.edu.cn
- 水生生物学报的其它文章
- GILL MEDIATES IMMUNE RESPONSES AFTER GRASS CARP REOVIRUS CHALLENGE IN GRASS CARP (CTENOPHARYNGODON IDELLA)
- MORPHOLOGICAL OBSERVATION AND RBCL SEQUENCE ANALYSIS OF A NEW SPECIES FROM CHINA, GRATELOUPIA BOAOENSIS WANG ET LUAN SP. NOV.(HALYMENIACEAE, RHODOPHYTA)
- GILL MEDIATES IMMUNE RESPONSES AFTER GRASS CARP REOVIRUS CHALLENGE IN GRASS CARP (CTENOPHARYNGODON IDELLA)
- 养殖密度对俄罗斯鲟幼鱼的生长、生理和免疫指标的影响
- 一种快速构建集胞藻6803 petBD必需基因定点突变株的方法
- 大通湖环棱螺的次级生产力

