不同壳色三角帆蚌外套膜基因的SRAP-cDNA差异分析
闻海波曹哲明金 武顾若波华 丹黄晓飞徐 跑
(1. 中国水产科学研究院淡水渔业研究中心, 农业部淡水鱼类遗传育种与养殖生物学重点开放实验室, 无锡 214081; 2. 中国水产科学研究院淡水渔业研究中心, 中美淡水贝类种质资源保护及利用国际联合实验室, 无锡, 214081; 3. 南京农业农业大学, 无锡渔业学院, 无锡 214081)
不同壳色三角帆蚌外套膜基因的SRAP-cDNA差异分析
闻海波1,2,3曹哲明1金 武1顾若波1,2华 丹2黄晓飞3徐 跑1,2,3
(1. 中国水产科学研究院淡水渔业研究中心, 农业部淡水鱼类遗传育种与养殖生物学重点开放实验室, 无锡 214081; 2. 中国水产科学研究院淡水渔业研究中心, 中美淡水贝类种质资源保护及利用国际联合实验室, 无锡, 214081; 3. 南京农业农业大学, 无锡渔业学院, 无锡 214081)
三角帆蚌幼蚌壳表面颜色和放射条纹表型遗传分离均符合孟德尔单基因位点的一对等位基因调控规律。研究为进一步阐释其壳色遗传分子调控机制, 应用群体分离分析法(BAS)和 SRAP-cDNA 比较了两种典型外壳色表型三角帆蚌外套膜组织的基因表达差异。采用30个引物组合获得5个差异片段, 回收克隆测序获得14条差异序列, 大小在195—339 bp之间, 通过序列比对, 获得与2个相似蛋白序列, 包括类二氢嘧啶脱氢酶和类锌指MYM-1型蛋白, 而未发现与色素合成相关基因和蛋白, 但三角帆蚌外壳色表型差异是否与嘧啶代谢和类锌指蛋白参与的基因表达调控有关还有待进一步研究。
三角帆蚌; 壳色表型; 外套膜; SRAP-cDNA; 差异基因
贝类的壳色由外套膜表皮分泌形成, 曾被认为是一种简单的表型性状而被忽视。对许多贝类的研究表明: 壳色不仅与贝类的生态和行为有关[1—3],还与其生长、存活等表型性状密切相关[4—8]。在国内外, 以壳色为选育标记, 已经成功选育出了高产白色珍珠的日本珍珠贝(Pinctada fucata martensii Dunker)[9]、生长快、抗病力强的“玛瑙鲍”、金黄壳色的太平洋牡蛎(Crassostrea gigas)[10]、高产的“中科红”海湾扇贝(Argopecten irradians irradians Lamarck)、“中国红”皱纹盘鲍(Haliotis discus Hannai)及“南科珍珠红”马氏珠母(Pinctada martensii Dunker)等多个贝类新品种(系), 为世界海水贝类养殖发展与繁荣做出了重大贡献。壳色与生产性状协同选育已经成为海水贝类新品种选育最为有效的技术手段之一。
与海水贝类相比, 淡水贝类壳色较为单调、表型简单, 其壳色遗传研究未受到普遍关注。三角帆蚌(Hyriopsis cumingii)是我国最主要的淡水经济贝类之一。闻海波等[11]首次报道了三角帆蚌F1代幼蚌的壳色表型遗传分离规律, 初步研究揭示: 三角帆蚌的壳色和放射条纹分别受单基因位点的一对等位基因调控。对大多数海水贝类的壳色遗传机制研究也表明: 贝类的壳色受到单个基因位点或少数基因位点的调控, 这有利于运用分子生物技术寻找与壳色相关的分子标记。筛选与壳色相关基因和分子标记, 有助于研究与贝类生长、发育及成活之间的关系, 有利于开展贝类壳色与生产性状的协同选育。国内已采用RAPD[12]、细胞色素酶[13]、微卫星[14]等多种分子生物技术开展了三角帆蚌遗传背景分析,为其遗传改良和品种选育奠定了重要基础, 而与三角帆蚌壳色相关的基因及分子标记的研究尚未开展。SRAP
(Sequence Re1ated Amplified Polymorphism)是Li和Quiros 2001年提出的一种基于PCR的新型分子标记, 其反应模板多数是基因组 DNA,也可以是cDNA [15]。SRAP-cDNA技术已成功运用于芸薹属、棉花、甜瓜、野牛草、桃、西葫芦、笋瓜等经济作物的遗传图谱构建、遗传多样性分析及比较基因组学研究[16]。在水产动物上主要以 DNA为模版, 对草鱼[17]、 鲀暗纹东方[18]、马氏珠母贝“南科珍珠红”品系[19]及青虾[20]等品种进行 SRAP分子标记筛选、分离及遗传图谱构建。本文采用SRAP-cDNA示差技术, 拟筛选与三角帆蚌壳色表型差异相关序列, 通过克隆、测序及信息比对, 获得与壳色形成相关基因或蛋白序列, 为揭示三角帆蚌壳色遗传表达机制及壳色新品系选育提供理论依据。
1 材料与方法
1.1 实验材料及来源
实验蚌为2010年建立的三角帆蚌A5家系的F1代幼蚌, 该家系中出现 2种典型的外壳色表型: 青褐壳色具放射条纹和金黄壳色不具放射条纹(图1)。2011年5月从中随机选取2种壳色表型1龄幼蚌各10只, PC8000电子称测量湿重(0.1 g)、IP6数显卡尺测量壳长、壳高、壳宽(0.01 mm)常规生物学性状; 青褐壳色具放射条纹和金黄壳色不具放射条纹幼蚌体重分别为(8.0 ± 2.4) 、(8.8 ± 2.4) g, 壳长为(48.97 ± 4.64)、(51.53 ± 4.03) mm。

图1 两种壳色表型的三角帆蚌幼蚌Fig. 1 Two different shell color phenotypes in juvenile Hyriopsis cumingii
1.2 组织总RNA提取
用解剖刀取新鲜外套膜边缘膜约 50 mg, 采用柱式动物组织总RNA抽提纯化试剂盒(上海生工生物工程有限公司)提取组织总 RNA, 在琼脂糖凝胶上检测 RNA的质量和浓度。采用集群分离分析法,取同一壳色表型的10份基因组RNA等量混合, 构建两种不同壳色表型的基因混合池。
1.3 单链cDNA的合成
以组织RNA为模版, 选取AMV First Strand cDNA Synthesis Kit (BIO BASIC INC) 合成单链cDNA。
1.4 SRAP -cDNA示差分析
SRAP-PCR反应采用25 µL的反应体系, 体系中包括以下成分: DNA 模板3 µL, dNTP (2.5 mmol/L) 1.5 µL, 10×Taq DNA聚合酶缓冲液2.5 µL, MgCl2 (25 mmol/L) 2.5 µL, 正向引物和反向引物(表 1)各0.5 µL, Taq DNA聚合酶0.2 µL, 无菌重蒸水14.3 µL。PCR反应所需试剂及引物均购自上海生工生物工程公司。
在Eppendorf Master cycler PCR仪上进行基因扩增。扩增程序为: 94℃变性5min; 然后开始5个循环(94℃变性45s, 38℃退火45s, 72℃延伸l min); 再进行30个循环(94℃变性1min, 55℃退火1min, 72℃延伸l min); 最后72℃延伸7min。扩增产物先在2%的琼脂糖凝胶上电泳, EB染色, 检测扩增产物的有无, 然后用6%的非变性聚丙烯酰胺凝胶分型, 银染显色、拍照、记录数据。将初步筛选到2个的差异序列后, 再用同一引物对所有个体进行验证, 确认为差异表达序列再进行回收。

表1 SRAP正反引物序列Tab. 1 Sequences of SRAP F-Primer and R-Primer
1.5 特异扩增片段的回收、克隆、测序及比对将特异片
段直接从凝胶上切下, 用100 μL双蒸水浸泡5min, 弃去洗涤水, 重复三次, 然后用50 μL双蒸水浸泡, 用枪头将胶捣烂, 70℃保温30min作为模板。特异片断的扩增反应总体积为 25 μL, 包括1.5 μL稀释连接产物, 1.5 μL 10×PCR buffer, 45 pmol HpaⅡ–MspⅠ预扩引物, 1.5 μL dNTPs (2.5 mmol), 2 U Taq 酶, 加水至25 μL。反应程序: 94℃变性5min;然后94℃变性20s, 56℃复性30s, 72℃延伸2min, 反应进行30个循环。扩增产物1%的琼脂糖凝胶电泳,用胶回收试剂盒回收, 克隆进pMD18-T载体, 每个差异条带挑选4个质粒, 送上海生物工程公司测序。获得导入的DNA序列在NCBI上进行比对, 寻找相似的DNA序列或蛋白序列。
2 结果
2.1 SRAP- cDNA示差分析
用30个引物组合扩增得到455条扩增带, 初步获得差异表达带5条, 对所有个体进行验证, 确认5条带均为差异条带。其中4条来自青褐壳具放射条纹群体, 1条来自金黄壳色不具放射条纹群体。图2为5个引物组合扩增结果图谱, 其中A 和B为扩增差异片段, 均出现在青褐壳色群体中。

图2 SRAP-cDNA扩增图谱Fig. 2 SRAP-cDNA amplification patterns
2.2 序列比对分析
本研究得到5个差异片段, 克隆测序得到14条不同的序列(表 2), 序列长度在 195—339 bp之间,其中仅3-2-1序列来自金黄壳色群体, 其余13条均来自青褐壳色群体。用NCBI的Blastn程序比对未找到这些序列的相似序列。采用BlastX程序比对发现: 由1-2、2-2引物组合扩增获得的6条差异序列编码蛋白类均似于二氢嘧啶脱氢酶, 鳉与青(Oryzias latipes)类二氢嘧啶脱氢酶蛋白318—354区域的相似度为 43%, 该序列位于蛋白 A亚基区域; 5-1-2序列编码蛋白与冠轮动物海蠕虫(Capitella teleta)的一个未知蛋白 40—66区域相似度为 48%;由5-2引物组合扩增获得的2条序列编码均类似于锌指蛋白MYM-1型蛋白, 其中5-2-2序列编码蛋白与大乳头水螅(Hydra magnipapillata)类锌指MYM-1型蛋白的46—90区域相似度为42%, 且位于未知功能结构域中; 5-2-4序列编码蛋白与大乳头水螅的类锌指MYM1型蛋白77—108区域相似度为53%, 而与大堡礁海绵(Amphimedon queenslandica)类锌指MYM-1型蛋白208—246区域相似度为46%, 均位于该蛋白的未知功能结构域中; 由 3-2引物组合扩增的 1条序列编码也类似二氢嘧啶脱氢酶, 是金黄壳色群体的唯一差异条带。其中5-1-1差异序列(16个GA重复)和5-2-3差异序列(23个CA重复)中各出现有一个微卫星序列。
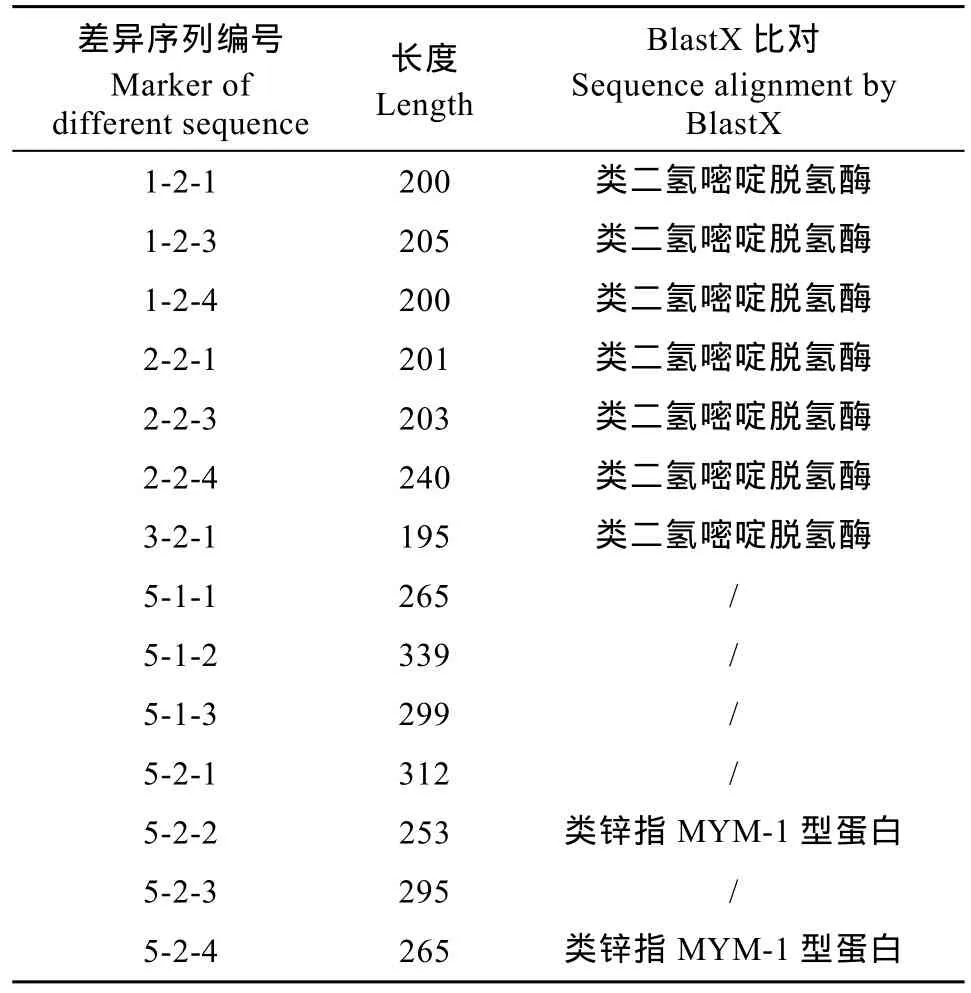
表2 差异序列的BlastX比对Tab. 2 Different sequences alignment by BlastX
3 讨论
与AFLP-cDNA技术相比, SRAP-cDNA具有两大优点: 第一、技术流程简单, 不需要第二链的合成,且能够检测到某些低水平表达的基因, 实验成本低;第二、多数产生高强带, 重叠少, 得到的差异序与蛋白质相关性更高。Dinler等[21]利用SRAP技术研究翦股颖(禾本科)不同个体的序列表达标签, 通过比较这些序列发现很多个体特异的序列都是同源的, 可以用于蛋白质组的比较。Gui等[22]利用SRAP研究Brassica allotetraploids异源多倍体化发现, 异源多倍体化的可以激活大约1.3%的在二倍体中不表达的转录单元。卢泳全等[23]应用SRAP技术对大米草的耐盐性状进行差异显示研究, 鉴定出一个与水稻葡聚糖酶基因有30%相似性的差异片段。马爱芬等[24]选用培育7年的重组自交系群体(RILs), 利用SRAP-cDNA技术进行了差异显示研究, 996对SRAP引物组合扩增出2100条带, 2次扩增重复率为65.2%,其中在黄黑籽材料之间重复稳定出现的差异片段有12条, 发现2个片段分别与拟南芥的NAD+ADP核糖转移酶及小肽转移蛋白3具有很高的同源性。
本文尝试将SRAP-cDNA技术应用在三角帆蚌外壳色基因差异表达分析, 采用30个引物组合共扩增出455个条带, 仅有5个差异序列, 差异序列占总数1.1%, 说明外壳色差异涉及的基因较少, 也进一步证实三角帆蚌外壳色性状可能受到少数基因位点调控, 与外壳色表型在F1代幼蚌中分离符合孟德尔单基因调控的规律的结论相符[11]。通过进一步克隆测序获得14条差异序列, 由于三角帆蚌的目前序列知之甚少, 未比对到相似基因序列, 但找到了与2个相关蛋白序列: 类二氢嘧啶脱氢酶和类锌指MYM-1型蛋白, 进一步证实了SRAP-cDNA技术具有容易寻找到相关序列蛋白的特点。
二氢嘧啶脱氢酶(Dihydropyrimidine dehydrogenase, DPD)是嘧啶分解途径的限速酶, 它催化尿嘧啶和胸腺嘧啶分别还原为二氢尿嘧啶和二氢胸腺嘧啶, 体内80%的5-氟尿嘧啶由DPD降解[25], 其编码基因(DPYD)的突变是二氢嘧啶脱氢酶活性降低和引起氟化嘧啶类化疗药物毒性的重要原因之一。在青褐色群体中出现了6条差异条带的编码蛋白均类似二氢尿嘧啶脱氢酶, 推测三角帆蚌壳色形成可能与嘧啶代谢途径中的某些蛋白相关。锌指结构于1983年首先发现于爪蟾5S RNA基因的转录因子IIIA (TFIIIA), 其三维结构由一个含有大约30个氨基酸的环和一个与环上的4个Cys或2个Cys和2个His配位的Zn2+构成, 形成的结构类似手指状, 该蛋白广泛存在于生物体基因组中, 占据大于人类基因组1%的基因, 能与特定DNA序列、RNA及蛋白结合, 与细胞分化、胚胎发育及人类多种疾病相关[26]。本研究获得两种不同外壳色三角帆蚌的外套膜的2种相似蛋白, 而未发现与相关色素合成的基因和蛋白, 但三角帆蚌外壳色表型是否与这两种基因或蛋白的表达差异有直接关系, 仍有待进一步的研究。
在海洋贝类中已找到一些与壳色相关的分子标记。Qin, et al.[27]对海湾扇贝的研究中, 将壳色基因分别作为母本标记和父本标记, 并同时进行雌性及雄性连锁图谱的构建, 壳色标记定位在了雌性图谱第九连锁群上; 利用 AFLP技术在海湾扇贝中找到了 6个与壳色相关的分子标记, 其中两个标记Flf335和D8f420与壳色基因之间遗传图距为0 cM,经过在家系和群体中初步验证, 证明这两个标记与橘黄壳色位点紧密或完全连锁。相比之下, 在扩增出的 10个微卫星中却未找到与壳色相关的分子标记。孙秀俊等[28]用 RAPD 技术对比了虾夷扇贝(Patinopecten yessoensis)白色贝和褐色贝群体的遗传差异, 发现位点 S285-1在褐色贝 75% 的个体中都能获得扩增片段, 但在白色贝所有个体中都没有这个位点的扩增片段, 由此推断该位点的缺失与壳色存在一定的关系。朱东丽等[29]利用AFLP筛选到一个细纹文蛤品系的特有分子标记, 出现频率为1.00; 利用微卫星标记技术, 对4个壳色花纹品系的文蛤(Meretrix meretrix)进行了遗传分析, 从中筛查出与壳色花纹相关的微卫星标记[30]。进一步以本文的差异序列为基础设计特异 TRAP引物, 筛选出稳定壳色 SCRA标记, 从而更加全面揭示三角帆蚌外壳色形成的分子遗传机制, 为壳色定向选育提供有力的工具。
[1] Mitton J B.Shell color and pattern variation in Mytilus edulis and its adaptive significance [J]. Chesapeake Science, 1977, 18(4): 387—390
[2] Odile L, Luc M, Jacques D. Temperature and phenotypic plasticity in the shell color and banding of the land snail Helix aspersa [J]. Animal Biology, 1998, 321: 649—654
[3] Sokolova I M, Berger V J. Physiological variation related to shell color polymorphism in white sea Littotina saxatilis [J]. Journal of Experimental Marine Biology and Ecology, 2000, 245: 1—2
[4] Newkirk G F. Genetics of shell color in Mytilus edulis L. and the association of growth rate with shell color [J]. Journal of Experimental Marine Biology and Ecology, 1980, 47(1): 89—94
[5] Fiqueroa E, Brand E, Winkler F. Shell color polymorphism and growth in the Chilean oyster Tiostrea chilensis [J]. Journal of Shellfish Research, 1992, 1(1): 194
[6] Brand E, Kijima A, Fujio Y. Shell color polymorphism and growth in the Japanese scallop, Patinopecten yessoen [J]. Tohoku Journal of Agricultural Research Sendm, 1994, 44: 67—76
[7] Zheng H P, Zhang G F, Liu X, et al. Establishment of different shell color lines of Bay scallop Argopecten irradians irradians Lamarck (1819) and their development [J]. Oceanologia et Limnologia Sinica, 2003, 34(6): 632—639 [郑怀平, 张国范, 刘晓, 等.不同贝壳颜色海湾扇贝(Argopecten irradians)家系的建立及生长发育的研究.海洋与湖沼, 2003, 34(6): 632—639]
[8] Cheng P, Yang A G, Wu B, et al. The applicability analysison microsatellite markers for parentage determination of different shell color lines of japanese scallop Patinopecten yessoensis [J]. Acta Hydrobiologica Sinica, 2011, 35(5): 768—775 [程鹏, 杨爱国, 吴彪, 等. 微卫星标记在不同壳色虾夷扇贝家系亲权鉴定的适用性. 水生生物学报, 2011, 35(5): 768—775]
[9] Wada K T, Komaru A. Color and weight of pearls produced by grafting the mantle tissue from a selected population for white shell color of the Japanese pearl oyster Pinctada fucata martensii (Dunker) [J]. Aquaculture, 1996, 142: 25—32
[10] Nell J A. The history of oyster farming in Australia [J]. Marine Fisheries Review, 2001, 63: 14—25
[11] Wen H B, Gu R B, Cao Z M, et al. Variation of color and ray pattern in juvenile shells in hatchery-produced freshwater triangle pearl mussels, Hyriopsis cumingii, in China [J]. Journal of the World Aquaculture Society, 2013, 44(1): 154—160
[12] Li J L, Dong Z G, Zheng H F. RAPD analysis on genetic variance of F1of Hyriopsis cumingii from three populations [J]. Journal of Fisheries of China, 2007, 31(6): 848—852 [李家乐, 董志国, 郑汉丰.三角帆蚌三种群F1遗传差异的RAPD分析.水产学报, 2007, 31(6): 848—852]
[13] Xiao T Y, Liu Q L, Guo X Z, et al. Cloning and expression analysis of cytochrome P450 homolog from Hyriopsis cumingii [J]. Acta Hydrobiologica Sinica, 2012, 36(5): 987—992 [肖调义, 刘巧林, 郭小泽, 等. 三角帆蚌细胞色素 P450基因的克隆与表达分析. 水生生物学报, 2012, 36(5): 987—992]
[14] Li J L, Wang G L, Bai Z Y. Genetic variability in four wild and two farmed stocks of the Chinese freshwater pearl mussel (Hyriopsis cumingii) estimated by microsatellite DNA markers [J]. Aquaculture, 2009, 287: 286—291
[15] Li G, Quiros C F. Sequence-related amplified polymorphism (SRAP), a new marker system based on a simple PCR reaction: its application to mapping and gene tagging in Brassica [J]. Theoretical and Applied Genetics, 2001, 103: 455—461
[16] Gui Q, Wang J L, Wu X M, et al. Application of SRAP-cDNA method in analysis of differential gene expression in plants [J]. Chinese Journal of Oil Crop Sciences, 2007, 29(4): 497—502 [桂琴, 王嘉璐, 伍晓明,等.SRAP-cDNA 方法在植物基因差异表达分析中的应用.中国油料作物学报, 2007, 29(4): 497—502]
[17] Ding W D, Cao L P, Cao Z M. The SRAP and SCAR molecular markers for detecting germ degeneration in Ctenopharyngodon idellus [J]. Acta Zoologica Sinica, 2008, 54(3): 475—481 [丁炜东, 曹丽萍, 曹哲明.草鱼种质相关SRAP及SCAR的分子标记.动物学报, 2008, 54(3): 475—481]
[18] Cheng C H, Zhang M Y, Liu K, et al. Analysis of genetic diversity of four Takifugu obscurus populations using SRAP markers [J]. Acta Hydrobiologica Sinica, 2012, 36(5): 858—865 [程长洪, 张敏莹, 刘凯, 等. 利用SRAP标记研究四个暗纹东方 鲀群体的遗传多样性. 水生生物学报, 2012, 36(5): 858—865]
[19] Zhang H Y, He M X, Guan Y Y. SRAP analysis on genetic variation of the different generations of a red shell family in pearl oyster, Pinctada martensi Dunker [J]. Journal of Fisheries of China, 2009, 33(5): 727—733 [张红玉, 何毛贤,管云雁.马氏珠母贝红色壳家系不同世代遗传变异的SRAP分析.水产学报, 2009, 33(5): 727—733]
[20] Qiao H, Wu Y, Fu H T, et al. Construction of a genetic linkage map for oriental river prawn (Macrobrachium nipponense) using SSR and SRAP markers [J]. Journal of Fishery Sciences of China, 2012, 19(2): 202—210 [乔慧, 吴滟, 傅洪拓, 等.应用SSR和SRAP标记构建青虾遗传连锁图谱.中国水产科学, 2012, 19(2): 202—210]
[21] Dinler G, Budak H. Analysis of expressed sequence tags (ESTs) from Agrostis species obtained using sequence related amplified polymorphism [J]. Biochemical Genetics, 2008, 46: 663—676
[22] Gui Q, Wang J L, Xu Y H, et al. Expression changes of duplicated genes in allotetraploids of Brassica detected by SRAP-cDNA technique [J]. Molekulyarnaya Biologiya, 2009, 43(1): 3—9
[23] Lu Y Q, Wu W R. Identification of salt-responsive genes in English cordgrass (Spartina anglica) roots using SRAP technique [J]. Journal of Zhejiang University (Agriculture and Life Science), 2006, 32(5): 511—514
[24] Ma A F, Li J N, Chen L, et al. Differential display of related genes to seed-coat color by cDNA-SRAP in Brassica napus L. [J]. Acta Agronomica Sinica, 2008, 34(3): 526—529 [马爱芬, 李加纳, 谌利, 等.甘蓝型油菜种皮色泽相关基因的 cDNA-SRAP 差异显示.作物学报, 2008, 34(3): 526—529]
[25] Van Kuilenburg A B, Haasjes J, Richel D J, et al. Clinical implications of dihydropyrimidine dehydrogenase (DPD) deficiency in patients with severe 5-fluorouracil-associated toxicity: identification of new mutations in the DPD gene[J]. Clinical Cancer Research, 2000, 6: 4705—4712
[26] Ganss B, Jheon A. Zinc finger transcription factors in skeletal development [J]. Critical Reviews in Oral Biology and Medicine, 2004, 15(5): 282—297
[27] Qin Y J, Liu X, Zhang H B, et al. Identification and Mapping of amplified fragment length polymorphism markers linked to shell color in bay scallop, Argopecten irradians irradians (Lamarck, 1819) [J]. Marine Biotechnology, 2007, 9: 66—73
[28] Sun X J, Yang A G, Liu Z H, et al. RAPD analysis of genetic diversity of Patinopecten yessoensis with different shell colors [J]. Progress in Fishery Sciences, 2009, 30(6): 110—117 [孙秀俊, 杨爱国, 刘志鸿, 等.两种壳色虾夷扇贝的RAPD分析.渔业科学进展, 2009, 30(6): 110—117]
[29] Zhu D L, Lin Z H, Dong Y H, et al. Genetic variation analysis of four strains of Meretrix meretrix that have different shell colors and decorative patterns [J].Oceanologia et Limnologia Sinica, 2011, 42(3): 374—379 [朱东丽, 林志华, 董迎辉, 等.文蛤4个壳色花纹品系的遗传差异分析.海洋与湖沼, 2011, 42(3): 374—379]
[30] Zhu D L, Dong Y H, Lin Z H, et al. Genetic analysis among four strains of different shell colors and decorative patterns of Meretrix meretrix using microsatellite markers [J]. Journal of Fisheries of China, 2012, 36(2): 202—208 [朱东丽, 董迎辉, 林志华, 等.利用微卫星标记对文蛤4个壳色花纹品系的遗传分析.水产学报, 2012, 36(2): 202—208]
ANALYSIS OF DIFFERENTIAL GENE EXPRESSION BY SRAP-cDNA IN MANTLE TISSUE OF HYRIOPSIS CUMINGII WITH DIFFERENT EXTERNAL SHELL COLOR
WEN Hai-Bo1,2,3, CAO Zhe-Ming1, JIN Wu1, GU Ruo-Bo1,2, HUA Dan2, HUANG Xiao-Fei3and XU Pao1,2,3
(1. Key Laboratory of Genetic Breeding and Aquaculture Biology of Freshwater Fishes, Ministry of Agriculture, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, China; 2. Sino-US Cooperative Laboratory for Germplasm Conservation and Utilization of Freshwater Mollusks, Freshwater Fisheries Research Center, Wuxi, Jiangsu 214081, China; 3. Wuxi Fishery college, Nanjing Agriculture University, Wuxi 214081, China)
The segregation of shell coloration and presence of radial rays in the juvenile freshwater mussel, Hyriopsis cumingii, follows Mendelian inheritance modes of a single gene locus with one pair of dominant/recessive alleles. To elucidate the mechanisms of external shell color formation, gene expression of two typical shell colors was analyzed by bulked segregant analysis (BSA) and SRAP-cDNA. Five differential gene segments were obtained by SRAP-cDNA using 30 primers’ combinations, and 14 fragments with the size ranging from 195 bp to 339 bp were obtained after reclaim and clone. Using BlastX, these fragments could encode two similar proteins, dihydropyrimidine dehydrogenase (DPD) and MYM-1 Zn Finger protein, and no protein related to pigment could be encoded. Further directions should focus on the relationship between shell color phenotype and pyrimidine metabolism by similar Zn finger proteins in the triangle pearl mussels.
Hyriopsis cumingii; Shell color phenotype; Mantle tissue; SRAP-cDNA; Differential genes
Q344+.1
A
1000-3207(2014)05-0848-06
10.7541/2014.127
2013-07-10;
2014-02-11
国家公益性行业科研专项(200903028); 中央级公益性科研院所基本科研业务专项(20l1JBFA18)资助
闻海波(1980—), 男, 江苏靖江人; 博士, 助理研究员; 主要从事淡水贝类种质资源保护及利用研究。E-mail: wenhb@ffrc.cn
顾若波(1963—), 男, 江苏无锡人; 硕士, 研究员; 主要从事水产动物遗传及养殖研究。E-mail: gurb@ffrc.cn
- 水生生物学报的其它文章
- GILL MEDIATES IMMUNE RESPONSES AFTER GRASS CARP REOVIRUS CHALLENGE IN GRASS CARP (CTENOPHARYNGODON IDELLA)
- MORPHOLOGICAL OBSERVATION AND RBCL SEQUENCE ANALYSIS OF A NEW SPECIES FROM CHINA, GRATELOUPIA BOAOENSIS WANG ET LUAN SP. NOV.(HALYMENIACEAE, RHODOPHYTA)
- GILL MEDIATES IMMUNE RESPONSES AFTER GRASS CARP REOVIRUS CHALLENGE IN GRASS CARP (CTENOPHARYNGODON IDELLA)
- 养殖密度对俄罗斯鲟幼鱼的生长、生理和免疫指标的影响
- 一种快速构建集胞藻6803 petBD必需基因定点突变株的方法
- 大通湖环棱螺的次级生产力

