正交实验优化川明参多糖超声提取工艺
董红敏,李素清,牛小勇,沈丽雯,李 路,秦 文,*
(1.四川农业大学食品学院,四川雅安625014;2.阆中县供销合作社,四川阆中637400)
正交实验优化川明参多糖超声提取工艺
董红敏1,李素清1,牛小勇2,沈丽雯1,李 路1,秦 文1,*
(1.四川农业大学食品学院,四川雅安625014;2.阆中县供销合作社,四川阆中637400)
研究超声波水提醇沉法提取川明参多糖的最佳工艺。通过单因素实验和正交实验对提取工艺进行优化设计,采用苯酚-硫酸比色法测定多糖含量,考察料液比、超声提取温度、超声功率、超声作用时间和超声提取次数对川明参多糖提取率的影响。得出影响川明参多糖提取率的先后次序为:料液比>超声提取温度>超声功率>超声作用时间。最佳提取工艺条件为温度70℃,超声功率140W,料液比1∶40,提取时间45min,提取2次。该工艺条件下,川明参多糖的平均提取率为47.13%。
川明参,超声提取,多糖,正交实验
川明参是伞形科(Umbelliferae)植物川明参属“chuanminshen violaceum Sheh et Shan”的干燥根,又名明参、明沙参、土明参、沙参,是我国特有的单种属植物,是四川产道地药材。具有滋阴补肺,健脾等功效,主治热病伤阴,肺热咳嗽,脾虚食少,病后体弱[1-2]。川明参中含有多糖、香豆素、黄酮、甾醇、蛋白质和氨基酸、有机酸、酚类等化学成分[3]。其中多糖含量最高。已有的研究表明川明参多糖具有抗突变作用,镇咳、祛痰,免疫调节作用,抗疲劳、抗氧化作用以及抗病毒作用等[4-7],可广泛应用于医药和保健食品领域,市场前景广阔,因此高效提取川明参多糖具有重要意义。
目前,对川明参多糖提取的研究,主要采用热水浸提法或热回流法[8-9],这些方法具有能耗大,效率低,提取温度高,容易造成多糖降解,多糖活性降低等缺点。而超声波提取由于具有简单、方便、快速、得率高且不影响有效成分等优点,近年来被广泛应用到植物活性成分的提取中[10]。而有关川明参多糖超声提取的研究尚未有报道。
本实验采用超声波法提取川明参多糖,用苯酚-硫酸比色法对川明参多糖进行含量测定,详细研究并优化了超声波法提取川明参多糖的工艺条件,为川明参多糖提取的工业化应用提供参考。
1 材料与方法
1.1 材料与仪器
新鲜川明参 2013年春由四川阆中供销社提供;葡萄糖、石油醚、无水乙醇、浓硫酸、苯酚 均为分析纯,成都市科龙化工试剂厂。
FW177型中药粉碎机 天津市泰斯特仪器有限公司;KQ5200DB型数控超声波清洗器 昆山市超声仪器有限公司;UV-3200型扫描型紫外可见分光光度计 上海美普达仪器有限公司;SC-04型低速离心

1.2.3 单因素实验 以蒸馏水为提取剂,分别就料液比、超声温度、超声功率、超声作用时间和超声次数做单因素实验。
1.2.3.1 料液比 固定超声温度50℃,超声功率80W,超声作用时间15min,超声次数2次,考察不同料液比(g/mL)1∶10、1∶20、1∶30、1∶40、1∶50对川明参多糖提取率的影响。
1.2.3.2 超声温度 固定超声功率80W,超声作用时机 安徽中科中佳科学仪器有限公司;RE-52AA型旋转蒸发器 上海亚荣生化仪器厂;101-4型恒温鼓风干燥箱 上海一恒科学仪器有限公司;Heto Power Dry PL3000型冻干机 美国Thermo Scientific公司;电子天平 北京赛多利斯仪器系统有限公司。
1.2 实验方法
1.2.1 川明参多糖超声波水提醇沉工艺流程 新鲜川明参→干燥→粉碎→过筛→脱脂、脱色、除小分子糖→干燥→超声提取→过滤→浓缩→醇沉过夜→离心→沉淀复溶→除蛋白质→醇沉→离心、洗涤沉淀→真空冷冻干燥→粗多糖。
将新鲜川明参清洗除去泥土等杂质,置于鼓风干燥箱中,60℃,干燥,至恒重,粉碎,过80目筛,石油醚:95%乙醇(V∶V)1∶1回流脱脂、脱色和除去小分子糖[11],滤渣60℃干燥,密封保存备用。
1.2.2 川明参多糖含量测定 采用苯酚-硫酸比色法测定[12]。
1.2.2.1 标准曲线的绘制 精密称取105℃烘干至恒重的标准葡萄糖对照品0.1g(精确到0.0001g),加蒸馏水溶解并定容于100mL容量瓶中,得到1mg/mL的标准溶液,分别精密吸取2、4、6、8、10mL于100mL容量瓶中定容得到20、40、60、80、100μg/mL的葡萄糖标准溶液。分别移取上述葡萄糖标准溶液2mL,置于具塞试管中,各加质量分数为5%的苯酚溶液1mL,摇匀,迅速滴加浓硫酸5.0mL,摇匀后室温放置5min,置沸水浴中加热15min,迅速冷却至室温,另以蒸馏水2mL加苯酚和浓硫酸,同上操作为空白对照[13]。采用扫描型紫外可见分光光度计在300~800nm范围内扫描,在最大吸收波长处测定吸光度。以葡萄糖质量浓度(μg/mL)为横坐标,吸光度(A)为纵坐标,绘制吸光度-葡萄糖质量浓度的关系曲线。
1.2.2.2 供试品溶液的制备 采用水提醇沉法制备粗多糖,醇沉方法参考张梅等[14],并有所改动。称取适量预处理后的川明参粉,用蒸馏水按一定的料液比(川明参粉∶蒸馏水,g/mL)、超声提取温度、超声功率、超声作用时间及提取次数超声提取,趁热减压抽滤,滤液浓缩至10~15mL,加无水乙醇至体积分数为80%沉淀多糖,静置过夜,离心,沉淀部分用蒸馏水溶解,稀释一定倍数得川明参多糖待测液。
1.2.2.3 川明参多糖含量的测定 准确移取2mL一定稀释倍数的川明参多糖待测液,按照1.2.2.1的操作方法加入苯酚和浓硫酸,以蒸馏水代替样品作为空白,于489nm处测定吸光度值,平行测定三次,计算川明参多糖提取率。间15min,超声次数2次,采用以上选出的结果,考察超声温度30、40、50、60、70、80℃对川明参多糖提取率的影响。
1.2.3.3 超声功率 固定超声作用时间15min,超声次数2次,采用以上选出的结果,考察超声功率80、100、120、140、160、180W对川明参多糖提取率的影响。
1.2.3.4 超声时间 固定超声次数2次,其他条件采用以上选出的结果,考察提取时间15、30、45、60min对川明参多糖提取率的影响。
1.2.3.5 超声次数 采用以上选出的结果为固定条件,提取4次,测定每一次川明参多糖的提取率。
1.2.4 川明参多糖超声提取的正交实验设计 在单因素实验的基础上,采用四因素三水平,按L9(34)正交设计[15]进行川明参多糖超声提取正交实验,各因素及水平设计如表1所示,每组实验重复3次。
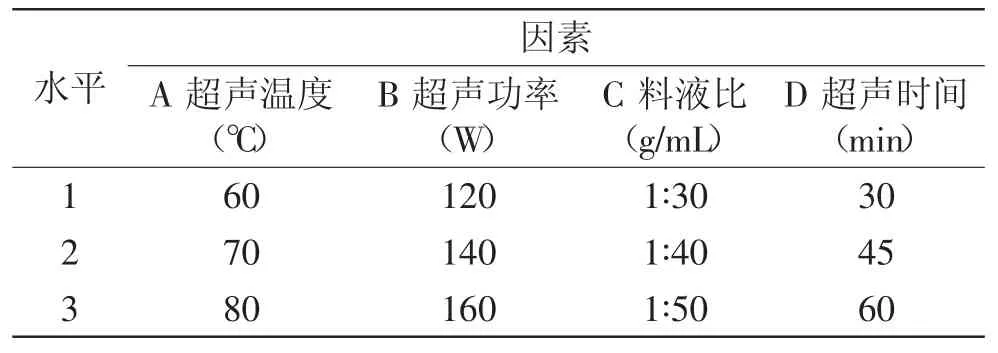
表1 L9(34)正交实验因素水平表Table 1 Factors and levels of the L9(34)orthogonal design
1.2.5 超声提取法与常规提取法的比较 分别对超声提取法、常温浸渍法、热浸提法进行川明参多糖的提取率的测定,比较三者的优劣。
2 结果与分析
2.1 标准曲线的绘制
按1.2.2.1方法,经扫描后得到波长489nm为最大吸收波长,即489nm为测定波长。以葡萄糖质量浓度(μg/mL)为横坐标,吸光度(A)为纵坐标,绘制吸光度-葡萄糖质量浓度的关系曲线,得到标准曲线方程:y=0.0133x+0.0127,r=0.9992。结果表明,葡萄糖标准溶液的质量浓度在20~100μg/mL范围内与吸光度具有良好的线性关系。

图1 料液比对川明参多糖提取率的影响Fig.1 Effect of solid-liquid ratio on the extraction yield of polysaccharides from chuanminshen violaceum
2.2 单因素实验
2.2.1 料液比对川明参多糖提取率的影响 实验结果如图1所示,在料液比1∶10~1∶40时,川明参多糖提取率增加,并由增长缓慢到逐渐加快,这是因为在传质过程中,随着提取剂的增加,溶液中多糖浓度逐渐稀释,增加了固相与液相间多糖的浓度差,加快了传递速度,当料液比达到1∶40时,提取率达到最大,但料液比1∶50时提取率明显下降,可能是因为料液比过大,增加了超声波破碎细胞的阻力,使细胞破碎程度下降,从而降低了多糖的提取率[16],也有可能是其他杂质溶出抑制了多糖的溶出。此外,随着蒸馏水量的增加,提取液浓缩的难度加大,浓缩时间过长也会影响多糖的提取率。因此,综合各因素,选择最佳料液比为1∶40。
2.2.2 超声温度对川明参多糖提取率的影响 实验结果如图2所示,超声温度低于70℃时,提取温度越高,川明参多糖的提取率越高,这是因为低温时,超声波未能使细胞彻底破碎,而随着温度的增加,分子的热运动加速,进一步破坏了细胞结构,从而使多糖充分释放;温度高于70℃后,多糖的提取率下降,这是因为高温和超声波破碎的协同作用导致部分川明参多糖破坏和降解,影响了川明参多糖的提取率[17-18]。因此,川明参多糖的超声提取温度不宜超过70℃。
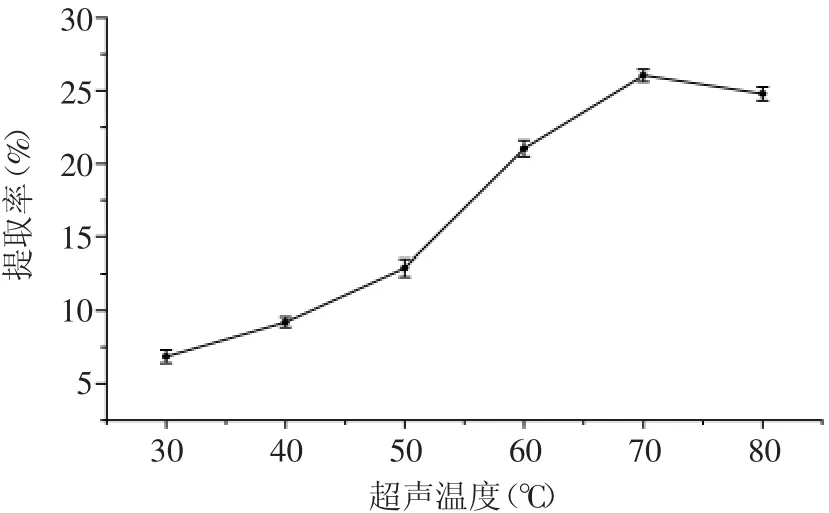
图2 超声温度对川明参多糖提取率的影响Fig.2 Effect of extraction temperature on the extraction yield of polysaccharides from chuanminshen violaceum
2.2.3 超声功率对川明参多糖提取率的影响 实验结果如图3所示,在超声功率80~140W时,随着功率的增大,川明参多糖的提取率逐渐增加,超声波功率为140W时,提取率达到最大值,当功率超过140W时,多糖提取率逐渐降低。这可能是因为超声时间固定,超声波的破碎作用主要取决于超声波的功率,功率越大,超声波对细胞的破碎作用越强,但当超声功率大于一定程度时,提取液的流动加速,减少了物料在超声场中的停留时间,细胞破碎作用也就随之减弱[16]。另外,高功率作用可能会导致多糖分子糖苷键的断裂,从而影响多糖提取率。因此超声功率以140W为宜。
2.2.4 超声时间对川明参多糖提取率的影响 实验结果如图4所示,在10~45min时,多糖的提取率随着超声时间的增加而明显提高,45min时川明参多糖提取率最高,随着时间的继续延长,多糖提取率呈下降趋势。这可能是因为随着时间的增加,川明参细胞破碎度逐渐增大,多糖溶出量逐渐增加,提取率提高;时间过长,细胞进一步破碎,杂质的溶出相应增多,川明参多糖的提取率随之降低,而且超声波具有较强的机械剪切作用,长时间作用会使大分子的多糖断裂,影响多糖的提取率[18]。因此超声波作用时间以45min为宜。
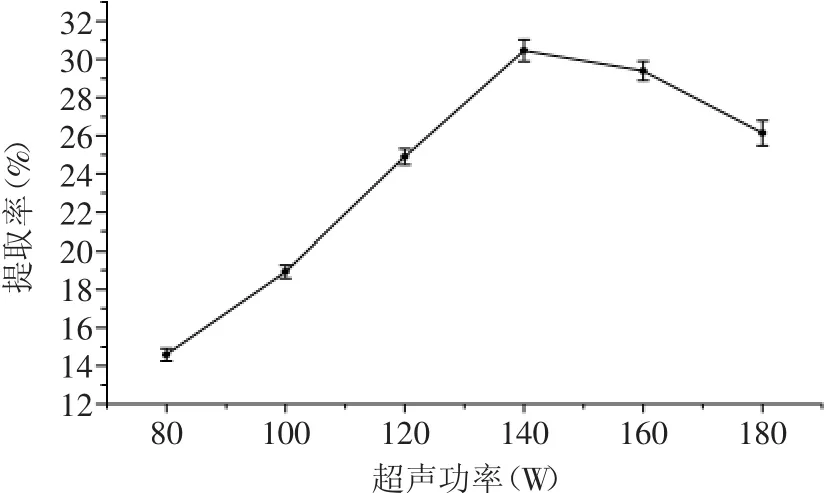
图3 超声功率对川明参多糖提取率的影响Fig.3 Effect of ultrasonic power on the extraction yield of polysaccharides from chuanminshen violaceum

图4 超声作用时间对川明参多糖提取率的影响Fig.4 Effect of ultrasonic power on the extraction yield of polysaccharides from chuanminshen violaceum
2.2.5 超声次数对川明参多糖提取率的影响 实验结果如图5所示,超声提取两次已达到基本提取完全,所以从经济合理性考虑,选取超声提取2次为最佳提取次数。
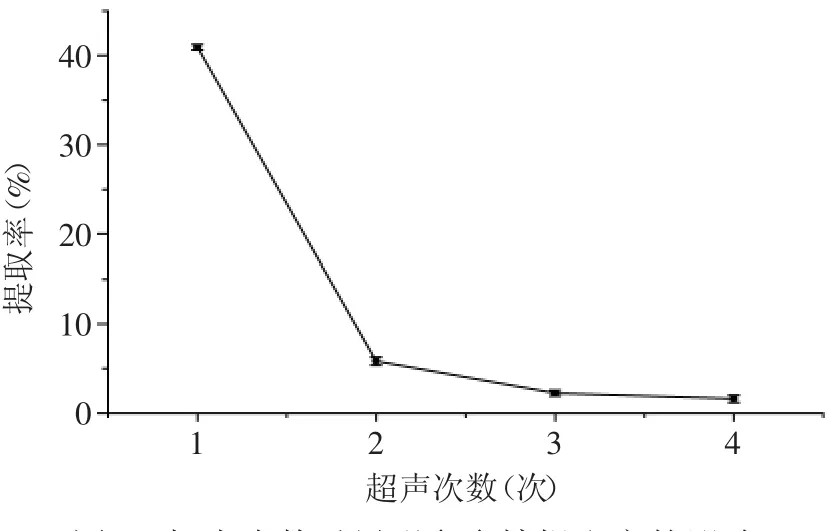
图5 超声次数对川明参多糖提取率的影响Fig.5 Effect of ultrasonic action times on the extraction yield of polysaccharides from chuanminshen violaceum
2.3 正交实验
在单因素实验的基础上,选取超声温度(A),超声功率(B),料液比(C),超声时间(D)4个因素作为考察指标。采用L9(34)正交实验设计,提取次数固定为2次,进行优化川明参多糖的提取工艺条件,正交实验结果见表2,方差分析结果见表3。
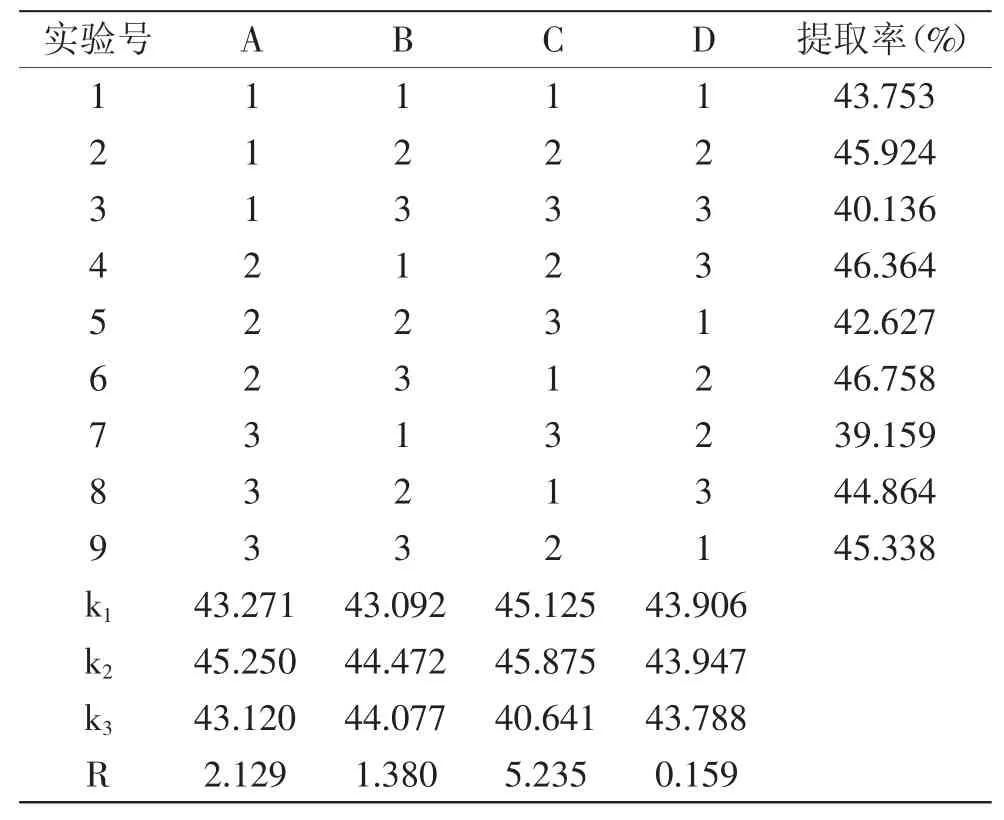
表2 正交实验设计与结果分析Table 2 Trials and results of orthogonal experiment
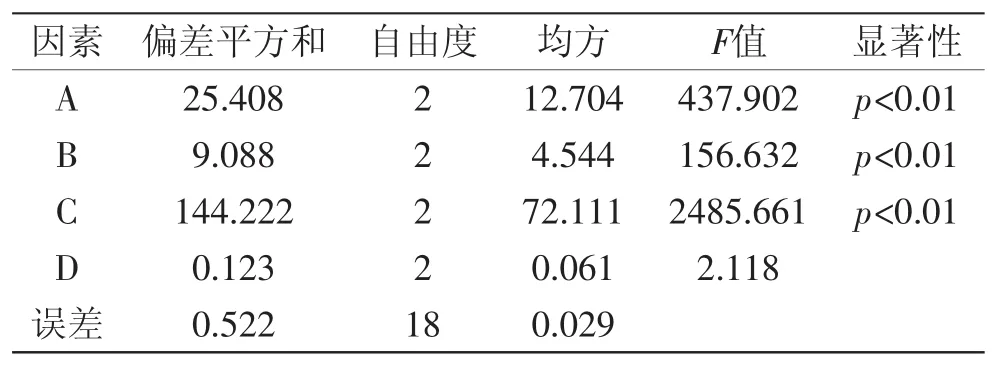
表3 方差分析表Table 3 Analysis results of variance
由表2中R值可知,影响川明参多糖提取率的先后顺序是:料液比>超声提取温度>超声功率>超声作用时间。由表3方差分析结果可知,超声提取温度、超声功率、料液比对提取率的影响极为显著,超声作用时间对提取率的影响不显著。由k值大小可知,优化工艺组合为A2B2C2D2,此结果与单因素实验筛选出的最佳条件组合一致,而正交实验提取率最高组合为A2B3C1D2,又因超声功率和料液比对提取率的影响极为显著,故将两组合分别进行验证实验,实验结果见表4。
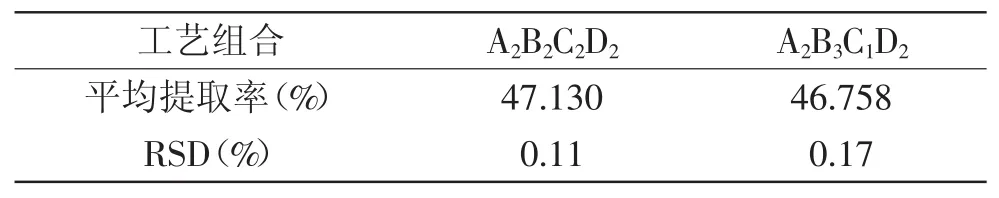
表4 验证实验结果(n=3)Table 4 Results of verification experiment(n=3)
由表4验证实验结果可知,川明参多糖超声提取的最佳工艺组合为A2B2C2D2,即超声温度70℃,超声功率140W,料液比1∶40,超声作用时间45min,提取2次,得到川明参多糖提取率为最高值47.13%,RSD为0.11%。
2.4 超声提取法与常规提取法的比较
准确称取一定量预处理后的川明参粉,固定提取温度70℃(常温浸渍法除外),料液比1∶40,提取次数2次,相对延长热浸提和常温浸渍法的提取时间,测定三种提取方法川明参多糖的提取率,实验条件及结果见表5。

表5 超声提取与常规提取法的比较Table 5 Comparison of three extraction methods
由表5可知,超声提取法较常规提取法有较大优势,不仅明显提高了多糖的提取率,而且大大缩短了提取时间,有利于工业化生产。
3 结论
本实验通过单因素实验和正交实验,采用超声法提取了川明参多糖。实验结果表明,影响超声提取川明参多糖提取率的四个因素中超声提取温度、超声功率、料液比对提取率的影响极为显著,超声作用时间对提取率的影响不显著,其先后顺序为:料液比>超声提取温度>超声功率>超声作用时间。综合考虑各因素得到的优化工艺参数为:超声温度70℃,超声功率140W,料液比1∶40,超声作用时间45min,提取2次。在该条件下川明参多糖的提取率是47.13%。与常规水提法相比,超声法安全、简单易行、效率高,是一种提取川明参多糖的有效途径。
[1]佘盂兰,单人骅.伞形科两新属——环根芹属和川明参属[J].植物分类学报,1980,18(1):45-49.
[2]万德光,彭成,赵军宁.四川道地中药材志[M].成都:四川科学技术出版社,2005:53.
[3]李帮经,周燕,王明安,等.滋补药材川明参的化学成分分析[J].分析实验室,2003,22(11):59-60.
[4]李宏,邵承斌.川明参多糖的遗传毒理学检验——对蚕豆根尖细胞微核的影响[J].渝州大学学报:自然科学版,1996,13(4):29-32.
[5]陈丹丹,彭成.川明参的药理作用及开发前景[J].中药与临床,2011,2(2):35-37.
[6]陈丹丹,彭成.川产道地药材川明参抗疲劳和抗氧化作用研究[J].现代中药研究与实践,2011,25(1):28-30.
[7]Song X,Yin ZQ,Li Li,et al.Antiviral activity of sulfated Chuanminshen violaceum polysaccharide against duck enteritis virus in vitro[J].Antiviral Research,2013,98:344-351.
[8]张梅,雨田,苏筱琳,等.川明参多糖理化性质和免疫活性研究[J].华西药学杂志,2007,22(4):396-398.
[9]雷晓莉,张梅.不同加工方法对川明参多糖及欧前胡素含量的影响[J].中药与临床,2012,3(2):34-38.
[10]吕明生,王淑军,房耀维,等.超声波提取雪莲薯多糖工艺优化及其对羟自由基的清除[J].食品科学,2011,32(2):24-27.
[11]杜清,秦民坚,郭巧生.明党参多糖提取工艺研究[J].现代中药研究与实践,2005,19(4):51-53.
[12]雷晓莉,宋芳芳,彭成,等.不同产地川明参药材中多糖含量测定[J].中药与临床,2011,2(1):49-54.
[13]钟振声,孙立杰,冯焱,等.超声波法提取人参多糖的研究[J].化学与生物工程,2006,26(6):30-32.
[14]张梅,雨田,苏筱琳,等.川明参多糖的提取工艺[J].华西药学杂志,2007,22(3):361-362.
[15]杜荣骞.生物统计学[M].北京:高等教育出版社,2003:119-139.
[16]范三红,原超,刘艳荣,等.超声波辅助提取南瓜籽油及其脂肪酸组成研究[J].食品科学,2010,31(24):107-110.
[17]孟宪军,李冬男,汪艳群,等.五味子多糖超声波提取条件的研究[J].食品工业科技,2010,31(4):313-315.
[18]李桂娟,李冲,姜雪,等.松籽壳多糖超声辅助溶剂法提取及抗氧化性研究[J].食品与机械,2012,28(6):133-137.
Optimizing ultrasonic extraction of plysaccharides from Chuanminshen violaceum based on orthogonal experiments design
DONG Hong-min1,LI Su-qing1,NIU Xiao-yong2,SHEN Li-wen1,LI Lu1,QIN Wen1,*
(1.College of Food Science,Sichuan Agricultural University,Ya’an 625014,China;2.Langzhong Supply and Marketing Cooperative,Langzhong 637400,China)
In order to obtain optimization of ultrasonic extraction of polysaccharides from Chuanminshen violaceum,the effect of the solid-liquid ratio,extraction temperature,ultrasonic power,ultrasonic action time and the extraction times of the polysaccharides by single factor experiments and orthogonal experiments in distilled water were investigated.The content of polysaccharides was determined by phenol-vitriol colorimetry method. The decreasing order of importance of the four process conditions affecting polysaccharide extraction was solid-liquid ratio,extraction temperature,ultrasonic power and ultrasonic action time.The orthogonal experimental results showed that the optimal conditions were extraction temperature 70℃,ultrasonic power 140W,solidliquid ratio 1∶40,ultrasonic action time 45min,2 times.Under this condition,the average rate of extraction of polysaccharides was 47.13%.
Chuanminshen violaceum,ultrasonic extraction,polysaccharides,orthogonal experiments design
TS201.1
B
1002-0306(2014)08-0306-05
10.13386/j.issn1002-0306.2014.08.061
2013-08-28 *通讯联系人
董红敏(1989-),女,硕士研究生,研究方向:农产品产后处理与品质控制。

