人肺癌组织中MCPH1基因过表达后协同化疗药物抑制肺癌A549细胞的增殖
何文婷,孟莎莎,吴晓彬
(重庆医科大学附属儿童医院重庆市儿童重大疾病诊治与预防国际科技合作基地儿童疾病研究教育部重点实验室认知发育与学习记忆障碍转化医学重庆市重点实验室,重庆400016)
肺癌(lung cancer,LC),是肺部最常见的恶性肿瘤之一。在许多国家的恶性肿瘤当中,肺癌的发病率占第一位[1]。传统的放疗和化疗的手段并不能特异地杀伤癌细胞,同时也杀伤了组织中的大量正常细胞,给患者带来非常严重的不良反应。为了减轻传统治疗给患者带来的痛苦和提高治疗效果,靶向治疗成为目前癌症治疗研究的热点。
MCPH1 为原发性小头脑基因,它编码microcephalin 蛋白,也被称作做BRIT1,最初是在筛选人端粒酶反转录酶阻遏物时被发现[2-4]。MCPH1(BRIT1)在DNA 损伤应答通路中发挥着重要作用[5]。近期研究发现多种人类肿瘤中MCPH1 表达下调,如卵巢癌、乳腺癌等。本实验前期研究也发现宫颈癌样本中MCPH1 基因表达下调[6]。
本研究拟在前期研究的基础上,进一步研究MCPH1 基因在肺癌中的表达及作用,为临床癌症基因诊断、治疗寻找新的靶点和标志物。
1 材料与方法
1.1 主要试剂
RT-PCR 试剂盒(Toyobo 公司);转染试剂Lipofectamine 2000 和Trizol 试剂(Invitrogen 公司);质粒提取试剂盒(Omega 公司);RNA 抽提液(Roche 公司);蛋白提取试剂盒、ECL 发光试剂盒、MTS 试剂盒(上海碧云天生物技术有限公司);兔抗人BRIT1多克隆抗体(Abcam 公司);HRP 标记的羊抗兔IgG(北京鼎国生物技术公司);阿霉素、顺铂、紫杉醇(Sigma 公司)。
1.2 质粒和细胞
真核表达质粒pcDNA3.1(-)/ MCPH1(重庆医科大学分子医学与肿瘤研究中心袁成福博士提供);pcDNA3.1(-)和A549 细胞(均为重庆医科大学分子医学与肿瘤研究中心保存)。
1.3 肺癌标本
本实验用肺癌标本,均取自重庆医科大学第一附属医院手术室,分为癌组织和癌旁组织两组,共20 例,各标本均已由细胞学及病理学实验证实。本研究项目已被重庆医科大学伦理委员会批准。
1.4 引物合成及序列
MCPH1 及GAPDH 上下游引物均由TAKARA生物公司设计合成。MCPH1 基因正义链:5'-CACC ATCTTTCACTCACCTC-3',反义链:5'-CTTTACTG AGGAACTCCTGG-3',扩增片段大小240 bp;内参GAPDH基因(NM_002046)正义链:5'-ACCTGACCTG CCGTCTAGAA-3',反义链:5'-TCCACCACCCTGTTG CTGTA-3',扩增片段大小227 bp。
1.5 细胞培养及转染
用含10%胎牛血清的DMEM 培养液,于37 ℃,5% CO2孵箱培养A549 细胞,以1 ×105个/孔接种于6 孔板中,当细胞汇合率达80% ~90%时,用LipofectamineTM2000 脂质体分别转染质粒pcDNA3.1(-)/MCPH1 和空载体pcDNA3.1(-)(阴性对照组),质粒与脂质体质量比为1∶2。
1.6 Real-time PCR 检测细胞中MCPH1 基因转录
转染后48 h,用Trizol 试剂提取各组细胞总RNA,紫外分光光度计定量。以随机引物在M-MLV反转录酶的作用下反转录合成cDNA,反应条件为:30 ℃10 min,42 ℃20 min,99 ℃5 min。以合成的cDNA 为模板进行PCR 扩增。反应条件为:95 ℃预变性5 min;95 ℃15 s,60 ℃15 s,72 ℃20 s,共30个循环;72 ℃7 min。扩增产物经2%琼脂糖凝胶电泳鉴定,Quantity One 软件进行光密度分析。试验重复3 次。采用real time PCR 法。反转录合成的cDNA进行real time PCR 反应。反应条件:94 ℃变性5 min;94 ℃10 s;60 ℃30 s,共40 个循环。实验重复3 次。采用2-△△Ct法对结果进行分析。
1.7 Westen blot 检测细胞中MCPH1 蛋白表达
转染后48 h,收集各组细胞,提取蛋白,BCA 法定量。取20 μg 蛋白样品,经SDS-PAGE 分离后,电转移至PVDF 膜上,5%脱脂奶粉室温振荡封闭1 h;加入兔抗人BRIT1 多抗(1∶500 稀释),4 ℃孵育过夜;PBST 洗膜3 次,加入HRP 标记的羊抗兔IgG(1∶5 000稀释),室温孵育1 h;PBST 缓冲液洗膜3次,用ECL 化学发光法检测BRIT1 蛋白的表达。以β-actin 作为内参照。实验重复3 次。
1.8 MTS 比色法检测细胞抑瘤率
取对数增长期的A549 细胞消化、计数,细胞浓度为1 ×108/L,将单细胞悬液100 μL 加入96孔培养板中,24 h 后转染,转染24 h 后每孔分别加入阿霉素1.0 μmol/mL、紫杉醇20 μg/mL、顺铂0.1 μg/mL,各组分别设置3 个复孔及3 个对照孔,培养48 h 后,加入10 μL MTS 试剂,孵育4 h后,用酶标仪(γ490 nm)测定每孔吸光度(A)值。
1.9 统计学分析
药物对细胞增长期的抑制率按下式计算:抑制率(%)=(1-加药孔平均A 值/对照孔平均A 值)×100%。应用SPSS11.5 统计学软件进行统计分析,实验数据以均值上标准差(±s)表示,多组间参数比较采用单因素方差分析。
2 结果
2.1 MCPH1 基因在人肺癌组织中表达下调
在25 例肺癌标本中,MCPH1 基因的表达,21例低于正常组,2 例高于正常组(图1)。
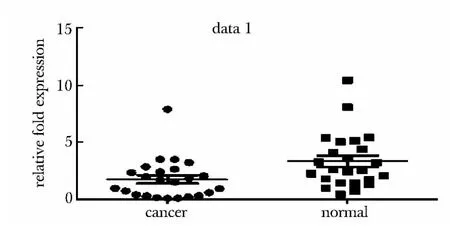
图1 Real-time PCR 数据散点图Fig 1 The data scatter plot of real-time PCR
2.2 转染A549 细胞后,过表达MCPH1 的鉴定
2.2.1 mRNA 水平鉴定MCPH1 基因过表达:实验组MCPH1 mRNA 表达值明显低于空白对照组和未处理组(P<0.05)。说明转染成功,实验组MCPH1基因过表达(表1)。
2.2.2 MCPH1 基因过表达蛋白水平鉴定:Western blot 检测结果显示,实验组2.18 ±0.13,显著高于对照组为0.47 ±0.12(目的条带/ β-actin)(P<0.05)(图2)。
表1 实时荧光定量PCR 检测各组细胞中MCPH1基因mRNA 的表达水平Table 1 Expression of MCPH1 gene in cells detected by Q-PCR (±s,n=3)
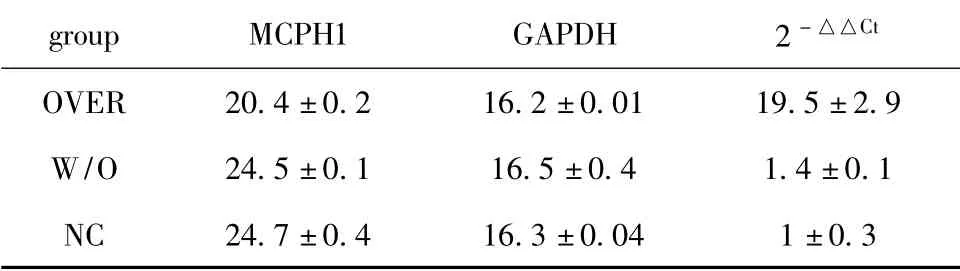
表1 实时荧光定量PCR 检测各组细胞中MCPH1基因mRNA 的表达水平Table 1 Expression of MCPH1 gene in cells detected by Q-PCR (±s,n=3)
groupMCPH1GAPDH2 -△△Ct OVER20.4 ±0.216.2 ±0.0119.5 ±2.9 W/O24.5 ±0.116.5 ±0.41.4 ±0.1 NC24.7 ±0.416.3 ±0.041 ±0.3

图2 Western blot 检测MCPH1 蛋白表达Fig 2 Protein expression of MCPH1 measured by Western blot
2.3 过表达MCPH1 协同化疗药物的细胞抑瘤率
MCPH1 过表达后,协同化疗药物阿霉素(ADM)、顺铂(DDP)、紫杉醇(TAX)的抑瘤率均超出空白对照组及未处理组20%左右(P<0.05),说明过表达MCPH1 协同化疗药物对于肺癌A549 细胞抑瘤率明显升高(图3)。
3 讨论
在DNA 损伤的情况下,MCPH1 可以通过协调DNA 损伤应答通路中的ATR 和ATM 通路来应对多种损伤修复和监视细胞周期,从而维持基因组的稳定性。一旦MCPH1 突变失活,会导致S 期和G2/M期的细胞周期检查点丢失,这样会造成损伤的DNA进入子代细胞,从而引起子代细胞染色质的不稳定,这种不稳定增加了其他肿瘤相关基因突变的可能性,最终导致肿瘤的发生。敲出MCPH1 的小鼠基因组表现出了不稳定性。在多种人类肿瘤中都发现了MCPH1 的表达下调[7]。在人类肿瘤中BRIT 的异常表达表明MCPH1 可能是一个新的肿瘤抑制基因。
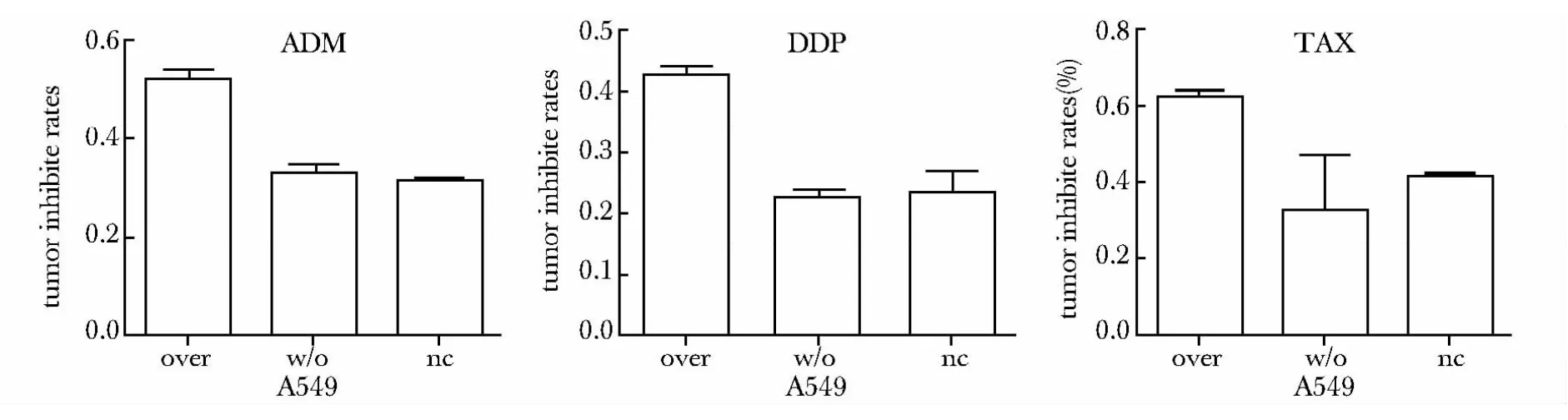
图3 化疗后细胞抑瘤率(%)对比Fig 3 Histogram tumor inhibition rate (%)of three chemotherapeutics
本研究发现肺癌组织MCPH1 基因在肺癌组织中表达下调,这就意味着MCPH1 基因可能参与肺癌发生发展的过程,且可能作为一种抑癌基因发挥作用。近年来,专家推测,该基因可能在肿瘤的发生发展中起到重要作用,但目前仍无其抗肿瘤作用的相关研究。本研究首次将该基因与抗肿瘤药物联系起来,为其将来作为一种新的抗肿瘤靶点药物打下基础。
阿霉素是为肺癌化疗的一线药物,它可以嵌入DNA 的碱基对之间干扰转录过程,阻止mRNA 的合成,最终通过促进细胞凋亡而起到抗肿瘤作用。在肺癌治疗中,单药阿霉素有效率较低,心脏毒性是主要剂量限制性因素之一;紫杉醇在临床上能引起广泛的过敏反应;顺铂对骨髓有严重的抑制作用。因此,需要寻找一种增加化疗药物敏感性,促使肺癌细胞易于发生凋亡,从而减小化疗药物用量及不良反应的新策略。本实验组前期试验过程中,已发现过表达MCPH1 基因后,可以促进肿瘤细胞的凋亡[8]。本研究将临床上常用的化疗药物与基因MCPH1 协调作用进行研究,结果发现两者之间有显著协同作用,可能因为该基因对于肿瘤细胞促凋亡作用的原因,具体机制还需要进一步研究。
综上所述,MCPH1 基因很可能作为一种抑癌基因在肿瘤的发生发展过程中产生作用,并作为一种新的抗肿瘤靶点,协同其他化疗药物,应用于临床治疗当中。
[1]Maguire AM,Simonelli F,Pierce EA,et al.Safety and efficacy of gene transfer for Leber's congenital amaurosis[J].N Engl J Med,2008,358:2240-2248.
[2]Fischer A,Cavazzana-Calvo M.Gene therapy of inherited diseases[J].Lancet,2008,371:2044-2047.
[3]Young LS,Searle PF,Onion D,et al.Viral gene therapy strategies:from basic science to clinical application[J].J Pathol,2006,208:299-318.
[4]Bachtarzi H,Stevenson M,Fisher K.Cancer gene therapy with targeted adenoviruses[J].Expert Opin Drug Deliv,2008,5:1231-1240.
[5]Douglas JT.Adenoviral vectors for gene therapy[J].Mol Biotechnol,2007,36:71-80.
[6]Chesnoy S,Huang L.Structure and function of lipid-DNA complexes for gene delivery[J].Annu Rev Biophys Biomol Struct,2000,29:27-47.
[7]Brower V.Approval of provenge seen as first step for cancer treatment vaccines[J].J Natl Cancer Inst,2010,102:1108-1110.
[8]胡仁智,宋方洲,袁成福,等.BRIT1 基因过表达对人宫颈癌HeLa 细胞凋亡的影响[J].中国生物制品学杂志,2012,25:439-432.

