Fe-TS-1催化1-己烯环氧化合成1,2-环氧己烷
李 颢,王 勇,张 宇,郑延成
(长江大学化学与环境工程学院,湖北 荆州 434023)
1,2-环氧己烷是一类用途十分广泛的有机原料和中间体。目前传统的烯烃环氧化方法主要有过酸法、卤醇法和间接氧化法,但均存在生产成本高、设备腐蚀、环境污染严重等问题[1]。钛硅分子筛在以稀过氧化氢为氧化剂的一系列有机物氧化反应中,表现出良好的催化活性和选择性,并且几乎无环境污染,引起了国内外研究者的广泛关注[2]。钛硅分子筛的结构、合成方法、反应温度、底物的扩散和溶剂对选择氧化反应有重要的影响[2]。其中,溶剂是影响催化剂活性和选择性的重要因素之一[3-5]。对于氯丙稀、丙烯和1-己烯等烯烃的环氧化反应,甲醇是TS-1的优选溶剂,这是因为TS-1有疏水特性[5-7]。对于1-己烯、苯乙烯和环己醇的选择氧化反应,乙腈可以明显地改善Ti-Beta的催化活性和选择性,归因于Ti-Beta的亲水性质[3,8]。这种差异被广泛认为是由不同的活性中间体所致:在质子溶剂中,物种1被认为是活性中间体,它是由ROH与Ti(Ⅳ)配位并与Ti-O-O-H通过氢键形成的一个稳定的五元环中间体;在非质子溶剂中,物种2被认为是活性中间体,它是由水与Ti(Ⅳ)配位并与Ti-O-O-H通过氢键形成的一个稳定的五元环中间体,结构式见图1。
近年来,人们在TS-1分子筛的合成过程中引入其他三价离子(Al3+,Ga3+,Fe3+或B3+等),得到了同时具有催化氧化(Ti4+)和酸催化(M3+)活性的双功能钛硅分子筛催化剂[9-14]。在采用甲醇为溶剂的乙烯[11]和1-丁烯[12]液相环氧化反应中,Fe-TS-1均表现出较高的催化活性,不过其催化选择性较差。这是由于Fe3+的引入,增加了TS-1的酸强度和酸量,促进了环氧化物的开环水解和溶解。此外,Fe3+的引入,使得TS-1分子筛的表面硅羟基数量增加,影响了分子筛的疏水性[14]。但是,目前有关Fe-TS-1催化1-己烯环氧化反应的研究还鲜有报道。

图1 活性钛物种的结构示意[3,5]
笔者采用四丙基溴化铵(TPABr)为模板剂,硅溶胶为硅源,正丁胺(NBA)为碱源,成功地制备出Fe-TS-1,其在乙烯选择氧化制乙二醇的反应中表现出较好的催化性能[11];并研究了Fe-TS-1催化1-己烯环氧化反应的溶剂效应,以及反应条件对Fe-TS-1催化性能的影响。
1 实 验
1.1 主要试剂
硅溶胶,30%,青岛恒盛达化工有限公司;钛酸正丁酯(TBOT)、正丁胺,分析纯,成都市科龙化工试剂厂;TPABr,99.0%,金坛市西南化工研究所;九水合硝酸铁(98.5%)、30%过氧化氢(分析纯),广东光华化学厂有限公司;1-己烯(97%)、环己酮(99.5%)、1,2-环氧己烷(96%)、1,2-己二醇(98%),阿拉丁试剂(上海)有限公司。
1.2 Fe-TS-1的制备
参照文献[11]制备Fe-TS-1分子筛。首先,将12.8 g TPABr和92.7 g硅溶胶溶解于142 g去离子水中,得到溶液1;另外配制TBOT(4.61 g)的过氧化氢(30%,6.4 g)络合水溶液,加入20.7 g NBA,得到溶液2。在剧烈搅拌下,将溶液2加入到溶液1中,然后滴加一定浓度的硝酸铁水溶液,所得溶液的物料比为SiO2∶xFe2O3∶0.03TiO2∶0.6NBA∶0.1TPABr∶30H2O,其中1/x=160~1 000。最后,加入1.2 g TS-1晶种,加热至333 K蒸醇,转移入高压釜(聚四氟乙烯为衬里),在448 K晶化3 d。将得到的晶化产物过滤,水洗至pH=7,在373 K过夜干燥,最后在马弗炉中在823 K焙烧5 h,即得Fe-TS-1分子筛。作为对照,按照上述合成步骤不添加硝酸铁制备TS-1分子筛。
1.3 Fe-TS-1的表征
X射线粉末衍射测试在荷兰帕纳科公司X’ pert pro MPD型X射线衍射仪上进行,CuKα辐射。紫外可见漫反射光谱(UV-Vis)光谱分析在TU-1091型光谱仪上进行,BaSO4作为参比物,测试范围190~800 nm。氨程序升温脱附(NH3-TPD)在一个连有气相色谱仪(GC 2000II型)的固定床上进行。将100 mg试样在高纯氩气流(25 mL/min)中于673 K活化1 h,降至373 K,然后在此温度下吸附纯氨(20 mL/min)1.5 h,再用高纯氩气流(25 mL/min)在此温度下吹扫1 h。最后,试样在高纯氩气流(25 mL/min)中以10 K/min的速率从373 K程序升温到873 K。
1.4 1-己烯环氧化反应
1-己烯环氧化反应在一个连接有冷凝管的100 mL三口烧瓶中进行,磁力搅拌,恒温油浴加热。典型的投料配比为:催化剂 0.4 g,乙腈30 mL(溶剂),1-己烯 32 mmol,过氧化氢(30%)29 mmol,温度 343 K,反应时间 5 h。反应液中过氧化氢的含量采用碘量法分析,产物组成采用GC 7890F型气相色谱仪(SE-54毛细管柱,15 m × 0.25 mm)分析,环己酮为内标。转化率和过氧化氢选择性的计算如下:



2 结果与讨论
2.1 Fe-TS-1的表征结果
XRD测试表明了TS-1和Fe-TS-1具有典型的MFI拓扑结构特征衍射峰,为分子筛纯相,说明掺杂Fe3+没有破坏TS-1的结构[11]。UV-Vis光谱分析表明,TS-1和Fe-TS-1分子筛骨架上的钛大部分处于四配位状态,少量的钛处于六配位状态。此外,TS-1和Fe-TS-1分子筛中可能含有少量的非骨架锐钛矿型TiO2[11]。这是由于在晶化过程中Fe3+与Ti4+竞争,导致一部分Ti4+没有进入分子筛的骨架,而以非骨架的形态存在[9]。
图1是TS-1和Fe-TS-1分子筛(n(SiO2)∶n(Fe2O3) = 860)的NH3-TPD谱。由图1可以看出:TS-1在444.1 K附近有一个明显的NH3脱附峰,对应的氨气吸附能力为0.13 mmol/g。这表明采用TPABr-NBA体系合成的TS-1具有弱酸性,主要归因于原料硅溶胶中所携带的微量杂质铝[15]。掺杂Fe3+后,444.1 K附近的氨气脱附峰的强度明显增大,并且在677.4 K左右出现一个较强的氨气脱附峰,对应的氨气吸附能力为0.18 mmol/g。以上结果表明,Fe3+的引入增加了TS-1的酸强度和酸量,使得TS-1分子筛的亲水性增加。
2.2 Fe-TS-1的催化性能
2.2.1Fe含量的影响
在TS-1为催化剂时,过氧化氢转化率为43.8%,过氧化氢选择性为60.1%,1-己烯转化率为26.5%,1,2-环氧己烷选择性为90.4%,1,2-己二醇选择性为9.6%。
在温度343 K、时间5 h、催化剂0.4 g、1-己烯32 mmol、30%过氧化氢29 mmol、乙腈30 mL的条件下,不同Fe含量的Fe-TS-1催化1-己烯环氧化的反应结果见图2。由图2可见:掺杂Fe3+(n(SiO2)∶n(Fe2O3)=1 000)后,过氧化氢的转化率、过氧化氢的选择性、1-己烯的转化率和1,2-环氧己烷的选择性略微增加。随着n(SiO2)∶n(Fe2O3)从1 000减小到860,过氧化氢的转化率、过氧化氢的选择性和1-己烯的转化率明显增加,而1,2-环氧己烷和1,2-己二醇的选择性变化不大。进一步减小n(SiO2)∶n(Fe2O3),过氧化氢的转化率、过氧化氢的选择性和1-己烯的转化率降低,而1,2-环氧己烷和1,2-己二醇的选择性变化不大。这说明过量Fe3+的引入使得TS-1亲水性增强,不利于催化剂吸附有机反应底物,进而导致催化剂的活性降低;此外,过量Fe3+的引入可导致过氧化氢无效分解程度的增强,使得过氧化氢的选择性降低[16]。因此,采用n(SiO2)∶n(Fe2O3)=860为合适的Fe-TS-1催化剂。
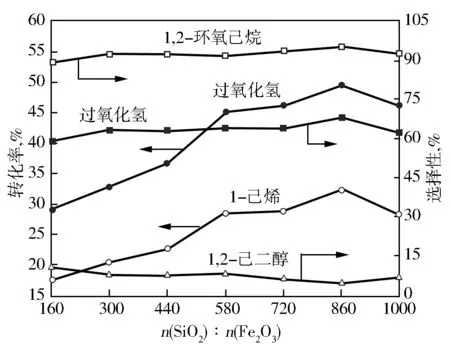
图2 不同Fe含量的Fe-TS-1催化1-己烯环氧化的反应结果
2.2.2溶剂效应
Fe-TS-1在不同溶剂中催化1-己烯环氧化的反应结果见表1。Fe-TS-1在质子性溶剂甲醇和乙醇中表现出较高的催化活性,不过其催化选择性较低,归因于催化剂上的酸性位可导致环氧化物的开环水解和醇解[10,11,13]。相反,Fe-TS-1在叔丁醇中表现出较低的催化活性和较高的催化选择性,是由于叔丁醇具有较低的亲电性和较大的空间位阻[5]。与质子性溶剂相比,Fe-TS-1在非质子性溶剂中表现出较高的催化活性和选择性。此外,尽管在乙腈和丙酮中的过氧化氢转化率比在丁酮中的略低,但是随着反应溶剂极性的增加,Fe-TS-1在非质子性溶剂中的催化活性和选择性增加。这种现象与Ti-Beta在1-己烯环氧化反应中的结果一致[5],因此,较合适的溶剂为乙腈。

表1 溶剂的质子/非质子性质和极性对Fe-TS-1催化性能的影响 %
注:1)1,2-环氧己烷、1,2-己二醇和其他产物的选择性采用色谱选择性。
2.2.3反应条件的选择
固定其他反应条件,考察反应温度对Fe-TS-1催化1-己烯环氧化反应的影响,结果见图3。由图3可以看出:随着反应温度从313 K升高到343 K,过氧化氢的转化率、1-己烯的转化率和1,2-己二醇的选择性增加,而过氧化氢和1,2-环氧己烷的选择性降低。进一步升高反应温度,过氧化氢的转化率增加,1-己烯的转化率突然降低,过氧化氢和1,2-环氧己烷的选择性降低,1,2-己二醇的选择性略微增加。因此,合适的反应温度为343 K。

图3 反应温度对1-己烯环氧化反应的影响
固定其他反应条件,考察过氧化氢用量对Fe-TS-1催化1-己烯环氧化反应的影响,结果见图4。由图4可以看出:随着过氧化氢浓度从0.2 mol/L增加到0.8 mol/L,过氧化氢的转化率和选择性降低,1-己烯的转化率明显增加,而1,2-环氧己烷和1,2-己二醇的选择性基本不变。进一步增加过氧化氢浓度,过氧化氢的转化率和选择性降低,1-己烯的转化率开始降低,而1,2-环氧己烷和1,2-己二醇的选择性变化不大。因此,合适的过氧化氢用量为0.8 mol/L。
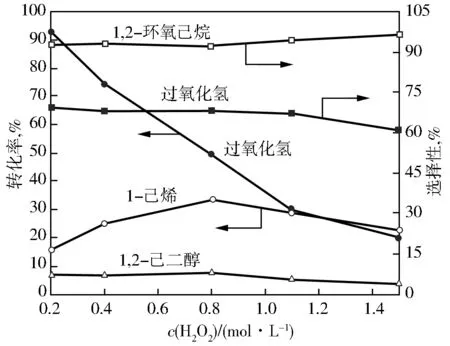
图4 过氧化氢用量对1-己烯环氧化反应的影响
固定其他反应条件,考察催化剂用量对Fe-TS-1催化1-己烯环氧化反应的影响,结果见图5。由图5可以看出:随着催化剂用量从2.7 g/L增加到10.7 g/L,过氧化氢的转化率、1-己烯的转化率和1,2-己二醇的选择性增加,而过氧化氢和1,2-环氧己烷的选择性降低。进一步增加催化剂用量,过氧化氢的转化率和1,2-己二醇的选择性增加,而1-己烯的转化率、过氧化氢的选择性和1,2-环氧己烷的选择性降低。这是由于催化剂用量的增加,使得催化剂的总酸量增加,造成1,2-环氧己烷开环水解程度的提高。因此,合适的催化剂用量为10.7 g/L。
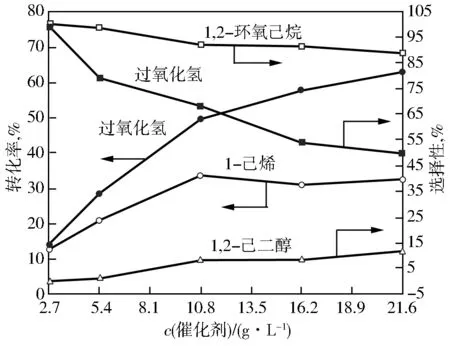
图5 催化剂用量对1-己烯环氧化反应的影响
固定其他反应条件,考察反应时间对Fe-TS-1催化1-己烯环氧化反应的影响,结果见图6。由图6可以看出:随着反应时间从1 h延长到5 h,过氧化氢和1-己烯的转化率线性增加,而过氧化氢的选择性线性降低。进一步延长反应时间,过氧化氢的转化率保持不变,1-己烯的转化率和过氧化氢的选择性略微降低。整个过程中1,2-环氧己烷和1,2-己二醇的选择性基本不变。这说明1,2-环氧己烷生成量是逐渐增加的[17],但是反应时间越长,过氧化氢无效分解的程度越大。因此,最佳的反应时间为5 h。
通过实验得出较优化的反应条件为:反应温度 343 K,过氧化氢用量 0.8 mol/L,催化剂用量 10.7 g/L,反应时间 5 h。

图6 反应时间对1-己烯环氧化反应的影响
2.3 反应机理
由于TS-1的疏水特性,在过氧化氢为氧化剂的1-己烯液相环氧化反应中,最佳的溶剂为甲醇,环氧化反应通过活性物种1进行[5]。与TS-1相反,乙腈是具有亲水性Ti-Beta的优选溶剂,环氧化反应通过活性物种2进行[3]。在采用甲醇为溶剂的1-己烯环氧化反应中,Fe-TS-1表现出较低的催化活性和选择性;而采用乙腈为溶剂时,Fe-TS-1表现出较高的催化活性和选择性(见表1)。这说明,掺杂Fe3+后,TS-1的疏水性发生了改变(见图1),乙腈溶剂的采用改变了反应的历程,使得环氧化反应通过活性物种2进行。由于H2O的供电子能力比醇差,物种2具有较高的亲电性,使得物种2的本征氧化活性比物种1高[3,5]。因此,Fe-TS-1在非质子溶剂中的催化活性比在质子溶剂中高。Fe-TS-1的酸性位(Fe3+),以及少量的非骨架锐钛矿型TiO2,它们可以在环氧化反应中导致过氧化氢的分解,使得过氧化氢选择性相对不高[16]。不过,具有弱碱性的乙腈可以屏蔽来自于Fe3+的Brönsted酸性位,使得1,2-环氧己烷具有较高的选择性[3,5]。基于以上的讨论,笔者提出了一个Fe-TS-1催化1-己烯环氧化生成1,2-环氧己烷的反应模型,见图7。
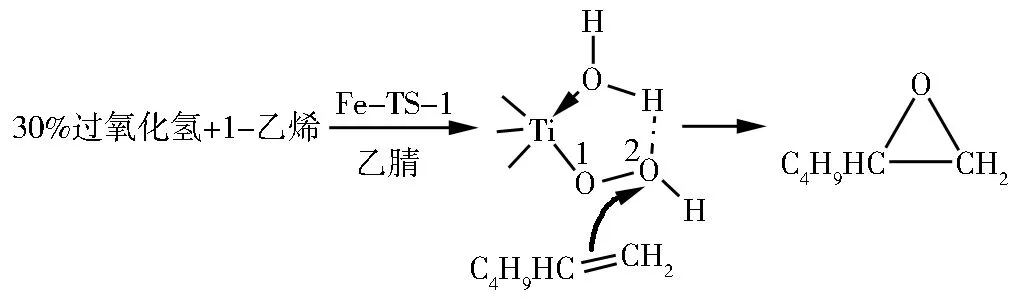
图7 Fe-TS-1催化1-己烯环氧化生成1,2-环氧己烷的反应模型
3 结 论
采用过氧化氢为氧化剂,研究了Fe-TS-1催化1-己烯环氧化生成1,2-环氧己烷的反应。结果表明:溶剂的质子/非质子性和极性对催化剂的催化活性和选择性有重要的影响。采用甲醇为溶剂时,Fe-TS-1表现出较低的催化活性和选择性;而采用乙腈为溶剂时,Fe-TS-1表现出较高的催化活性和选择性。说明掺杂Fe3+后,TS-1的疏水性发生了改变,乙腈溶剂的采用改变了反应的历程,使得环氧化反应通过活性物种2进行。在优化的条件下,过氧化氢的转化率为49.6%,过氧化氢的选择性为68.1%,1-己烯的转化率为33.4%,1,2-环氧己烷的选择性为92.0%,1,2-己二醇的选择性为8.0%。最后,提出了一个Fe-TS-1催化1-己烯环氧化生成1,2-环氧己烷的反应模型。
参 考 文 献
[1] 常丽娟,田恒水.1-己烯绿色合成1,2-环氧己烷 [J].广东化工,2011,38(3):62-63.
[2] Ratnasamy P, Srinivas D, Knözinger H. Active sites and reactive intermediates in titanium silicate molecular sieves [J].Adv Catal,2004,48: 1-169.
[3] Corma A, Esteve P, Martínez A. Solvent effects during the oxidation of olefins and alcohols with hydrogen peroxide on Ti-beta catalyst: The influence of the hydrophilicity-hydrophobicity of the zeolite [J].J Catal,1996,161(1): 11-19.
[4] Ramachandran C E, Du H, Kim Y J, et al.Solvent effects in the epoxidation reaction of 1-hexene with titanium silicalite-1 catalyst [J].J Catal,2008,253(1): 148-158.
[5] Fan W, Wu P, Tatsumi T.Unique solvent effect of microporous crystalline titanosilicates in the oxidation of 1-hexene and cyclohexene [J].J Catal,2008,256(1): 62-73.
[6] Clerici M G, Bellussi G, Romano U. Synthesis of propylene oxide from propylene and hydrogen peroxide catalyzed by titanium silicalite [J].J Catal,1991,129(1): 159-167.
[7] Clerici M G,Ingallina P.Epoxidation of lower olefins with hydrogen peroxide and titanium silicalite [J].J Catal,1993,140(1): 71-83.
[8] Hulea V,Dumitriu E.Styrene oxidation with H2O2over Ti-containing molecular sieves with MFI,BEA and MCM-41 topologies [J].Appl Catal A: Gen,2004,277(1-2): 99-106.
[9] Trong On D, Nguyen S V, Hulea V, et al.Mono- and bifunctional MFI, BEA and MCM-41 titanium-molecular sieves. Part 1. Synthesis and characterization [J].Micropor Mesopor Mater,2003,57(2): 169-180.
[10] Li H, Lei Q, Zhang X, et al.One-pot synthesis of ethylene glycol and its mono-methyl ether from ethylene using Al-TS-1 catalyst [J].Catal Commun,2009,10(14): 1936-1939.
[11] Li H, Lei Q, Zhang X, et al.Synthesis, characterization, and catalytic performance of bifunctional titanium silicalite-1 [J].Chin J Catal,2013,34(7): 1363-1372.
[12] Bellusi G, Carati A, Clerici M G, et al.Double substitution in silicalite by direct synthesis: a new route to crystalline porous bifunctional catalysts [J].Stud Surf Sci Catal,1991,63: 421-429.
[13] Shen L, Deng X, Liu Y. Synthesis and catalytic oxidation performance of Al-TS-1 [J].Chin J Catal,2013,34(6): 1232-1241.
[14] Ovejero G, Van Grieken R, Uguina M A, et al.Study on the Ti and Al coincorporation into the MFI zeolitic structure [J].J Mater Chem,1998,8(10): 2269-2276.
[15] Guo X W, Wang X S, Liu M, et al.Epoxidation of propylene with dilute H2O2over titanium silicalite containing trace aluminum [J].Catal Lett,2002,81(1-2): 125-130.
[16] Thangaraj A, Kumar R, Sivasanker S. Evidence for the simultaneous incorporation of Al and Ti in MFI structure (Al-TS-1) [J].Zeolites,1992,12(2): 135-137.
[17] Shima H, Tatsumi T, Kondo J N. Direct FT-IR observation of oxidation of 1-hexene and cyclohexene with H2O2over TS-1 [J].Micropor Mesopor Mater,2010,135(1-3): 13-20.

