非酒精性脂肪性肝炎模型的建立及氧化应激在其发生中的作用
吴雪园,黄翠影,杨路亭
(河北医科大学第三医院消化内科,河北 石家庄 050051)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种无过量饮酒史,以肝实质细胞脂肪变性为特征的临床综合征。疾病谱从单纯脂肪肝经非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)可进一步发展为肝纤维化、肝硬化、肝细胞癌、肝衰竭[1]。肝脂肪变与糖尿病、高血压、心血管事件等的发生风险增加有关,尤其是NASH,可增加心血管病和恶性肿瘤患者的病死率;同时NASH相关肝硬化是原发性肝癌的独立危险因素[2],因此,NAFLD已成为世界性的公共卫生问题。近年来由于高热量饮食,体育锻炼减少等生活方式改变,我国NAFLD患病逐年增加,已成为仅次于病毒性肝炎的第二大慢性肝病[3]。但其发病机制并未完全阐明,治疗上也缺乏有效措施。目前尚无理想的能够完整表达人类NASH的动物模型,本实验旨在通过饲喂高脂饮食建立大鼠NASH模型,并探讨氧化应激在其发生中的作用。
1 材料与方法
1.1 实验动物:清洁级Wistar大鼠30只(雄性),体质量180~200g,购自河北省实验动物中心。实验条件为室温(22±1)℃,湿度为(55±10)%。
1.2 饲料:普通基础饲料购自河北省实验动物中心,高脂饲料由88%基础饲料+2%胆固醇+10%猪油组成。
1.3 试剂:血清丙二醛(malondialdehyde,MDA)、过氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)购自南京建成科技有限公司。
1.4 方法
1.4.1 动物模型建立:30只Wistar大鼠以普通基础饲料适应性喂养1周后,随机分成2组。正常组10只饲喂普通基础饲料,模型组20只饲喂高脂饲料,自由饮水,每周称体质量1次并记录。实验8周末从模型组随机挑选10只大鼠处死,12周末处死正常组10只及模型组剩余10只大鼠,留取血清及肝组织标本备用。
1.4.2 标本采集:大鼠取材前禁食12h,10%水合氯醛腹腔麻醉,采集心脏血5mL于抗凝管中,以3 000r/min,15min离心后获取血清分装标记,-20℃保存备用;摘取整个肝脏标本,生理盐水冲去多余血液,滤纸吸干表面水分后称湿质量;取肝左叶组织(5mm×5mm×3mm大小)浸泡于10%甲醛溶液中固定,石蜡包埋,切片,HE染色,光镜下观察肝脏组织形态。
1.4.3 观察指标及测定方法:实验期间每周记录大鼠体质量,实验结束时称大鼠肝湿质量,并计算肝指数(肝指数=肝湿质量/体质量)。SOD、MDA、GSH-PX测定严格按试剂盒规范操作。病理学观察参照美国国立卫生研究院NASH临床研究网病理工作组指南,统计NAFLD活动度积分(NAFLD activity score,NAS)。NAS 0~8分。①肝细胞脂肪变,0分为<5%,1分为5%~33%,2分为34%~66%,3分为>66%。②小叶内炎症(20倍镜计数坏死灶),0分为无,1分为<2个,2分为2~4个,3分为>4个。③肝细胞气球样变,0分为无,1分为少见,2分为多见。NAS<3分可排除NASH,NAS>4分则可诊断NASH,介于两者之间者为NASH可能。规定不伴有小叶内炎症、气球样变和纤维化但肝脂肪变>33%者为单纯性脂肪肝,脂肪变达不到此程度者仅称为肝细胞脂肪变[4]。

2 结 果
2.1 肝脏的一般情况:正常组的肝组织形态正常,表面光滑,边缘锐利,质地红润柔软。模型组8周末肝脏体积增大,包膜稍紧张,边缘圆钝;12周末肝脏体积明显增大,包膜紧张,部分肝脏呈奶黄色,切面油腻。
2.2 肝指数:与正常组相比,模型组体质量、肝湿质量和肝指数均显著增加和升高(P<0.05);与模型组8周比较,模型组12组体质量、肝湿质量和肝指数均明显增加和升高(P<0.05)。见表1。
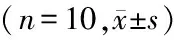
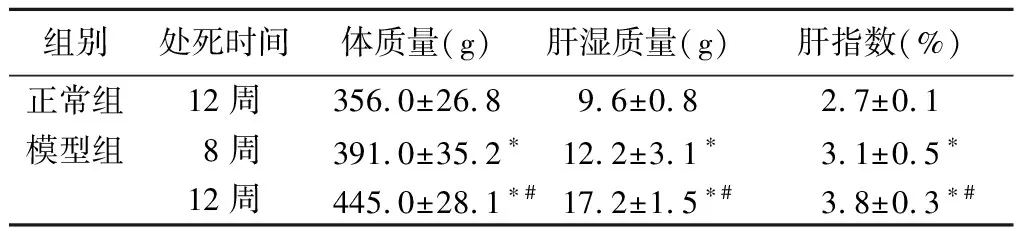
组别处死时间体质量(g)肝湿质量(g)肝指数(%)正常组12周356.0±26.89.6±0.82.7±0.1模型组8周391.0±35.2∗12.2±3.1∗3.1±0.5∗12周445.0±28.1∗#17.2±1.5∗#3.8±0.3∗#
*P<0.05与正常组比较 #P<0.05与模型组8周比较(q检验)
2.3 光镜下观察:正常组大鼠肝小叶结构正常,肝索排列规则,肝细胞大小均匀一致,胞核呈圆形,形态规则,NAS均为0(图1);模型组在8周末肝细胞肿胀,有少量肝细胞质内可见小泡性或颗粒状脂质空泡,NAS均≤4分,符合单纯性脂肪性肝炎或NASH可能表现(图2);12周末肝细胞极度肿胀,肝细胞排列紊乱,索状结构不清,肝窦狭窄,肝细胞胞质内充满大量脂肪空泡,酷似泡沫细胞,界限不清,伴程度不同的炎症细胞浸润,少数出现点、灶状坏死,但未见纤维化,NAS均>4分,符合NASH病理改变(图3)。
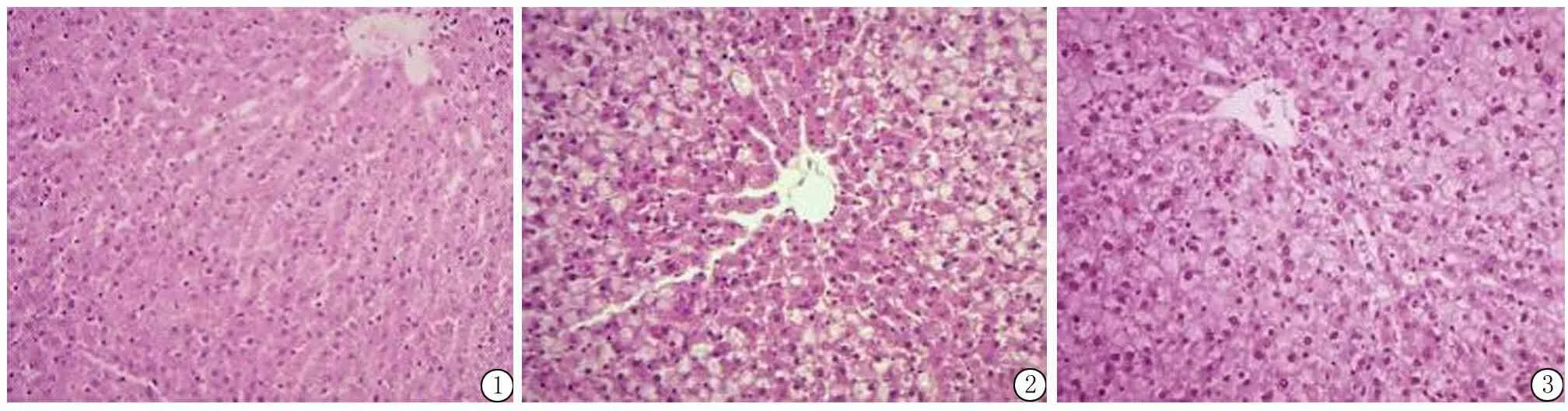
图1 对照组肝索排列规则,肝细胞大小均匀一致,胞核呈圆形,形态规则(HE ×100)
图2 模型8周组肝细胞肿胀,有少量肝细胞质内可见小泡性或颗粒状脂质空泡(HE ×100)
图3 模型12周组肝细胞极度肿胀,排列紊乱,胞质内充满大量脂肪空泡,伴炎症细胞浸润(HE ×100)
2.4 血清指标:与正常组相比,模型组8周末血清MDA开始上升,SOD、GSH-PX开始下降(P<0.05),随时间延长12周末MDA水平进一步升高,SOD、GSH-PX活力进一步降低(P<0.05)。见表2。
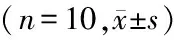

组别处死时间MDA(nmol/mL)SOD(U/mL)GSH-PX(酶活力单位)正常组12周5.8±0.59.3±0.31 197.9±102.2模型组8周6.9±0.6∗6.9±0.1∗869.9±90.8∗12周9.7±0.1∗#5.6±0.5∗#617.2±96.4∗#
*P<0.05与正常组比较 #P<0.05与模型组8周比较(q检验)
MDA:malondialdehyde;SOD:superoxide dismutase;GSH-PX:glutathione peroxidase
3 讨 论
NASH是单纯性脂肪肝发展为NASH相关性肝硬化及肝细胞癌的必经病理阶段,合适的NASH动物模型成为实验研究的关键。NAFLD动物模型大体分为两类[5],即影响肝内脂肪酸氧化的基因敲除或突变模型与环境因素(饮食与药物)导致肝内脂肪酸合成和氧化不平衡引发的脂肪肝模型。高脂饮食建立大鼠NASH模型符合人类脂肪肝发病特点,本研究模型组大鼠的肝湿质量、肝指数均明显高于正常组;病理学角度观察,模型组大鼠肝脏体积增大,包膜紧张,呈奶黄色,切面油腻感,肝细胞水肿,细胞内出现脂肪变性,伴炎症、坏死,且随造模时间延长,病变加重,镜下表现和人类脂肪肝一致。
自由基介导的肝损伤是NASH的重要发病机制,其主要表现为氧化产物增多和(或)过氧化作用减弱。高脂饮食使血清游离脂肪酸增加,当肝细胞产生的大量反应性氧化物(reactive oxygen species,ROS)超过抗氧化系统清除能力时便产生氧化应激,ROS与膜磷脂的不饱和脂肪酸反应形成脂质过氧化,脂质过氧化产物又可改变线粒体DNA,抑制呼吸链的电子传递,进一步增加反应性氧产物和脂质过氧化产物的生成[6-7]。SOD是机体抗氧化损伤防御体系中的最重要的抗氧化酶,GSH-PX可特异性催化还原性谷胱甘肽对过氧化氢的还原反应,起到保护细胞膜及其功能作用。本研究结果显示,模型组大鼠血清SOD和GSH-PX下降明显,而脂质氧化终产物MDA明显升高。表明NASH发生过程中产生了大量自由基和脂质过氧化物,消耗了大量SOD、GSH-PX,损害机体抗氧化防御机制,机体不能清除过多的自由基而导致肝损伤,氧化应激是NASH发病的重要机制之一。
综上所述,高脂饮食所建立的NASH模型具有操作简单、经济、重复性好、动物病死率低、病变逐渐形成等优点,符合人类NAFLD的发生发展过程。
[1] VERBEEK J,CASSIMAN D,LANNOO M,et al.Treatment of non-alcoholic fatty liver disease: can we already face the epidemic? [J].Acta Gastroenterol Belg,2013,76(2):200-209.
[2] 段晓燕,范建高.日本东京2010非酒精性脂肪性肝炎专题报道[J].胃肠病学和肝病学杂志,2011,20(1):1-7.
[3] 郑全喜,王昆,刘超.非酒精性脂肪性肝病动物模型的研究进展[J].中国实验方剂学杂志,2013,19(2):357-360.
[4] 范建高.中国非酒精性脂肪性肝病诊疗指南(2010年修订版)[J/CD].中国医学前沿杂志:电子版,2012,4(7):4-10.
[5] 南月敏,王蕾,李良霄,等.非酒精性脂肪肝动物模型研究进展[J].河北医科大学学报,2007,28(1):67-69.
[6] 董婷,卢胜家,刘璇,等.氧化应激在非酒精性脂肪性肝炎发病机制中的作用[J].肝脏,2012,17(8):602-604.
[7] 蒋艳明,陆璐,钱建成,等.复方楂金颗粒剂对非酒精性脂肪性肝炎大鼠氧化应激的影响[J].中华中医药学刊,2012,30(9):2066-2069.

