猪胎儿成纤维细胞的分离与基因转染
于永生,曹 阳,罗晓彤,张立春,金海国,王晓阳
(吉林省农科院畜牧分院,吉林 公主岭 136100)
中国是世界上养猪规模最大的国家,但猪生产水平远低于欧美养猪发达国家[1]。短期内传统的育种手段很难在猪生产性能方面取得大的进展,转基因动物为猪遗传育种提供了新的技术手段,可大大加速遗传改良的速度,尤其是转基因体细胞核移植技术的出现,为转基因技术在猪改良育种中的应用提供了技术支撑。绿色荧光蛋白(Green-fluorescent protein,GFP)cDNA由 Prasher等在维多利亚水母(Aequorea Victoria)中克隆获得[2],该蛋白在一定波长的紫外光下呈现绿色荧光,可作为标记蛋白用于生物学研究,尤其是由于可直观表现表达效果,而在转基因动物研究领域中广泛应用[3-6]。
表达GFP的转基因猪由Park等采用核移植方法在2001年获取[7],随后韩国的2个实验室也分别获取了GFP转基因猪[8-9]。国内东北农业大学刘忠华研究团队于2007年也获得了国内首批GFP转基因猪[10]。
本文利用组织块贴壁法获取猪胎儿成纤维细胞,通过脂质体介导的转基因技术获得了表达绿色荧光蛋白的转基因细胞,为建立利用核移植技术获取转基因猪的技术平台奠定了基础。
1 材料与方法
1.1 试验材料
怀孕35 d的大白猪来源于吉林省农业科学院畜牧分院种猪场,手术法采集子宫,置于37℃PBS中,1 h内运送至实验室;荧光蛋白真核表达质粒pEGFP-C1为本实验室保存。
1.2 猪胎儿成纤维细胞的分离培养
用灭菌剪刀剖开子宫,取出胎儿,利用添加抗生素的37℃ PBS洗涤至少3遍,置于无菌平皿中,去除头、四肢、内脏,将剩余的躯干转移到另外的灭菌安瓿瓶中,利用灭菌眼科剪将组织剪碎至糊状,将其涂布到细胞培养皿底部,置于38℃、饱和湿度的CO2培养箱中放置4h后,小心加入细胞培养液(DMEM+10%胎牛血清+1%双抗+1%非必需氨基酸),尽量避免组织块漂浮,继续以上述条件进行培养,每72h换液一次,在第9 d左右成纤维样细胞开始从组织块孵出,利用0.25%的胰蛋白酶消化细胞,进行传代。
1.3 猪胎儿成纤维细胞生长曲线测定
用0.25%胰蛋白酶消化传至第三代的猪胎儿成纤维细胞,将细胞悬液与等量0.5%台盼蓝混合染色,利用细胞计数板进行活细胞计数,利用细胞培养液将活细胞浓度调整为2×104/mL,接种至24孔细胞培养板,每孔接种量为0.5 mL,将细胞培养板置于38℃、5%CO2、饱和湿度的CO2培养箱中培养。每24 h利用细胞计数板计数3个孔中的活细胞数目,计算平均活细胞数,利用Excel绘制生长曲线。
1.4 猪胎儿成纤维细胞最小致死浓度测定
将传至第三代的猪胎儿成纤维细胞按每孔接种2×105细胞的量接种到24孔板的6个孔,24 h 后换液,分别用终浓度为 0、200、400、600、800、1000μg/mL的G418进行处理,每72h换液1次,培养9 d后所有细胞均凋亡的G418浓度,就是G418对猪胎儿成纤维细胞的最小致死浓度。
1.5 猪胎儿成纤维细胞的转染
将传至第三代的猪胎儿成纤维细胞接种至6孔板中,利用不添加双抗的细胞培养液进行培养,待生长至80%汇合时,按照脂质体2000说明书的方法进行基因转染,每孔用脂质体10μL,质粒4μg。转染18 h后利用含最小致死浓度的G418的细胞培养液进行筛选,每72 h换液一次。
1.6 转基因细胞的鉴定
筛选9 d后,利用荧光显微镜观察细胞是否具有荧光,同时利用0.25%胰蛋白酶消化部分细胞,蛋白酶K(150μg/mL)消化后用两倍体积的无水乙醇(含0.075M的氯化钠)沉降DNA,利用引物P1和P2,PCR检测外源基因的整合。引物序列如表1所示。

表1 PCR引物序列
2 结果与分析
2.1 组织块法分离培养猪胎儿成纤维细胞
贴壁的组织块培养3 d后仅有少量成纤维细胞从组织块边缘游离出,接种9 d后,组织块周围即可长出大量成纤维细胞(图1A)。利用胰蛋白酶传代,传代后的细胞呈梭形,生长旺盛(图1B)。

图1 猪胚胎成纤维细胞分离培养
2.2 细胞生长曲线的测定
每天对24孔板中的3个孔进行活细胞计数,绘制细胞生长曲线(图2),可以发现细胞生长趋势为:细胞生长滞留期为0~1 d,对数生长期为2~4 d,5 d后进入平台期。

图2 猪胎儿成纤维细胞生长曲线图
2.3 G418对猪胎儿成纤维细胞最小致死浓度的确定
以6个不同浓度的G418处理猪胎儿成纤维细胞,观测细胞形态,发现600μg/mL的G418处理9 d后可使猪胎儿成纤维细胞全部死亡,因此在筛选转基因细胞时采用的G418浓度为600μg/mL。
2.4 转基因细胞的鉴定
对筛选得到的转基因细胞提取DNA,利用PCR对外源基因的整合进行鉴定,结果显示,可检测到预期片段(图3),说明外源基因有效整合到细胞基因组。
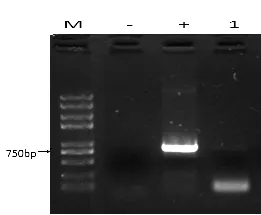
图3 GFP转基因细胞和克隆胚胎DNA检测结果
在荧光显微镜下,可以看到筛选得到的细胞大多可表达绿色荧光蛋白(图4),说明外源基因得到有效表达。

图4 GFP转基因猪成纤维细胞(200x)
3 讨论
目前猪胎儿成纤维细胞的分离主要采用两种方法:蛋白酶消化法和组织块法。前者是先用蛋白酶对组织块进行消化,经过筛网过滤后,细胞悬液接种到细胞培养皿(瓶),经过3~5 d培养获得原代细胞,该方法需要时间短,但蛋白酶消化程度不好把握,容易对分离的细胞增殖造成一定影响;后者是把组织剪碎后接种到培养皿(瓶)壁,当组织周围孵出的细胞形成单层时,消化这些单层细胞即可获得原代细胞,该方法获得的细胞增殖能力比较稳定,但需要的时间长。综合考虑利弊,本文采用组织块贴壁法进行猪胎儿成纤维细胞的分离,通过9 d组织块贴壁培养,最终获得了形态正常的猪原代胎儿成纤维细胞。传至第三代,绘制的细胞生长曲线显示,接种第一天细胞处于恢复期,细胞数量有所下降,因为部分细胞死亡。从第二天开始细胞恢复旺盛的增殖分裂,进入对数生长期,5 d后进入平台期,细胞铺满培养皿,随后由于细胞相互接触,生长受到抑制。该结果与李仕新等采用酶联检测仪测定OD值法绘制的蛋白酶消化法分离的猪胎儿成纤维细胞的生长曲线的实验结果不一致,该研究小组结果显示猪胎儿成纤维细胞于生长初期1~6 d呈对数增长,此后进入平台期,差异可能是由于细胞分离方法以及生长曲线绘制方法不同而造成[7]。猪胎儿成纤维细胞的分离为进一步的基因转染奠定了基础。
转基因细胞一般采用脂质体介导转染法、电击法、钙沉淀法、病毒介导法进行获取。电击法往往适用于所转移的片段比较大、细胞转染率低等情况;钙离子沉淀法需要对钙离子浓度进行精密控制,不易操作且实验重复性差;病毒介导法具有转基因效率高的特点,但考虑到安全性,往往在以获取转基因动物为目的的研究中应用不多;脂质体法主要利用带正电荷的阳离子脂质体与带负电荷的DNA片段结合,进而将DNA导入细胞膜脂质双分子层内,从而完成转基因,目前脂质体法已经在猪、牛、羊等动物细胞转基因方面得到应用。综合考虑上述的转基因方法,本项目采用脂质体介导的转基因技术进行基因导入,按脂质体10μL:荧光蛋白质粒4μg的比例对六孔板中的细胞进行转染,由于荧光蛋白质粒上带有neo基因,一旦整合到细胞中,可表达neo蛋白,有效抵抗G418对细胞的危害,因此可用G418对转染后的细胞进行筛选,经过600μg/mL的G418的筛选,最终得到转基因细胞,PCR检测荧光蛋白基因得到有效整合,荧光检测显示,所获取的细胞大多可表达绿色荧光蛋白,说明外源基因得到有效表达,所得转基因细胞可以作为生产转绿色荧光蛋白猪的核移植供体细胞,为下一步通过核移植方法获得转基因“荧光猪”奠定了基础。
[1]熊远著 .中国养猪业发展道路[J].中国猪业,2006(4):1-4.
[2]Prasher DC,Eckenrode VK,Ward WW,et al.Primary structure of the Aequorea victoria green-fluorescent protein[J].Gene,1992,111(2):229-233.
[3]Takada T,Iida K,Awaji T.Selective production of transgenic mice using green fluorescent protein as a marker[J].Nat Biotechnol,1997,15(5):458-461.
[4]Koo BC,Kwon MS,Roh JY,et al.Quantitative analysis of tetracycline-inducible expression of the green fluorescent protein gene in transgenic chickens[J].J Reprod Dev,2012,58(6):672-677.
[5]Lin F,Liu Q,Li M,et al.Transient and stable GFP expression in germ cells by the vasa regulatory sequences from the red seabream (Pagrus major)[J].Int J Biol Sci,2012,8(6):882-890.
[6]Murakami T,Kobayashi E.GFP-transgenic animals for in vivo imaging:rats,rabbits,and pigs[J].Methods Mol Biol,2012(872):177-189.
[7]Park K W,Cheong H T,Lai L,et al.Production of nuclear transfer-derived swine that express the enhanced green fluorescent protein[J].Anim Biotechnol,2001(12):173-181.
[8]Hyun S,Lee G,Kim D,et al.Production of nuclear transfer-derived piglets using porcine fetal fibroblasts transfected with the enhanced green fluorescent protein[J].Biol Reprod,2003(69):1060-1068.
[9]Lee G S,Kim H S,Hyun S H,et al.Production of transgenic cloned piglets from genetically transformed fetal fibroblasts selected by green fluorescent protein [J].Theriogenology,2005(63):973-991.
[10]刘忠华,宋 军,王振坤,等.体细胞核移植生产绿色荧光蛋白转基因猪[J].科学通报,2008,53(5):556-560.
[11]李仕新,陈松玲,李加琪,等.长大二元杂交猪胎儿成纤维细胞的生物学特性 [J].四川农业大学学报,2012,30(2):220-225.
[12]李景芬,于 浩,袁 野,等 .同源重组敲除MSTN基因的猪胎儿成纤维细胞的构建 [J].中国农业科学,2009,42(8):2972-2977.
[13]于永生,罗晓彤,张立春,等.牛胎儿成纤维细胞的分离培养及转染线虫ω-3脂肪酸去饱和酶基因 [J].中国农学通报,2011,27(23):12-16.
[14]王彦凤,梁 燕,金 永,等 .克隆内蒙古白绒山羊胸腺素β4基因并稳定转染胎儿成纤维细胞 [J].中国农业科学,2010,43(21):4497-4504.

