烟蚜茧蜂毒蛋白对寄主生长发育的影响
李艳红
(吉林农业工程职业技术学院,吉林 四平 136001)
烟蚜茧蜂(Aphidius gifuensis)是寄生蔬菜、果树、棉花和大田作物上蚜虫的一种寄生蜂。作为一种害虫生物防治的重要因子,在温室以及大田中,烟蚜茧蜂都起到了很重要的作用[1]。有关内寄生蜂对鳞翅目寄主的作用国内外有大量报道,但在半翅目蚜虫上还很少,主要表现在寄主的免疫抑制与发育受阻上[2],如寄主降低生长速度、延迟发育[3],减少脱皮素的产量[4],减少血淋巴细胞数目、转化及改变行为[5]。寄生蜂产生的毒蛋白如毒液、萼液和畸形细胞均能产生这样的生理作用[6],但是,三者对寄主的作用又因种类而存在差异,如菜蛾盘绒茧蜂(Cotesia plutellae)寄生小菜蛾后,寄主不能正常化蛹,3种寄生因子均发挥了关键性的作用,单独注射PDV或畸形细胞和毒液均能抑制寄主化蛹[7]。甲腹茧蜂(Cotesia inanitus)寄生寄主后,寄主不能正常化蛹,畸形细胞只在寄生寄主的初期出现,在这过程中,PDV和毒液起到了主要的作用。
本试验以寄生蜂产生的毒蛋白对寄主的生长和发育的影响为研究模式体系[8],为了克服萼液、毒液和幼蜂作用的干扰以及作用剂量的不同,采用假寄生、过寄生和显微注射畸形细胞的方法,来研究3种毒蛋白对寄主蚜虫生长发育的影响[9]。可揭示寄生蜂作用于寄主的内部奥秘,并对指导寄生蜂的人工培养利用和害虫综合治理以及探索应用生物科技控制害虫等方面具有重要的理论和实践价值。
1 材料与方法
1.1 试验材料
在辽宁省昆虫重点实验室内,通过萝卜(Raphanus sativus L.)[(温度(25±2)℃,相对湿度70%~90%,每日光照周期L/D∶14/10(L夜间,D白天),光照强度3000 Lx的人工气候培养箱中)]连代扩繁烟蚜茧蜂,羽化出蜂,经鉴定确认后,按雌雄蜂1∶1配对,交配后接种于预先繁殖有200~300头烟蚜的盆栽萝卜植株上,进行扩繁[10]。
1.2 试验方法
1.2.1 被寄生寄主的获得
将交配过的烟蚜茧蜂20头移入指形管(Φ=1.5 cm,h=5 cm)内,分别接入 2 龄末、3 龄、4龄初及4龄末若蚜20头,一次寄生行为发生后,换以未接触过蜂的同龄若蚜,控制每蜂寄生8~10头;寄生头数达到试验所需,记录寄生时间;将寄生后的若蚜接入人工气候箱内隔离的鲜嫩萝卜叶片上,供试昆虫在上述条件下饲养。
1.2.2 雌蜂的处理
在无菌操作台上,用紫外灯光照射交配过的雌蜂100头3 h(在本实验室内,进行3次重复试验,分别对交配过的雌蜂50头用紫外灯照射0.5 h、1.0 h、1.5 h、2.0 h、2.5 h、3.0 h、3.5 h 和 4.0 h,然后,分别寄生50头3~4龄若蚜,结果发现照射3h的雌蜂寄生的蚜虫的卵孵化率仅为3.6%),随后按上述方法让其寄生2龄末、3龄、4龄初若蚜,每日解剖20头被寄生各龄期寄主,观察各处理寄生蜂卵孵化情况。以未经照射处理的正常雌蜂寄生的同龄若蚜做比较,观察假寄生对寄主若蚜发育的影响,同时以未寄生的同龄若蚜作对照。
1.2.3 畸形细胞的收集
在4℃无菌生理盐水中解剖寄生5 d已消毒的僵蚜,用毛细吸管将吸入的畸形细胞,置于凹玻片上,经生理盐水多次冲洗去除寄主血细胞和组织后,再吸入到冰浴中的离心管内,沉淀一定时间后,将上半部分弃去,将沉淀再用生理盐水冲洗,直至无寄主血细胞及其他组织的残留,在冰浴中保存立即用作显微注射。畸形细胞注射前的活性由0.1%中性红吸收和0.4%台盼蓝排斥进行检测。
1.2.4 畸形细胞的注射
将100头4龄的若蚜或假寄生后第7d的4龄若蚜用乙醚麻醉,用显微注射器将吸入的畸形细胞从蚜虫腹部注射,每头虫注射约1μL,同时注射等量的无菌生理盐水作为对照。注射后,每日观察蚜虫的发育,100头假寄生寄主被注射后,每日称量注射后寄主的体重(0.0001 g),并同时设注射生理盐水和未经注射的假寄生寄主的体重作为对照。
1.2.5 过寄生与假寄生的获得
对3龄寄主进行多次 (2~4次)寄生与假寄生,正常寄生1次与多次(2~4次)寄生,每日定时称量寄主体重,均设同期未寄生寄主的体重变化为对照。以50头供试若蚜为1个处理,设3次重复;观察记录寄主在不同寄生状态下的生长发育情况,并测量最大寄主的体长和称取体重。
2 结果与分析
2.1 毒液与萼液和畸形细胞对寄主生长发育的影响
未寄生寄主的发育均快于假寄生和正常寄生寄主,寄生2 d后,正常寄生寄主达到显著差异水平,到第5 d达到极显著水平,说明寄生能引起寄主发育的抑制;但从寄生后第7 d起,未寄生寄主已发育成成蚜,假寄生寄主继续取食发育,最大寄主体重可达0.93 mg,略超过对照未寄生寄主达到成蚜时的最大寄主体重0.91 mg(表1)。若虫期延长,说明毒蛋白具有抑制若虫发育的作用;正常寄生后,97.1%的被寄生雌蚜不能进行孤雌生殖,这说明寄生蜂产生的畸形细胞具有抑制生殖的作用;但从假寄生寄主体重的增长趋势来看,它与正常寄生不同,正常寄生后,寄主体重增长缓慢,这说明是畸形细胞起作用的结果。
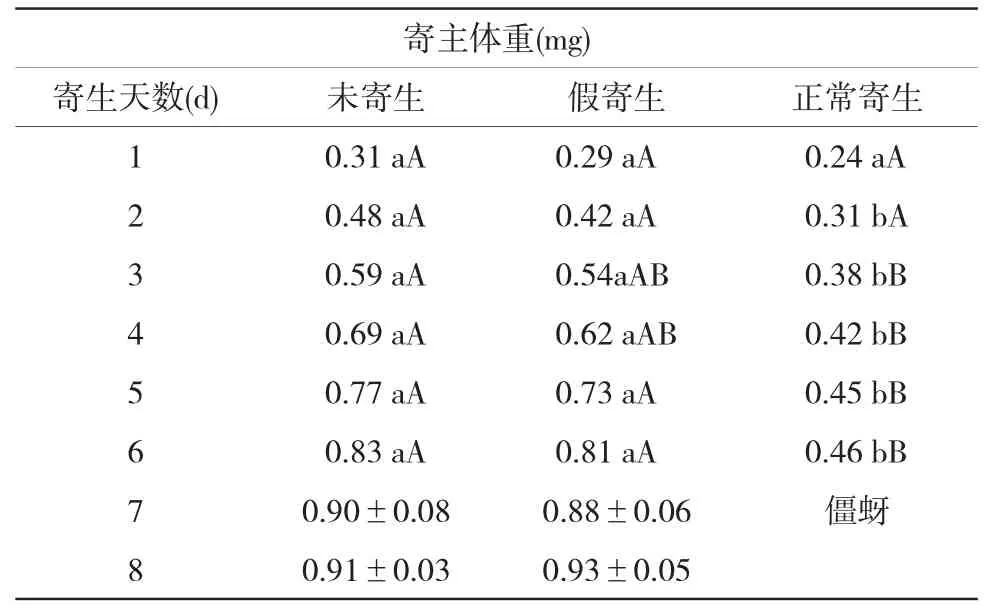
表1 寄生对寄主体重的影响
2.2 不同剂量的毒液与萼液对寄主生长发育的影响
对被寄生寄主进行解剖发现,在寄主体内存在蜂卵,说明经紫外灯处理的雌蜂仍能进行产卵寄生,随着对整个生育期的连续解剖,(96.4±2.8)%的蜂卵不能进行孵化,并且绝大多数的蜂卵未能被寄主的免疫系统所识别而进行血细胞包囊。假寄生的2龄末、3龄和4龄初寄主若虫期延长,对一次假寄生的寄主而言,毒液与萼液剂量较低,若虫期延长8~12 d,而多次假寄生的寄主,其剂量成2~4倍增加,当发育到第11 d后,转化成僵蚜,说明剂量增加对寄生生长和发育有明显抑制作用。从图中还可以看到,多次寄生寄主的体重均低于单次寄生寄主的体重,这也说明随着毒液和萼液剂量的增加,对寄主体重有显著的影响。
2.3 不同剂量的畸形细胞对寄主生长发育的影响
从图2中可以看出,多次正常寄生寄主的体重低于单次寄生寄主的体重,说明随着剂量增加,畸形细胞对寄主抑制作用增强,同时也低于多次假寄生的寄主的体重,说明3种毒蛋白共同作用的结果超过了毒液与萼液的影响。当寄主被寄生2d后,正常寄生的蜂卵即将孵化,同时畸形细胞体积逐渐增大,对寄主的生长抑制更为明显,而假寄生寄主不存在这种情况。

图2 四种寄生情况对寄主的影响
2.4 注射活体畸形细胞对寄主生长发育的影响
表2、3所示,注射畸形细胞与注射生理盐水相比,寄主的体重降低,与未寄生寄主相比,体重增加缓慢,达到的最大体重也低于正常发育的寄主的体重,并从表中能够看出,因为蚜虫虫体较小,注射器伤口造成的寄主死亡率较高。因此,产生寄主体重低的原因可能是畸形细胞和伤口共同造成的。

表2 注射畸形细胞对蚜虫的生长发育的影响
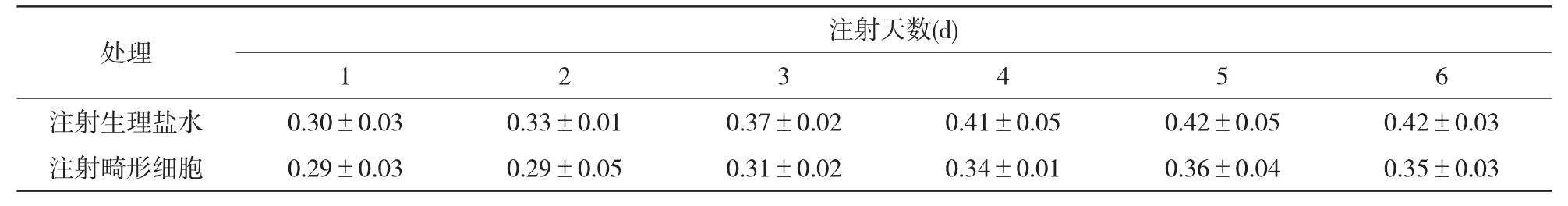
表3 注射畸形细胞后对寄主体重的影响
3 结论与讨论
雌蜂经紫外灯处理后,虽能正常产卵,但产卵不能孵化,采用这种方法造成的假寄生能够排除蜂卵孵化时释放的畸形细胞的作用,单独分析寄生蜂在产卵时注入体内毒液和萼液对寄生蜂的作用。毒液和萼液使寄主蚜虫取食期延长,发育历期较未寄生寄主的也长。俞瑞鲜等(2006)[11]提出萼液对寄主的作用是通过毒液而实现的。而正常寄生后,在幼蜂即将结茧化蛹前,寄主停止取食,寄主转化成僵蚜,这说明有畸形细胞和幼蜂的存在能明显改变寄主的行为。从该研究结果分析认为,幼蜂的存在是保证畸形细胞发挥作用的前提,首先是保证畸形细胞不被寄主血细胞包囊,之后各因素的协同效应共同抑制寄主的发育,以确定保证幼蜂的发育。曹婷婷[12]得出了用0.05VRE浓度的毒液或0.05FE/μL浓度的毒液和萼液混合物处理离体条件下小菜蛾血细胞就失去了包囊作用。这说明蜂产卵初期由于毒液和萼液的作用,也抑制了寄主免疫系统的作用,使蜂卵进行生长发育,伴随着蜂卵的生长,产生的畸形细胞开始起到反包囊作用,进而抑制或破坏寄主的免疫系统。我们的研究也发现,单纯注射畸形细胞后,寄主体重也呈现下降的趋势,但下降的趋势不如正常寄生中3种毒蛋白的影响显著。
本试验采用的假寄生较注射的方式有其独特的优异性,首先它反映的是自然寄生时寄生因子生理剂量的效应,避免了显微注射人为的机械损伤以及剂量难以控制、生物活性的丧失等因素的干扰,能真正反映寄生因子的生理作用。但对于畸形细胞的研究我们通过与假寄生相结合的方式,一定程度上也能反映正常寄生情况下各种因子的作用。
从我们的研究来看,3种毒蛋白能影响寄主的生长发育,表现在体重降低,若虫期延长等。有报道称,多分DNA病毒也对特别是在寄生前期,但到寄生后期,则需畸形细胞的协同作用,共同抑制寄主的生长,以保证幼虫在完成发育后顺利从寄主中羽化出[13]。关于烟蚜茧蜂3种毒蛋白对寄主免疫系统和各种酶的影响将在未来的研究中进一步实现[14]。
[1]刘金文,李建平,丛 斌,等.烟蚜茧蜂畸形细胞发生及发育[J].植物保护,2008,34(1):62-66.
[2]Hotta M,Okuda T,Tanaka T.Cotesia kariyai teratocytes:growth and development[J].Journal of Insect Physiology,2001(47):31-41.
[3]Norton W N,Vinson S B.Encapsulation of a parasitoid egg within its habitual host:an ultrastructural investigation[J].Journal of Invertebrate Pathology,1977(30):55-67.
[4]Dover B A,Vinson S B.Stage-specific effects of Campoletis sonorensis parasitism on Heliothis virescens development and prothoracic glands[J].Physiol.Ent.,1990(15):405-414.
[5]Stoltz D,Makkay A.Co-replicafon of a reovirus and a polydnavirus in the ichneumonid parasitoid Hyposoter exiguae[J].Virology,2000(278):266-275.
[6]Lawrence P O,Lanzrein B.Hormonal interactions between insect endoparasites and their host insects[J].In:Parasites and Pathogens of Insects. (Backage N E,Thompson S N,Federici B A.Eds.).1993(1):59-86.
[7]白素芬,陈学新,程家安,等.菜蛾盘绒茧蜂多分DNA病毒的特性及其对小菜蛾幼虫的生理效应[J].昆虫学报,2003,46(4):401-408.
[8]刘金文,颜秀娟,丛 斌.烟蚜茧蜂畸形细胞对寄主生理代谢的调控[J].中国农学通报,2011,27(9):368-371.
[9]刘金文,李建平,丛 斌,等.协同寄生蜂寄生寄主的因素及其作用[J].安徽农业科学,2006,34(21):5588-5590.
[10]忻亦芬,李学荣,王洪平,等 .用萝卜苗作桃蚜植物寄主繁殖烟蚜茧蜂[J].中国生物防治,2001,17(2):49-52.
[11]俞瑞鲜.菜蛾盘绒茧蜂毒液对寄主小菜蛾生理调控机制的研究[D].浙江大学,2006.
[12]曹婷婷.菜蛾盘绒茧蜂毒液和萼液对寄主小菜蛾幼虫的免疫调控研究[D].浙江大学,2008.
[13]Johner A,Lanzrein B.Characterization of two genes of the polydnavirus of Chelonus inanitus and their stage-specific expression in the host Spodoptera littoralis[J].Journal of General Virology,2002(80):1847-1854.
[14]Md.Ramjan Ali,Jongbok Seo,Daeweon Lee,et al.Teratocyte-secreting proteins of an endoparasitoid wasp,Cotesia plutellae,prevent host metamorphosis by altering endocrine signals[J].Comparative Biochemistry and Physiology,2013(166):251-262.

