自身免疫性肝炎与慢性乙型肝炎患者肝组织MUM-1表达的差异
蒋丽琳,陆忠华,顾娟,冯云霞,陈宏,冯一中
·短篇论著·
自身免疫性肝炎与慢性乙型肝炎患者肝组织MUM-1表达的差异
蒋丽琳,陆忠华,顾娟,冯云霞,陈宏,冯一中
目的探讨自身免疫性肝炎(AIH)和慢性乙型肝炎患者肝组织多发性骨髓瘤癌基因-1(MUM-1)在浆细胞和浆母细胞中的表达及其意义。方法对18例AIH和20例慢性乙型肝炎患者行肝穿刺,取肝组织行免疫组化染色,应用半定量法评估MUM-1表达的差异。结果MUM-1阳性颗粒主要分布在界面型肝炎区的浆细胞/浆母细胞核中,20例AIH患者肝组织MUM-1均阳性,而在慢性乙型肝炎患者肝组织仅1例(5%)阳性;AIH患者肝组织浆细胞/浆母细胞MUM-1表达强度为(1.94±1.056)。结论MUM-1在自身免疫性肝炎患者肝内浆细胞/浆母细胞表达的意义还有待于进一步研究。
自身免疫性肝炎;慢性乙型肝炎;多发性骨髓瘤癌基因-1;免疫组织化学
自身免疫性肝炎(Autoimmune hepatitis,AIH)是由自身免疫反应介导的一种病因不明的慢性进行性肝脏炎症性疾病,其临床表现为不同程度的血清转氨酶升高、高γ-球蛋白血症、抗自身抗体阳性。该病在欧美国家发病率较高,在我国其确切发病率和患病率尚不清楚。迄今为止,AIH的病因和发病机制尚未得到完全阐明,遗传易感、病毒感染、自身免疫功能异常等多种因素均可能参与其发病[1],最终可导致免疫耐受失衡,引起肝内进行性的炎症、坏死及纤维化。尽管该病在临床表现、血液生化、自身抗体和组织病理等方面与其他慢性肝炎有不同的特点,然而它们有时表现不典型,给诊断带来了一定的困难。新近国外的一些学者采用免疫组织化学法对不同病变肝组织浆细胞及浆母细胞进行了比较和分析,发现有助于对AIH的鉴别诊断。多发性骨髓瘤癌基因(multiple myeloma oncogene 1,MUM-1)是干扰素调控因子家族成员之一,在促进生发中心后B细胞向浆细胞分化过程中发挥重要调控作用。在活化的生发中心后B细胞、免疫母细胞、浆母细胞和浆细胞中高表达[2]。鉴于国内尚无该方面的文献报道,本实验同样采用免疫组化方法,针对MUM-1在AIH患者和慢性乙型肝炎患者肝穿组织中浆细胞和浆母细胞的表达情况,进行了比较分析,初步探讨了MUM-1检测在AIH与其他慢性肝炎鉴别诊断中的意义。
1 资料与方法
1.1 病例来源收集2012年1月~2014年5月我院收治的AIH患者18例[女性17例,男性1例;年龄26~70岁,平均年龄(48.7±13.0)岁];慢性乙型肝炎患者20例[男14例,女6例;年龄24~61岁,平均年龄(40.5±9.6)岁]。病例诊断参考2008年国际自身免疫性肝炎小组(IAIHG)提出的AIH简化诊断积分系统及2010年美国肝病学会(AASLD)更新的有关AIH的诊断和治疗指南[3、4],在AIH患者,排除肝炎病毒感染及药物性、酒精性和遗传代谢性肝病。
1.2 血液生化和抗自身抗体检测使用AU5400型(日本奥林巴斯)全自动生化分析仪和日本和光纯药工业株式会社试剂检测血生化;采用酶联免疫吸附法检测抗核抗体(ANA,德国欧蒙公司试剂);采用免疫印迹法检测抗线粒体(AMA)-M2亚型抗体、抗肝肾微粒体-1(LKM-1)抗体、抗肝特异性胞质1型(LC-1)抗体、抗可溶性肝抗原/肝胰抗原(SLA/LP)抗体(德国欧蒙医学实验诊断股份公司)。
1.3 肝活检组织学检查使用BARD 14G一次性活检针经皮穿刺,肝组织经石蜡包埋后连续切片,常规HE染色。
1.4 肝组织MUM-1检测采用免疫组化法,兔抗人MUM-1单克隆抗体和DAB显色试剂盒均购自上海长岛生物技术开发有限公司。取石蜡包埋肝组织,4 μm薄切片,脱蜡至水,加柠檬酸缓冲液,微波中高火修复5 min。自然冷却后水洗,PBS冲洗3 min×3次,滴加一抗,室温孵育1 h,PBS冲洗后再PBS洗3 min×3次,滴加二抗,室温下40 min,PBS冲洗后再PBS洗3 min×3次,DAB显色,苏木精衬染,封片。为减少读片者主观影响,采用盲法,按Daniels et al[5]半定量评分法,在高倍物镜(400×)下对浆细胞和浆母细胞MUM-1阳性表达细胞数量进行半定量分级,分为偶见(1分)、少见(2分)、中等(3分)和显著(4分)。
1.5 统计学方法采用SPSS 13.0统计软件进行数据分析,计量资料以()表示,两组样本比较采用t检验,以P<0.05为有统计学差异。
2 结果
在20例慢性乙型肝炎患者中,肝组织MUM-1弱阳性表达1例(5%),几乎未见MUM-1阳性颗粒表达(图1);在18例AIH患者,肝组织MUM-1均阳性表达(100%,图2),表达强度为(1.94±1.06),明显高于慢性乙型肝炎患者(P=0.000)。MUM-1阳性颗粒主要分布在界面性肝炎区浆细胞和浆母细胞胞核中(图3),并成簇分布(图4),在肝小叶内亦可见浆细胞和浆母细胞有MUM-1阳性颗粒表达(图5)。
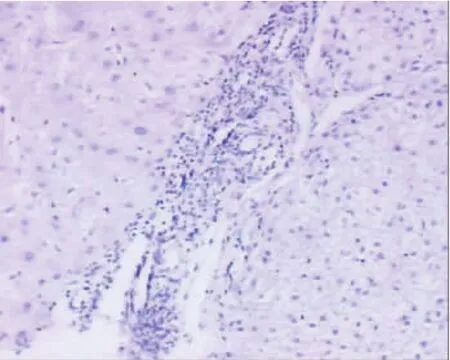
图1 慢性乙型肝炎患者肝组织MUM-1表达情况检测结果为阴性(SP,200×)
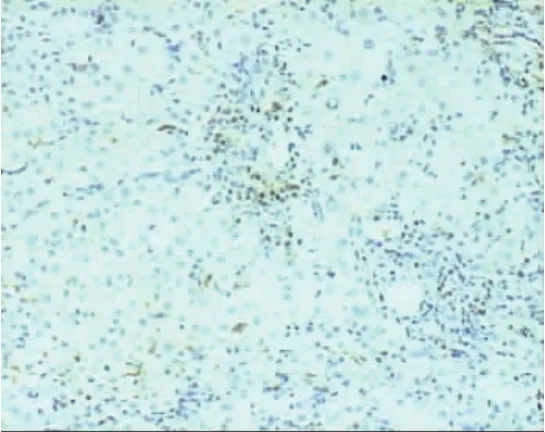
图2 AIH患者肝组织MUM-1表达情况在界面性肝炎区,有MUM-1阳性表达的浆细胞和浆母细胞明显增多(SP,200×)
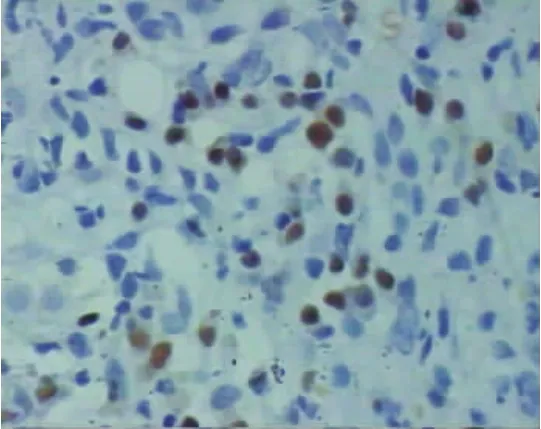
图3 AIH患者肝组织MUM-1表达情况界面性肝炎区MUM-1阳性颗粒主要分布在浆细胞和浆母细胞核中(SP,400×)
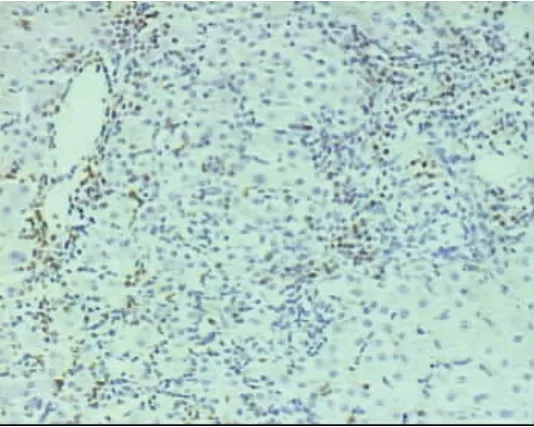
图4 AIH患者肝组织MUM-1表达情况在界面性肝炎区,MUM-1阳性标记的浆细胞和浆母细胞成簇分布(SP,200×)

图5 AIH患者肝组织MUM-1表达情况肝小叶内少量MUM-1阳性表达细胞(SP,200×)
3 讨论
自身免疫性肝炎是针对肝抗原的异常免疫攻击所造成的肝损伤。虽然ANA,抗平滑肌抗体(SMA)、抗LKM-1阳性是典型的AIH患者的血清学标志,但是这些抗体也能在其它疾病中检出,无疾病特异性,不能作为AIH诊断或预测疗效的决定性指标。
AIH患者肝组织以小叶内炎症、变性、坏死为主,与慢性乙型肝炎病理学改变相似,表现为汇管区炎症,其中可见淋巴细胞、浆细胞及单核细胞浸润,界面性炎症,小叶内肝细胞水样变性及气球样变性,可见凋亡小体,点状、灶状或小片状坏死,部分病例可见肝细胞呈玫瑰花结样排列。界面性炎症是AIH最具特征性的病理学改变,在界面炎区域常可见到醒目、成簇排列的浆细胞浸润,病情继续发展可出现桥样坏死及融合性坏死和花结细胞,几乎所有病例均存在不同程度的纤维组织增生,重症患者可见纤维间隔及假小叶形成,最终病情可进展至肝硬化[6]。在汇管区及界面性肝炎区浆细胞较多,并常聚集成簇,作为AIH的特点,可与其他慢性肝炎的界面性肝炎相区别[7]。
早在1999年,国际AIH小组就指出自身免疫性肝炎诊断积分标准的病理改变有3项,具有全部3项改变者加5分,即界面性肝炎3分,浆细胞浸润1分,肝细胞花结形成1分;而不具备者减5分。可见,肝组织学是诊断AIH的关键参数。然而,有时汇管区界面性肝炎的炎症细胞,尤其是淋巴细胞和浆细胞,在HE染色中很难区分。因此,我们需要找到一种特定的方法,能够清楚地将界面性炎症中的浆细胞标记出来,以便于我们对AIH诊断积分标准的准确判定,为临床诊断AIH提供可靠证据。
MUM-1是一种特殊的淋巴细胞转录因子[8]。有研究发现MUM-1缺陷小鼠会发生进行性淋巴结病,并伴有严重低免疫球蛋白血症,活化的淋巴细胞和浆细胞数量明显减少,抗体反应低下,T淋巴细胞细胞毒作用或抗肿瘤反应能力下降,说明MUM-1对T、B细胞成熟和自稳是必需的。在B细胞中,浆细胞、一小部分生发中心B细胞(Germinal center B cells,GCB)及生发中心后B细胞,即GCB向浆细胞成熟分化的终末阶段细胞均有MUM-1表达。在T细胞中,无论是正常T细胞,还是异常活化的T细胞均有MUM-1表达[9]。CD4+CD25+调节性T细胞(regulatory T cell,Treg)是一群专职的主动抑制针对自身抗原或外来抗原免疫反应的细胞,在维持免疫平衡中发挥重要作用[10]。Maria et al[11]证实AIH患者Treg细胞数量及功能均有缺陷。虽然Treg细胞不直接诱导细胞凋亡,但AIH患者体内效应T细胞的自发凋亡功能存在缺陷。另有研究表明Treg细胞特异性表达Foxp3,后者对Treg细胞的发育和功能具有至关重要的作用[12]。Wahl et al[13]研究发现,Foxp3基因缺陷小鼠会引起炎症性及自身免疫性疾病。有实验证实AIH患者肝组织Foxp3表达显著低于慢性乙型肝炎患者[14]。Lafdil et al认为,IL-17受体几乎表达于所有类型肝脏细胞上,它主要通过刺激多种类型的肝脏非实质细胞产生前炎症介质及趋化因子,从而对肝脏造成损伤[15]。因此,我们认为Th17细胞及其分泌的炎症介质可能参与了AIH的发病过程。此外,近期研究发现Th17细胞与Treg细胞在免疫调节方面作用相反,因此有人提出Treg/Th17细胞平衡失调可能在AIH的发病机制中起一定的作用[16]。普遍认为,AIH患者肝组织自身抗原被专职抗原提逞细胞(APC)以HLA-II类分子限制形式提逞给未分化Th细胞,激活的Th细胞在IL-12或IL-4的诱导下分化为Th1细胞和Th2细胞,并通过分泌细胞因子促进细胞免疫及体液免疫的发生,从而引起肝细胞损伤[17]。Treg细胞的活化是抗原特异性的,活化后分泌大量的细胞因子,有针对性地抑制Th0细胞的激活,从而抑制Th1介导的免疫和炎症反应及Th2介导的抗体产生和CD8+细胞毒性T淋巴细胞的活性[18]。MUM-1同时又是干扰素调节因子家族成员[8,19,20]。
本实验仅仅观察了MUM-1在AIH患者和慢性乙型肝炎患者肝脏中浆细胞及浆母细胞的表达,而MUM-1在其它慢性肝炎患者肝内如何表达及MUM-1在AIH发病的自身免疫调节上究竟发挥着怎样的作用仍需要进一步研究。
[1]Wang PZ.Autoimmune hepatic disease and autoantibodies.Clin Focus,2005,20(4):230-232.
[2]霍颖颖,潘毅,管冰心,等.MUM-1/IRF4在滤泡性淋巴瘤中的表达及意义.中华病理学杂志,2011,40(8):528-531.
[3]Manns MP,Czaja AJ,Gorham JD,et a1.Diagnosis and managementofauto-immunehepatitis.Hepatology,2010,51(6): 2193-2213.
[4]Qiu D,Wang Q,Wang H.Validation of the simplified criteriafor diagnosis of autoimmune hepatitis in Chinese patients.Hepatology,2011,54(2):340-347.
[5]Daniels JA,Torbenson M,Anders RA,et al.Immunostaining of plasma cells in primary biliary cirrhosis.Am J Clin Pathol,2009,131(2):243-249.
[6]丁红兵,陈育霞,杨环文,等.自身免疫性肝炎与原发性胆汁性肝硬化患者血生化和肝组织病理学分析.实用肝脏病杂志,2014,17(1):84-85.
[7]王泰龄,赵新颜.自身免疫性肝炎的病理特点.临床肝胆病杂志,2011,27(6):577-580.
[8]Mamane Y,Heylbroeck C,Genin P.Interferon regulatory factors: the next generation.Gene,1999,237(1):1.
[9]Falini B,Fizzotti M,Pucciarini A,et al.A monoclonal antibody(MUM1p)detects expression of the MUM-1/IRF4 proteininasubset of germinal center B cells,plasma cells,and activated T cells.Blood,2000,95:2084-2092.
[10]Sakaguchi S.NaturallyarisingFoxp3-expressingCD25+CD4+regulatoryTcellsinimmunologicaltolerancetoselfand non-self.Nat Immunol,2005,6:345-352.
[11]Longhi MS,Hussain MJ,Mitry RR,et al.Functional study of CD4+CD25+regulatory T cells in health and autoimmune hepatitis.Immunology,2006,176:4484-4491.
[12]Hori S,Nomura T,Sakaguchi S,et al.Control of regulatory T celldevelopmentbythetranscriptionfactorFoxp3.Science,2003,299:1057-1061.
[13]Wahl SM,Vazquez N.Chert WJ,el al.Regulatory T cells and transcription factors:Gatekeepers in allergic inflammation.Cur OpinImmunol,2004,16:768-774.
[14]李明,诸葛洪祥,朱传武,等.自身免疫性肝炎CD4+CD25+high调节性T细胞的研究.中华实验和临床病毒学杂志,2007,21(4):337-339.
[15]Lafdil F,Miller AM,Ki SH,et al.Th17 cells and their associatedcytokines inliverdiseases.CellMolImmunol,2010,7(4):250-254.
[16]Zhao L,Qiu de K,Ma X.Th17 cells:the emerging reciprocalpartner of regulatory T cells in the liver.J Dig Dis,2010,11: 126-133.
[17]鲁沛,贾继东.自身免疫性肝炎发病机制的研究进展.肝脏,2011,16(5):411-414.
[18]Czaja AJ.Autoimmune liver disease.Curr Opin Gastroenterol,2007,23(3):255-262.
[19]顾珺,沈朝斌,王裕发.干扰素调节因子4对淋巴细胞调控研究进展,国际儿科学杂志,2011,38(4):410-412.
[20]Biswas PS,Bhagat G,Pernis AB.IRF4 and its regulators:evolving insights into the pathogenesis of inflammatory arthritis? Immunol Rev,2010,233(1):79-96.
(收稿:2014-07-21)
(校对:陈宗炳)
Expression of multiple myeloma oncogene 1 inplasma cells and plasma cell precursors in patients with autoimmunehepatitis
Jiang Lilin,Lu Zhonghua,Gu Juan,et al.Department of Pathology,FifthPeople's Hospital,Wuxi 214005,Jiangsu Province,China
Feng Yizhong,E-mail:yizhongvon@163.com
Autoimmune hepatitis;Hepatitis B;Multiple myeloma oncogene 1;Immunohistochemistry
10.3969/j.issn.1672-5069.2014.06.019
214005江苏省无锡市第五人民医院病理科(蒋丽琳,陆忠华,顾娟,冯云霞,陈宏);苏州大学附属第二医院病理科(冯一中)
蒋丽琳,女,病理科医师。主要从事肝脏病理学诊断研究。E-mail:shiqiloujj@163.com
冯一中,E-mail:yizhongvon@163.com

