猪链球菌的分型鉴定及其体外形成生物被膜的研究
周永辉,王淑杰,黄全勇,陈俭清,李艳华
(1.东北农业大学动物医学学院,黑龙江 哈尔滨150030;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江 哈尔滨150001)
猪链球菌(Streptococcussuis,S.suis)已成为我国当前引起人兽共患病的一种重要的病原菌,可引起人畜的急性、热性传染病,会使人出现脑膜炎、关节炎、持久性听力缺失,严重者可导致中毒休克综合征并引起死亡。根据猪链球菌的荚膜多糖抗原可将其分为35个血清型,其中能引起人和动物发病的致病性猪链球菌血清型主要是1型、2型、7型和9型等。(Biofilm,B F)是细菌产生的多聚复合物基质将自身包绕,粘附于无活性物体或活体表面,形成的有一定结构的细菌群体;生物被膜内细菌容易对抗生素产生广泛的耐药性,造成感染难以治愈,反复发作[1]。国内学者证明,猪链球菌在体外可以形成生物被膜[2-3]。本试验对13株从病料中分离出的猪链球菌进行分型鉴定,并对其生物被膜能力进行测定及形态观察,为研究其致病性及生物被膜研究提供物质基础。
1 材料与方法
1.1 菌株由中国农业科学院哈尔滨兽医研究所提供。THB培养基(青岛高科园海博生物技术有限公司)。试剂:pH值7.4磷酸盐缓冲溶液、结晶紫、甲醇、冰乙酸、犊牛血清、Taq DNA聚合酶(购自TaKaRa公司);PCR引物由上海生工生物工程技术服务有限公司合成。材料:卡尔加里生物膜装置、96孔细胞培养板。检测仪器:酶标仪(SN239591,美国Epoch)、扫描电镜(S-3400N,日本)、PCR仪(S1000TMThermal Cycler,美国)。
1.2 试验菌株培养及表型特征观察 首先将猪链球菌菌株于无菌条件下在THB琼脂平板上传代II代进行纯化分离,然后从THB琼脂平板上挑取单个菌落,接种于无菌THB液体试管中,37℃恒温培养箱中培养16 h后,取适量菌液稀释进行革兰染色,显微镜下观察。
1.3 生化试验 纯培养后的细菌进行甘露醇、山梨醇、菊糖、棉子糖和蜜二糖发酵试验,马尿酸盐试验,精氨酸和透明质酸酶水解试验,6.2%NaCl生长试验等。结果参照文献[4]的介绍进行判定。
1.4 猪链球菌的PCR鉴定及分型 猪链球菌鉴定引物及血清1型2型7型和9型猪链球菌的分型引物由中国农业科学院哈尔滨兽医研究所设计,并由上海生工生物工程技术服务有限公司合成。用常规方法对细菌DNA进行小量制备。常规PCR反应,之后用1%琼脂糖凝胶电泳观察结果。
1.5 生物被膜的培养及形成能力测定 按照1.2方法培养细菌2代,比浊法将菌液浓度先调整为0.5麦氏管悬液(1.0×108CFU/mL),再用THB液体培养基稀释,使菌液浓度为1×106CFU/mL。每孔200μL菌液加到卡尔加里装置底部板内,只含THB液体培养基的孔为阴性对照组,边孔加生理盐水为空白对照,37℃,45 r/min摇床上培养。参照Stepanovic[5]的方法测定生物被膜的形成能力。PBS清洗3次,固定,染色,测OD595值。
1.6 S.suis生物被膜的形态学观察 首先从卡尔加里生物被膜装置上取下形成生物被膜的桩钉,并使用灭菌PBS洗涤3次以去除游离菌,用戊二醛固定,脱水处理,用冷冻干燥仪对样品进行干燥4 h。样品表面在真空条件下镀一层厚100A的金属膜,SEM下观察。
1.7 统计学处理 采用SPSS 18.0软件对相关数据进行统计分析,结果用均值±标准差表示,统计资料的比较采用单因素方差分析,P<0.05有统计学意义。
2 结果与分析
2.1 S.suis菌落及染色结果 细菌在未加犊牛血清的THB培养基平板上菌落为微小且透明,在加入血清的THB培养及平板上呈中等大小、光滑圆润不透明。在显微镜下可看到细菌呈蓝紫色长链状。
2.2 生化试验 13株菌株在菊糖、棉子糖和蜜二糖试验中呈阳性,甘露醇和山梨醇中为阴性,马尿酸盐中为阳性,精氨酸中为阳性,透明质酸酶试验为阴性,在6.2%NaCl中不生长,以上生化结果符合猪链球菌生化指标。
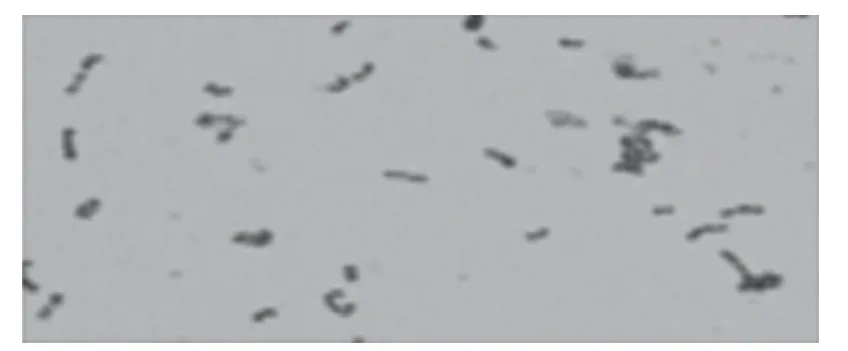
图1 猪链球菌显微镜下形态 (1 000×)
2.3 猪链球菌PCR鉴定及分型结果 13株菌扩增均得到689 bp的gdh目的基因(图2A)。其中1型引物扩增出约441 bp的片段,1号菌为1型猪链球菌(图2B);其中2型引物扩增出约675 bp的片段,11号、12号菌为2型猪链球菌(图2C);其中7型引物扩增出约335 bp的片段,2号、10号菌为7型猪链球菌(图2D);其中9型引物扩增出约388 bp的片段,3、5、6、7号菌为9型猪链球菌(图2E)。
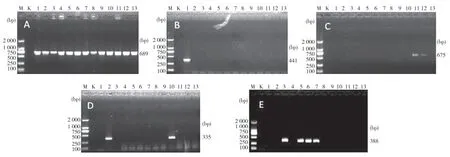
图2(A-E)猪链球菌PCR扩增结果
2.4 生物被膜的培养及形成能力测定结果 参照Stepanovic[5]的标准,13株猪链球菌均可形成生物被膜,1号、2号、3号、4号、7号、9号、10号、12号、13号菌OD595数值介于阴性对照组OD595(0.203±0.016)值的1倍到2倍之间,差异显著(P<0.05),形成生物被膜能力较弱[5];5号、6号、8号、11号菌OD595数值大于2倍阴性对照组OD595数值,但小于4倍阴性对照组OD595数值(0.203±0.016),差异显著(P<0.01),形成生物被膜能力中等[5]。
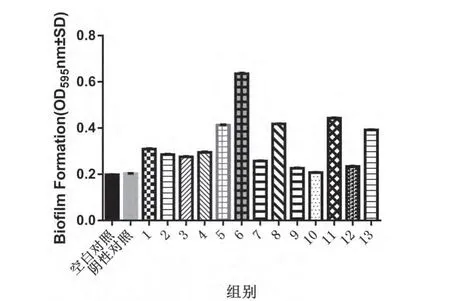
图3 猪链球菌形成生物被膜测定结果(n=16,±SD)
2.5 S.suis生物被膜的形态学观察 通过扫描电镜观察了生物被膜的形态学,结果见图4。细菌镶嵌于生物被膜中,细菌周围有厚厚的黏液层。这些外观形态表明细菌形成了生物被膜,且形成生物被膜可从外观观察到有的形成生物被膜致密,有的则稀疏。

图4 S.suis生物被膜作用的形态学观察 (5μm)
3 讨论
猪链球菌病作为集约化猪群的主要传染病之一,受到越来越多养猪业者的重视[6]。猪链球菌按照荚膜抗原的差异可分为35个血清型(1~34,1/2)[7]。其中1型、2型、7型、9型是主要流行的致病血清型。
据报道猪链球菌的gdh基因具有保守性[8-9],因此此次设计引物特异性的鉴定出猪链球菌,本试验对分离到的13株猪链球菌进行了致病性血清型鉴定,并成功鉴定出了1型1株,2型2株,7型2株,9型4株,为后续研究其毒力因子及其他特性做基础。对13株猪链球菌进行生物被膜培养,结果13株全部能形成生物被膜,根据猪链球菌生物被膜的形成能力判定标准[10]:临界值(OD c)约为阴性对照。当OD≤OD c时,判定细菌无生物被膜形成能力;当OD c<OD≤2×OD c时,判定细菌生物被膜形成能力较弱;当2×OD c<OD≤4×OD c时,判定细菌生物被膜形成能力中等;当4×OD c<OD值时,判定细菌生物被膜形成能力强。根据判定标准形成生物被膜能力1号、2号、3号、4号、7号、9号、10号、12号、13号菌较弱,5号、6号、8号、11号菌中等,这些结果可能与菌体自身毒力基因及QS系统的调节有关[11]。生物被膜危害巨大,可造成细菌强力耐药性并且造成交叉感染,难于治理,所以亟待对其更深一步研究,找出对策对其进行清除治理。
[1] Grenier D,Grignon L,Gottschalk M.Characterisation of biofilm formation by a Streptococcus suismeningitis isolate[J].The Veterinary Journal,2009,179(2):292-295.
[2]汪洋.猪链球菌生物被膜形成机理与研究[D].南京:南京农业大学,2011.
[3]魏子贡.猪链球菌流行病学及其生物被膜形成机理研究[D].武汉:华中农业大学,2010.
[4]李一经.兽医微生物学[M].北京:高等教育出版社,2011.
[5] Stepanovic S,Vukovic D,Dakic I,et al.Amodifiedmicrotiter-plate test for quantification of staphylococcal biofilm formation[J].JMicrobiol Methods,2000,40(2):175-179.
[6]兰信海,冯永胜,王彬,等.青岛地区猪链球菌病的流行病学调查[J].山东畜牧兽医,2008,29(1):26-27.
[7] Staats JJ,Feder I,Okwumabua O,et al.Streptococcus suis:past and present[J].Vet Res Commun,1997,21(6):381-407.
[8] Okwumabua O,Persaud JS,Reddy PG.Cloning and characterization of the gene encoding the glutamate dehydrogenase of Streptococcus suis serotype 2[J].Clin Diagn Lab Immunol,2001,8(2):251-257.
[9] Okwumabua O,OcConnor M,Shull E.A polymerasechain reaction(PCR)assay specific for Streptococcus suis based on the gene encoding the glutamate dehydrogenase[J].FEMSMicrobiol Lett,2003,218(1):79-84.
[10]Stepanovies,Vukovied,Hola V,et al.Quantification of biofilm in microtiter plates:overview of testing conditions and practical reconmmendations for assessment of biofilm production by Staphylococci[J].APMIC,2007,115(8):891-899.
[11]Calefe M W,Shelton JG,McCubrey J A,et al.Solubility and Bioactivity of the Pseudomonas Quinolone Singal Are Increased by a Pseudomonas aeruginosa-Produced Surfactant[J].Infect Immun,2005,73(2):878-882.

