2013年中日友好医院临床分离细菌耐药性分析
邵 茁,贾红兵,王 靖,杨 辉,部小霞
(中日友好医院 检验科,北京 100029)
近年来随着临床广泛应用抗菌药物,细菌的耐药性日益突出,已经成为公共卫生领域的严重问题。为了正确及时掌握医院细菌耐药性的变迁,为临床提供合理用药的参考,现将医院2013年分离病原菌株分布和耐药性进行分析总结,结果如下。
1 材料与方法
1.1 菌株来源
菌株为2013年1月~12月中日友好医院临床送检的28123份标本。
1.2 主要试剂及仪器
中国兰琼脂、M-H琼脂、木糖-赖氨酸-脱氧胆 酸 琼 脂 (xylose-lysine-desoxycholate agar,XLD)、环丝氨酸-头孢甲氧霉素-果糖培养基(cycloserine-cefoxitin-fructose agar,CCFA)均购自英国Oxoid公司;血平板、加万古霉素巧克力平板培养基购自北京赛默飞公司;BacT/Alert3D全自动血培养仪和VITRK-2全自动细菌鉴定药敏仪及其试剂(法国生物梅里埃公司)。
1.3 质控菌株
大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853、金黄色葡萄球菌ATCC29213来自卫生部临床检验中心;肺炎链球菌ATCC49619、阴沟肠杆菌ATCC700323、铅黄肠球菌ATCC700327由法国生物梅里埃公司提供。
1.4 方法
1.4.1 细菌培养和传代培养
疑似血流感染患者血液标本注入需氧和厌氧血培养瓶,成人为8~10ml/瓶,儿童为4~5ml/瓶(仅做需氧血培养),使用BacT/Alert3D全自动血培养仪进行动态监测。血液标本经血培养仪培养阳性后转种平板,革兰氏染色镜检。
疑似呼吸系统感染患者痰液等标本培养,接种于血平板、中国兰平板和加万古霉素巧克力平板培养基,放置于含5%二氧化碳、35℃培养箱中培养。
疑似泌尿系统感染患者尿液标本培养,接种于血平板(取1μl标本密涂,用于菌量计数)和中国兰平板,放置于普通环境、35℃培养箱中培养。
疑似消化系统感染患者便标本培养,依据检验申请单目标细菌培养分别选择血平板、中国兰平板、XLD平板、CCFA平板等一种或几种培养基,放置于普通环境或厌氧环境、35℃培养箱中培养。
疑似生殖系统感染或其他无菌部位感染患者标本培养,选择血平板、中国兰平板或淋病奈瑟菌选择平板或巧克力平板,放置于含5%二氧化碳、35℃培养箱中培养。
1.4.2 鉴定及药敏试验
VITRK-2全自动细菌鉴定药敏仪进行菌种鉴定和药物敏感试验,革兰氏阳性球菌选用GP鉴定卡、P67或P68药敏卡;革兰氏阴性杆菌选用GN鉴定卡、N09或N16药敏卡。结果判断参考CLSI 2013 M100-S23[1]。

表1 主要分离菌株及患者标本分布(按分离菌株数量排序)
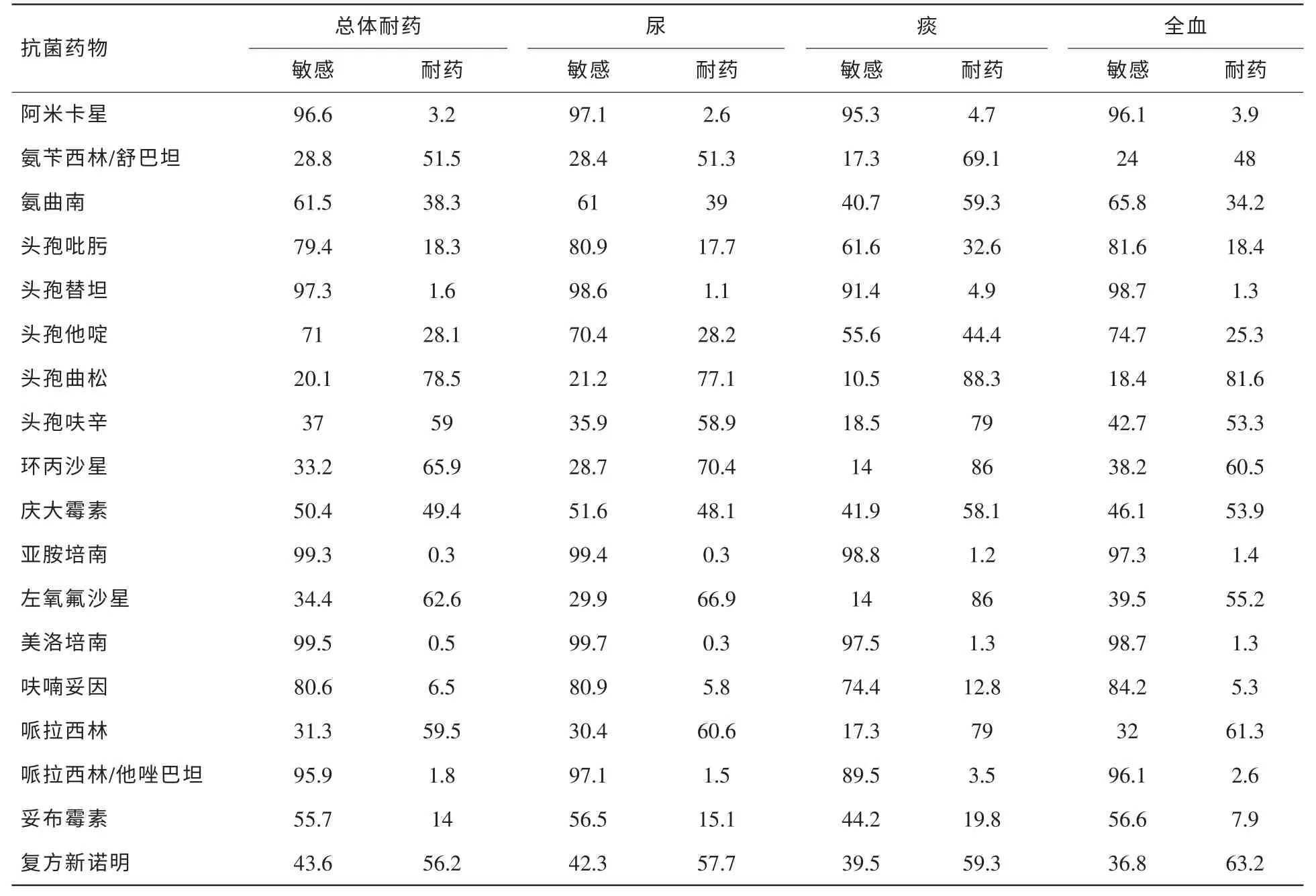
表2 大肠埃希菌不同分离部位的体外药敏结果抗菌药物 (%)

表3 鲍曼不动杆菌的体外药敏结果 (%)
1.4.3 头孢西丁筛选试验
VITRK-2全自动细菌鉴定药敏仪配套药敏卡P67可进行头孢西丁筛选试验,检测MRSA和MRCNS,结果判断参考CLSI 2013 M100-S23[1]。
1.5 统计学方法
数据采用WHONET 5.6软件进行统计分析。
2 结果
2.1 主要分离菌株及患者标本分布
按患者首次分离非重复菌株统计,2013年1月~12月医院总共分离3977株菌,主要分离菌株及其排名前4位的分离部位见表1。
2.2 主要分离菌株的耐药率
2.2.1 大肠埃希菌药敏分析
(患者首次分离非重复菌株为统计对象)具体见表2。其中分离到5株碳青霉烯酶类药物耐药的大肠埃希菌(0.9%,5/567),3株分离自痰,1株分离自尿、1株分离自胸水。
2.2.2 鲍曼不动杆菌药敏分析
由于鲍曼不动杆菌主要分离于痰标本(86.3%,315/365),其他标本来源的菌株所占比例小,因此采用总体耐药率进行分析,具体见表3。
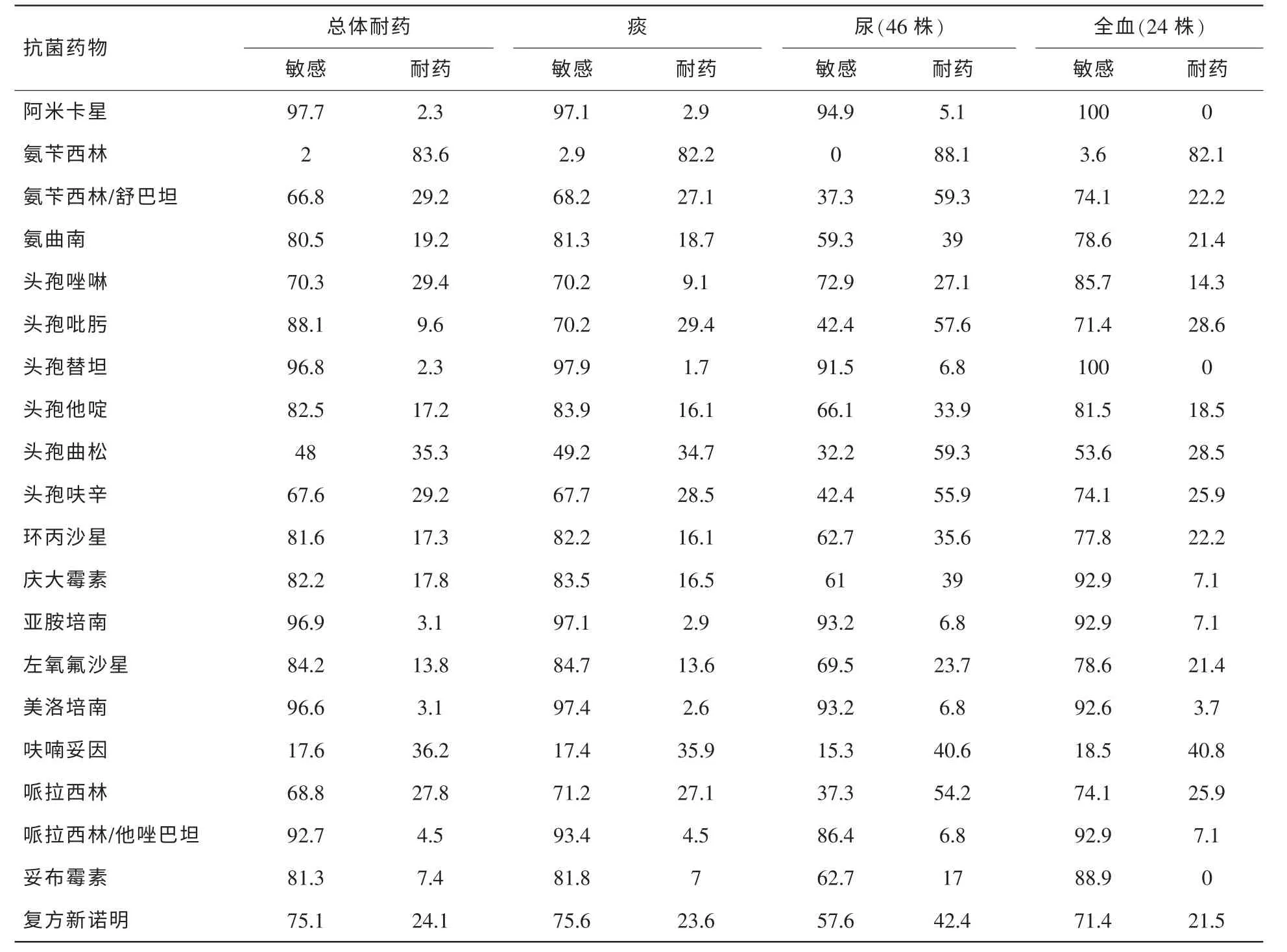
表4 肺炎克雷伯菌不同分离部位的体外药敏结果 (%)
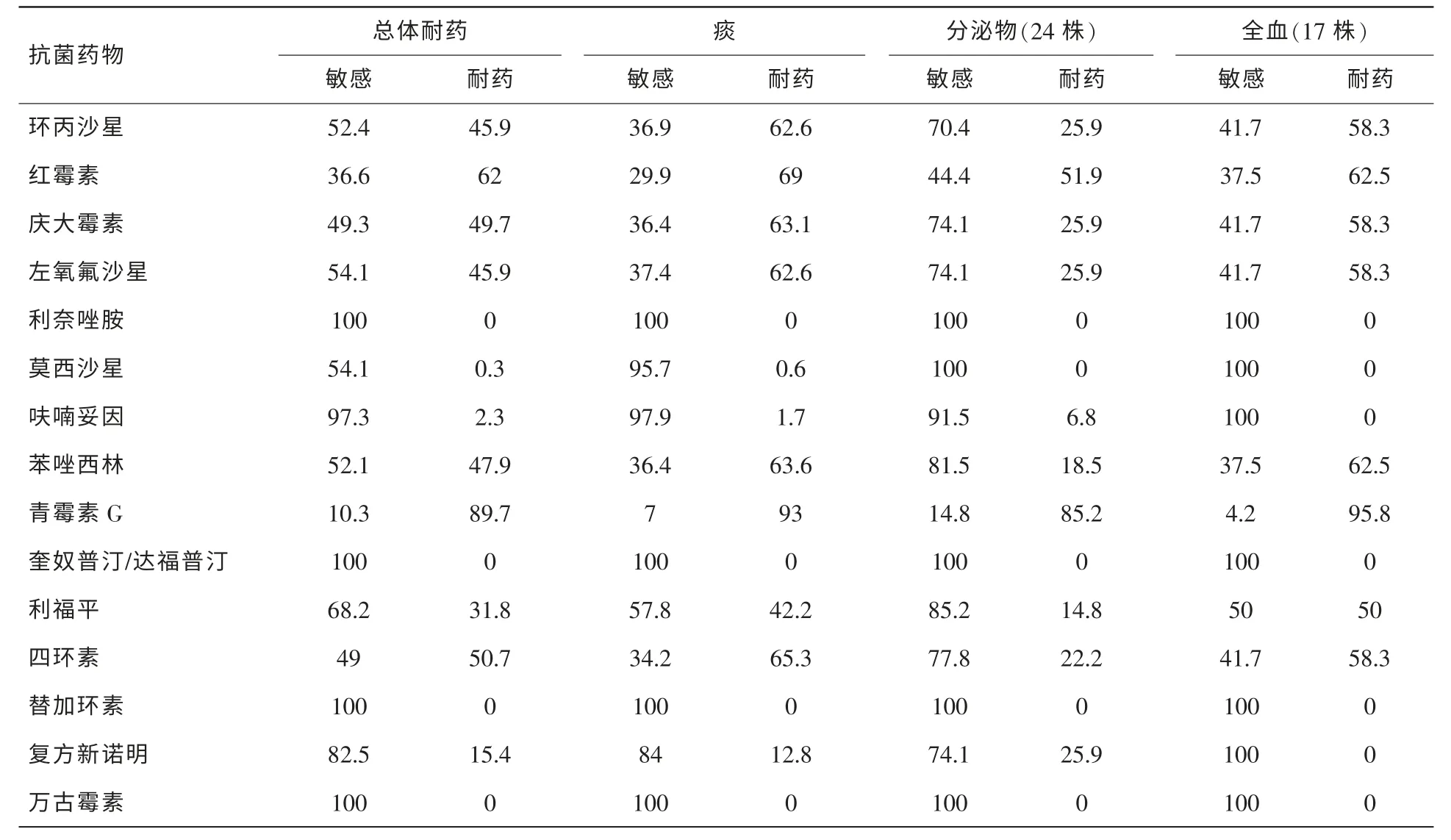
表5 金黄色葡萄球菌不同分离部位的体外药敏结果 (%)
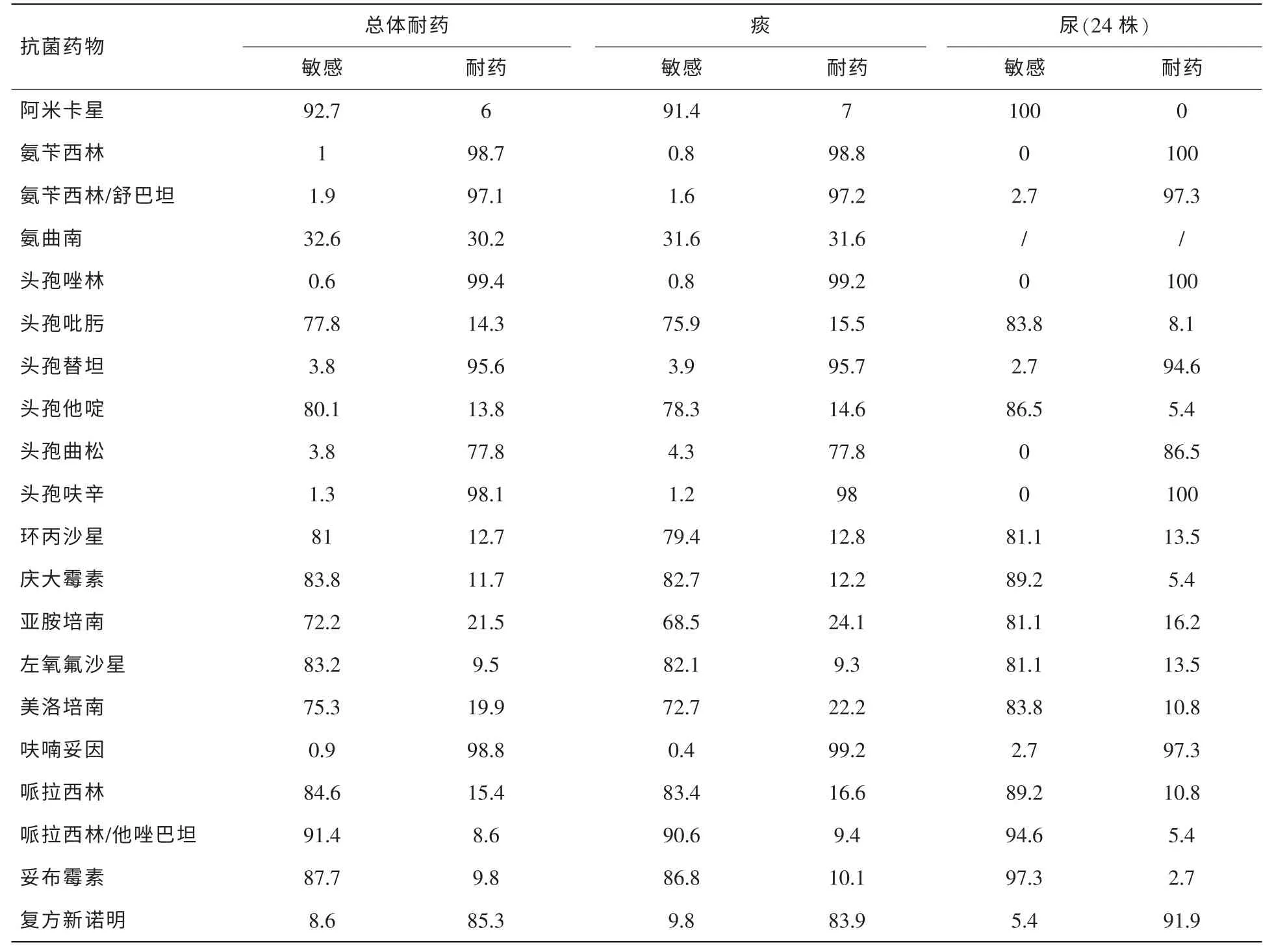
表6 铜绿假单胞菌不同分离部位的体外药敏结果 (%)
2.2.3 肺炎克雷伯菌药敏分析
具体见表4。其中分离到11株碳青霉烯酶类药物耐药的肺炎克雷伯菌(3.1%,11/354),5株分离自痰,3株分离自尿、另外3株分别分离自全血、胸水和伤口分泌物。
2.2.4 金黄色葡萄球菌药敏分析
表5示,金黄色葡萄球菌共分离292株,其中MARS为146株(50.0%);凝固酶阴性葡萄球菌共分离301株,其中MRCNS为237株(78.7%)。未发现耐万古霉素的葡萄球菌。
2.2.5 肠球菌属药敏分析
粪肠球菌共分离到183株,其中耐万古霉素粪肠球菌1株(0.6%,1/183),分离自尿;屎肠球菌共分离到140株,其中耐万古霉素屎肠球菌29株(20.7%,29/140),8株分离自尿,8株分离自痰、5株分离自全血,11株分离自其他部位。
2.2.6 铜绿假单胞菌药敏分析(见表6)
3 讨论
本研究对医院2013年所分离3977株细菌分析表明,鲍曼不动杆菌、铜绿假单胞菌、大肠埃希菌、肺炎克雷伯菌和金黄色葡萄球菌是目前主要院内感染致病菌。分离自痰标本的主要病原菌依次为鲍曼不动杆菌、铜绿假单胞菌、肺炎克雷伯菌、金黄色葡萄球菌、嗜麦芽窄食单胞菌、大肠埃希菌、阴沟肠杆菌,约占所有痰分离菌株量的80%,其是呼吸道感染主要的定植菌或致病菌;分离自尿标本的主要病原菌依次为大肠埃希菌、粪肠球菌、屎肠球菌、肺炎克雷伯菌、铜绿假单胞菌、奇异变形杆菌,其中大肠埃希菌约占所有尿分离菌株量的40%;分离自血液标本的主要病原菌依次为凝固酶阴性葡萄球菌、大肠埃希菌、肺炎克雷伯菌、金黄色葡萄球菌、屎肠球菌、鲍曼不动杆菌、粪肠球菌,其中凝固酶阴性葡萄球菌分离率高多源于医护人员医疗操作污染,大肠埃希菌是引起医院血流感染的第一位病原菌。本研究提示,临床医生可根据各种细菌标本分布部位的不同,针对患者的感染部位更及时合理的经验性选取抗生素治疗。
2013年医院分离的金黄色葡萄球菌中MRSA的检出率为50.0%,凝固酶阴性葡萄球菌中MRCNS检出率78.7%,均与CHINET2012报告结果接近[2]。金黄色葡萄球菌中未发现万古霉素耐药株,肠球菌属中耐万古霉素肠屎肠球菌占20.7%;耐万古霉素粪肠球菌占0.6%,发现少量利奈唑胺耐药屎肠球菌(0.7%)。
近年来由于头孢菌素的不规范使用及超广谱β-内酰胺酶的产生,肠杆菌科细菌的耐药性逐年上升,对一代、二代头孢菌素耐药性高,第三代头孢菌素越来越多的被医生所选择,而医院大肠埃希菌、肺炎克雷伯菌对三代头孢菌素类抗生素头孢曲松的耐药率由2007年的49.2%、21.7%上升至2013年的78.5%、35.3%,这又导致医生选择抗菌药物的压力越来越大。监测结果显示,耐碳青霉烯类肠杆菌科细菌(carbapenemase-resistant Enterobacteriaceae,CRE)已在我院出现且发生率逐年增高,其中碳青霉烯类耐药肺炎克雷伯菌比2012年(共分离5株)增长了120%。本年度发现的CRE菌株主要分离自痰 (47.1%)、尿液(29.4%)、胸水(11.8%)等部位,多出现在重症监护病房(47.1%),普通外科(17.6%)及急诊(11.8%),且多集中在病情危重或手术创伤患者。引起碳青霉烯类耐药的主要原因包括产碳青霉烯酶、膜孔蛋白缺失或突变合并AmpC酶或ESBLs酶的高表达以及外排泵[3]。其中产碳青霉烯酶是CRE最主要的耐药机制。随着碳氢霉烯类抗菌药物广泛使用,碳青霉烯酶耐药基因在肠杆菌科细菌中呈现出蔓延趋势。CRE在医院可能导致患者临床治疗无效、延长住院时间及死亡率增高等一系列严重后果。研究表明,多黏菌素B、替加环素、磷霉素等对CRE菌株有良好抗菌活性[4],推荐联合疗法用于治疗CRE感染。目前上述药物并未列入医院革兰氏阴性菌常规耐药性监测范畴,因此对于CRE有必要加做上述药物的药敏试验,指导临床更合理用药。
2013年度医院鲍曼不动杆菌对亚胺培南和美洛培南的耐药率分别57.2%和72.4%,与2012年度监测结果基本相同,亦与CHINET2012报告结果接近[2]。多重耐药或全耐药鲍曼不动杆菌给临床感染的治疗带来严峻的挑战。替加环素治疗多重耐药革兰阴性菌感染特别是鲍曼不动杆菌疗效较好,本研究为77.7%敏感,17%中介,5.3%耐药,说明鲍曼不动杆菌已经开始出现部分替加环素的耐药株。研究表明鲍曼不动杆菌对替加环素耐药与AdeABC外排泵系统有关[5]。有学者指出临床上多重耐药鲍曼不动杆菌引起的严重感染应使用替加环素联合用药[6,7]。
2013年度医院共分离出23株艰难梭菌(分离率14.3%,23/161),主要分离自中医呼吸科(43.5%),急诊科(17.4%)等。艰难梭菌感染是导致医院内抗生素相关性腹泻的最重要因素之一,随着抗生素的广泛使用,艰难梭菌感染的发生率和病死率日渐升高。诊断艰难梭菌感染除了结合患者腹泻的临床症状,在艰难梭菌培养阳性的同时应配合检测艰难梭菌毒素[8]。进一步研究表明,医院2013年艰难梭菌在中医呼吸科存在小范围的院内感染流行,因此对于艰难梭菌感染的控制除了要合理应用抗生素,还要注重环境消毒及医护人员的手卫生。
[1] CLSI.Performance standards for antimicrobial susceptibility testing;twentieth informational supplement[S].M100-S23,2013.
[2] 汪复,朱德妹.2012年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2013,13(5):321-330.
[3] 吴森泉,邱晨.碳青霉烯类耐药肠杆菌科细菌研究现状[J].广东医学,2013,34(17):2718-2721.
[4] Van DuinDV,Kaye RS,Neuner EA,et al.Carbapenem resistant Entero-bacteriaceae:a review of treatment and outcomes[J].Diagn Microbiol Infect Dis,2013,75(2):115-120.
[5] Coyne S,Guigon G,Courvalin P,et al.Screening and quantification of the expression of antibiotic resistance genes in Acinetobacter baumannii with a microarray[J].Antimicrob Agents Chemother,2010,54(1):333-340.
[6] Lee K,Yong D,Jeong SH,et al.Multidrug-resistant Acinetobacter spp:increasingly problematic nosocomial pathogens[J].Yonsei Med J,2011,52(6):879-891.
[7] 沈丹,薛婧,张蕊,等.某三甲医院鲍曼不动杆菌耐药性分析[J].武警医学,2013,24(10):869-871.
[8] Cohen SH,Gerding DN,Johnson S,et al.Clinical practice guidelines for Clostridium difficile infection in adults:2010 update by the society for healthcare epidemiology of America(SHEA)and the infectious diseases society of America(IDSA)[J].Infect Control Hosp Epidemiol,2010,31(5):431-455.

