附子灵和尼奥宁的药理研究进展
李燕,李芸霞,龚小红,张若琪,彭成
·综述进展·
附子灵和尼奥宁的药理研究进展
李燕,李芸霞,龚小红,张若琪,彭成
通过分析总结国内外有关附子灵和尼奥宁的药理研究文献,发现两者的药理研究主要集中在心血管系统、镇痛、局部麻醉、抗肿瘤、杀虫等方面,且两者均欠缺全面系统的药理学研究。
中药药理学;附子灵;尼奥宁;药理研究
附子为毛茛科植物乌头(Aconitum carmichaeli Debx.) 的子根加工品,被2010 版《中华人民共和国药典》收载;其味辛、甘,性大热,有毒,归心、肾、脾经;具有回阳救逆、补火助阳、逐风寒湿邪的功效,常用于亡阳虚脱、肢冷脉微、阳痿、宫冷、心腹冷痛等症[1],为回阳救逆之要药。其对机体具有抗炎、祛风湿、麻醉止痛、免疫抑制等药理作用[2,3],对心血管系统则表现为强心、扩血管、降血压等作用[4]。其化学成分主要为生物碱,在国内药用的51种乌头属植物中,二萜生物碱被认为是其活性成分之一,也具有镇痛、消炎、局部麻醉、强心等作用[5]。但双酯型二萜生物碱如乌头碱、中乌头碱和次乌头碱一般毒性较大,是其引起中毒的主要原因,一般须经炮制方能使用[6]。
附子灵(fuziline,figure 1)、尼奥宁(neoline,figure 1)是附子中二萜生物碱的主要活性成分,毒性很小。1982年陈泗英等首次从大理栽培的附子中分离得到两者并对两者做了结构鉴定,结果表明,附子灵的结构中有一个氮原子,四个羟基,经鉴定为15-a-OH neoline,两者均属于脂溶性二萜生物碱;同时,陈泗英等也发现附子灵在附子的药理药效中有重要的作用[7]。截至目前,国内外对两者的研究主要集中在提取分离和化学结构鉴定方面;药理方面的研究还较少,现将其进展情况概述如下。
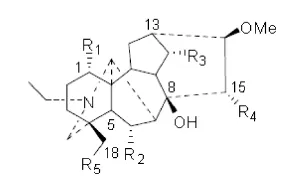
fgure 1. Structures of Fuziline and Neoline
1 对心血管系统的作用
1.1 强心、抗心肌缺血和抗休克
Xiong等[8]通过MTT法研究从附子中提取的几种化合物对戊巴比妥钠诱导的原代培养的乳鼠心肌损伤的保护活动。结果显示,在体外实验中,几种化合物能显著抑制戊巴比妥钠的诱导作用,在浓度为10 μM,1 μM,0.1 μM时,附子灵、尼奥宁显示活性,明显恢复心肌细胞的跳动节奏,增加心肌细胞活力和存活率。
徐墩海等[9]采用附子提取组分进行了相应的离体工作心脏和整体抗心衰试验;结果表明,含有附子灵、尼奥宁等的脂肪酸醋型生物碱和苯甲酞类生物碱的提取组分有抗失血性休克作用和微弱的正性肌力作用。
李晗等[10]前期定性鉴别和确定了参附注射液中含有一定量的附子灵和尼奥宁;后期采用Cocktail体外孵育法结合液质联用技术对SD大鼠肝中1A2、2B、2C和3A各亚酶的酶活性进行测定,并利用RTPCR技术对上述亚型的mRNA水平表达进行检测;结果显示,参附注射液组对1A2和3A酶活性具有抑制作用,与酶活性水平具有一致性,且在mRNA水平上显著诱导2B和2C11的基因表达。Zheng等[11]报道,参附注射液对大鼠心肌缺血再灌注损伤具有保护作用。Yang等[12]报道,参附注射液可改善休克症状。由此推测,附子灵、尼奥宁可能具有抗心肌缺血和抗休克的作用。
1.2 抗心律失常
尼奥宁(NE)是不含酯基的二萜类生物碱,与乌头宁(乌头原碱,aconine)的结构类似,相关资料证明乌头宁有对抗乌头碱(AC)引起的心律失常的作用;其与拉巴乌头碱(lappaconitine,LA)均具有镇痛和局部麻醉等相似作用,且LA可对抗乌头碱诱发的大鼠心律失常;给麻醉大鼠恒速iv NE时,小剂量NE可引起大鼠心电图(ECG)的心率(HR)减慢、P-R间期延长等改变,与LA对麻醉大鼠ECG的影响颇为相似[13~16]。由此推测,尼奥宁可能具有抗心律失常的作用。
1.3 对血管和血压的作用
杨秀伟[17]研究报道,附子灵等化合物具有扩张血管、降低血压、镇痛等作用,为附子中的主要活性成分。
2 镇痛、局部麻醉
研究表明,已知乌头属的几个品种中均含有NE,且NE具有镇痛和局部麻醉作用,给小鼠iv NE,LD50为150 mg﹒kg-1,表明NE毒性很小[13]。
Taki M等[18]从乌头花蕾中分得了尼奥宁的一种衍生物(即8-O-肉桂酰尼奥宁),并进行了急性毒性试验及采用小鼠压尾法评价其镇痛作用;结果显示,其毒性是中乌头碱的1/30,其皮下注射可剂量相关地提高痛阈值,即其毒性大大降低且具有一定的镇痛作用。
3 抗肿瘤
Z Naturforsch C[19]采用从乌头属等植物中分离的去甲二萜生物碱对肿瘤细胞株CT26(小鼠结肠腺癌)、SW480(人结肠腺癌)、HeLa(人类子宫颈腺癌细胞)、SkMel259(人类黑色素瘤)、SkMel28(人恶性黑色素瘤)和非肿瘤细胞系CHO(中国仓鼠卵巢细胞)进行了体外细胞毒性实验;结果显示,尼奥宁(5)、pubescenine(15)、14-deacetylajadine(25)、browniine lycoctonine(26)和dehydrotakaosamine(34)等化合物具有选择性杀伤癌细胞与非癌性细胞的作用,以及有不可逆影响SW480等肿瘤细胞系的效果,同时,其效果可能涉及到抑制ATP的产生。
4 杀虫
陈亚玲等[20]从江油生附子中提取分离得到5种二萜生物碱,然后以普筛浓度500 mg﹒L-1对稻飞虱、粘虫、红蜘蛛、苜蓿蚜进行杀虫活性测试。结果显示,附子灵等对稻飞虱和菖蓿蚜均有明显的杀灭作用,附子灵和总二萜生物碱等对稻飞虱的杀灭活性达到50%;附子灵对苜蓿蚜的杀灭活性也达到了50%[21],其效果虽较敌敌畏和丁硫克百威差,但可同时作用于这两种害虫,显示出一定的抗虫广谱性。因此,可以推测附子灵可能是二萜类生物碱或附子的杀虫作用的主要活性成分且杀虫作用较强。
同时,附子灵的杀虫作用与其溶剂的种类和效应也具有一定的相关性。万里翔[22]采用附子二萜生物碱进行了杀虫活性测试和胃毒活性测定,结果显示,以丙酮、丙酮甲醇混合液和DMSO为溶剂时,附子灵等对3龄黏虫24h死亡率最高为16.7%;以DMSO作为溶剂时,其触杀效果较好;但其对黏虫的胃毒活性甚微。
5 其他作用
二萜类生物碱还具有免疫调节、抗炎和抑制血小板活化因子(PAF)诱导的血小板聚集等作用[23],而附子灵和尼奥宁又作为其主要成分。因此,可以推测两者可能也具有免疫调节、抗炎和抗PAF活性等药理作用。
附子灵在药动学方面也有一定的研究,沈燕等[24]通过大鼠整体实验法研究了参附汤体内代谢情况,结果表明,附子灵在体内是以原形药物而非代谢产物的形式被吸收而发挥药效的。Sun等[25]采用亲水作用液相色谱耦合电喷雾质谱(HILIC-MS)法进行了附子灵在大鼠中的药代动力学研究;结果显示,附子灵用于静脉内给药的平均C5min为582.2±229.0 ng﹒mL-1、口服给药的Cmax值为72.1±28.9 ng﹒mL-1,相应的平均Tmax值为2.8±0.7 h,对SD大鼠口服给药4mg﹒kg-1附子灵后,其绝对生物利用度为21.1±7.0%、清除率在1745.6±818.1 mL/kg/h、平均血浆消除半衰期约为6.3±2.6 h。
由此可见,目前附子灵、尼奥宁的药理研究主要集中在心血管系统、镇痛、局部麻醉、抗肿瘤以及杀虫等方面;但两者均欠缺全面系统的药理学研究,希望在今后的研究中有所深入。
[1] 国家药典委员会.中华人民共和国药典一部[S].北京:中国医药科技出版社,2010:132.
[2] J.R.Hanson.For an overview of Wagner-Meerweinrear rangement and related reactions[J].Comprehensive Organic Synthesis,1991,3:7050.
[3] B.M.Trost.A catalytic asymmetric Wagner-Meerwein shift[J]. Am Chem.Soc,2001,123:7162.
[4] 季红.Ⅰ.宣威乌头中生物碱成分的研究Ⅱ.紫衫醇类似物的合成研究Ⅸ.去甲二萜生物碱转化合成紫杉醇类似物的研究[D].四川:四川大学,2006:1.
[5] 薛姣,杨春华,刘静涵,等.乌头属植物二萜生物碱研究进展[J].海峡药学杂志,2009,21(2):10.
[6] 熊江,古昆,谭宁华.黑顺片的二萜生物碱成分[J].然产物研究与开发,2008,20:440.
[7] 陈泗英,刘玉青,王济承.云南栽培川乌的生物碱成分[J].云南植物研究,1982,4(1):73.
[8] Xiong L, Peng C, Xie XF, et al.Alkaloids Isolated from the Lateral Root of Aconitum carmichaelii[J].Molecules,2012,17:9939.
[9] 徐墩海,宋风瑞,赵洪峰,等.人参四逆汤成分的研究[J].中国医药学报,2002,17(7):406.
[10] 李晗,王宇光,马增春,等.基于临床用量的参附注射液对大鼠肝脏主要药物代谢酶的影响[J].药学学报,2013,48(5): 728.
[11] Zheng SY, Xu JG, Zhao ZZ. The protective effect of Shenfu injection on myocardium against ischemia reperfusion injury in rats[J].Chin J Integr Med, 2004, 24: 541.
[12] Yang FJ, Zheng YS, Deng WL, et al. Effect of Shenfu injection on microcirculation[J].J Biomed Eng, 2003, 20: 91.
[13] 陈迪华.二萜类生物碱的生理活性及其药用前景[J].中草药,1984,15(4):39.
[14] 唐希灿,朱梅英,冯洁,等.刺乌头碱氢溴酸盐的药理作用研究[J].药学学报,1993,18(8):579.
[15] 王培德,张慧灵,刘和利,等.尼奥宁与拉巴乌头碱对乌头碱诱发大鼠心律失常的影响[J].包头医学院学报,1997,13(3):1.
[16] 王培德,马学民,张慧灵,等.刺乌头碱对麻醉大鼠心电图的影响及其抗实验性心律失常作用[J].中国药理学通报, 1997,13(3):263.
[17] 杨秀伟.生物碱[M].北京:化学工业出版社,2005:357.
[18] Taki M,Niitu K,Omiya Y,et al.8-O-Cinnamoylneoline,a new alkaloid form the fower buds of Aconitum carmichaeli and its toxic and analgesic activities[J].Planta Med,2003,69(9):800.
[19] de Inés C,Reina M,Gavín JA,et al. In vitro cytotoxicity of norditerpenoid alkaloids.[J].Z Naturforsch C.2006;61(1-2):11.
[20] 陈亚玲,袁小红,侯大斌.生附子中二萜生物碱化学成分及其杀虫活性的研究[J].安徽农业科学,2009,37(10):4536.
[21] 陈亚玲.二萜生物碱和其杀虫活动[D].绵阳:西南科技大学, 2009:1.
[22] 万里翔.附子主要二萜生物碱的分离和活性测试[D].绵阳:西南科技大学,2008:1.
[23] 唐长明.剑川乌头中化学成分研究及部分二萜生物碱的结构改造[D].云南:云南大学,2011:1.
[24] 沈燕,吴立军,王本祥,等. 参附汤体内代谢化学成分的初步研究[J]. 沈阳药科大学,2001,18(1): 23.
[25] Sun JG, Zhang FY, Peng Y, et al. Quantitative determination of diterpenoid alkaloid Fuziline by hydrophilic interaction liquid chromatography(HILIC)-electrospray ionization mass spectrometry and its application to pharmacokinetic study in rats[J].J Chromatography B, 2013,913-914:55.
(责任编辑:何瑶)
The pharmacological research progress of Fuziline and Neoline
LI Yan, LI Yun-xia, GONG Xiao-hong, ZHANG Ruo-qi, PENG Cheng//( Pharmacy College, Chengdu University of Traditional Chinese Medicine; The Ministry of Education Key Laboratory of Standardization of Chinese Herbal Medicine; State Key Laboratory Breeding Base of Systematic Research, Development and Utilization of Chinese Medicine Resources Co-founded by Sichuan Province and MOST, Chengdu 611137, China)
By analyzing and summarizing pharmacological research literature about Fuziline and Neoline, the pharmacological research of both drugs are found to be mainly concentrated on the cardiovascular system, analgesia, anesthesia, antitumor, insecticidal, and so on. At the same time, Fuziline and Neoline are lack of a comprehensive and systematic pharmacological research.
Pharmacology of TCM; Fuziline; Neoline; Pharmacological research
R 285.5
A
1674-926X(2014)02-019-03
国家科技支撑计划项目(2011BAI13B05),国家重点基础研究发展计划(2012CB723502),博士点新教师基金(20105132120001 ),四川省科技厅青年基金(2013JQ0018)
成都中医药大学药学院 中药材标准化教育部重点实验室中药资源系统研究与开发利用省部共建国家重点实验室培育基地,四川 成都 611137
李燕(1990-),女,研究生在读,主要从事中药物质基础以及药动学方向研究Email:993603736@qq.com
彭成(1964-),男,博士生导师,研究员,主要从事疾病动物模型与中药复方研究Email: pengchengchengdu@126.com
2013-10-08

