芦笋多糖活性炭法脱色工艺
彭友舜,韩占霞,李嘉明
(1河北科技师范学院化学工程学院,河北秦皇岛,066600;2河北省芦笋工程技术研究中心)
芦笋(Asparagusofficinalis L.),学名石刁柏,是百合科天门冬属多年生草本植物,其营养价值高于一般蔬菜水果,在国际市场上被称为“蔬菜之王”。药理学研究表明芦笋多糖对高脂血症、糖尿病、癌症等有一定疗效[1],具有较高的营养和药用价值[2~4],而且大多数活性较小,在预防疾病上优于其他化合物,具有广阔的应用前景。
植物多糖中含有色素、蛋白质等物质,对其活性造成影响,因此脱色是多糖的提取、分离、纯化及结构研究中的一个重要环节。目前多糖脱色多采用双氧水法和活性炭吸附法,如卢国勇等[5]采用过氧化氢对鱼腥草多糖脱色,杨培民等[3]利用活性炭对白花蛇舌草多糖溶液进行脱色。双氧水通过氧化色素实现脱色目的,容易造成多糖降解。活性炭(粉炭)有巨大的比表面积,对杂质的吸附能力很强,脱色成本低,效果好,且不会影响提取物的生物活性[6]。受秦皇岛长胜农业科技有限公司委托,笔者进行了单因素及均匀设计试验,对芦笋多糖活性炭脱色的最佳工艺条件进行研究,以期为芦笋多糖工业化生产脱色工艺提供依据。
1 材料与方法
1.1 材料与试剂
芦笋粗多糖,引自秦皇岛长胜农业科技有限公司芦笋生产基地;粉末活性炭,引自天津市风船化学试剂科技有限公司;牛血清蛋白CBBG250,引自西安周鼎国生物技术有限责任公司;考马斯亮蓝G-250,引自国药集团化学试剂有限公司;D-无水葡萄糖,引自中国药品生物制品检定所,批号为110833-200503;其余试剂均为分析纯。
1.2 仪器和设备
HZQ-QG恒温振荡器,哈尔滨东联电子技术开发有限公司出品;722s可见分光光度计,上海精密仪器仪表有限公司出品;FE-20精密pH酸度计,上海微川精密仪器有限公司出品;JA5003型电子天平,上海方瑞仪器有限公司出品;720060型和720110型手动单道可调式移液器,上海大龙医疗器械有限公司出品;雷磁pHS-3C型pH计,上海精密科学仪器有限公司出品;800型离心机,江苏宏凯仪器厂出品。
1.3 方法
1.3.1 芦笋粗多糖溶液的制备 称取1 g芦笋粗多糖粉末,加蒸馏水溶解定容至100 mL,即为质量浓度10 g/L的芦笋粗多糖样品溶液。
1.3.2 脱蛋白率的测定 蛋白质含量的测定采用Bradford法[7]。
质量浓度为0.10 g/L的考马斯亮蓝储备液的制备:称取0.100 g考马斯亮蓝G-250,溶于50 mL体积分数为0.95的乙醇,加入100 mL体积分数为0.85的磷酸,用蒸馏水定容至1 L,摇匀,备用。
标准曲线的绘制:精密移取 0,0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0 mL 的牛血清蛋白标准溶液,依次置于11个20 mL的具塞试管中,各加蒸馏水至1.0 mL,再分别加入质量浓度为0.10 g/L的考马斯亮蓝G-250溶液5.0 mL,充分摇匀后,静置15 min,于波长595 nm处测定溶液吸光度值。以牛血清蛋白浓度为横坐标,吸光度值为纵坐标制得蛋白质标准曲线。
样品溶液中蛋白质含量的测定:精密量取样品溶液1.0 mL,加入考马斯亮蓝储备液5.0 mL,振摇,以1.0 mL水作为空白,静置15 min后于595 nm处测定吸光度值。按(1)式计算脱蛋白率:

W1——脱蛋白率;C1——处理前溶液中的蛋白质的质量浓度;C2——处理后溶液中的蛋白质的质量浓度。
1.3.3 多糖保留率的测定 多糖的测定采用苯酚-硫酸法[8]。
质量浓度为50.0 g/L的苯酚溶液的配制:精确称取苯酚5.0 g,加入少量蒸馏水溶解,转移至100 mL容量瓶中,用蒸馏水定容后其置于棕色试剂瓶中备用。
1.0 g/L葡萄糖标准溶液的配制:准确称取105℃下干燥至恒重的标准葡萄糖0.5 g,加少量蒸馏水溶解后转移至100 mL容量瓶中,用蒸馏水定容,配得质量浓度为5.0 g/L葡萄糖母液。用移液器精密移取5.0 mL葡萄糖母液至25 mL容量瓶中,用蒸馏水定容,备用。
标准曲线的绘制:精确移取0,0.10,0.15,0.20,0.25,0.30 mL 的标准葡萄糖溶液,依次置于6 个20 mL的具塞试管中,分别加蒸馏水至1.0 mL,之后加入质量浓度为50.0 g/L的苯酚溶液1.0 mL及体积分数为0.98的浓硫酸5.0 mL,将其充分摇匀后,放入85℃水浴锅中加热20 min,取出,冷却至室温,于波长490 nm处测定溶液吸光度值。以葡萄糖浓度为横坐标,吸光度值为纵坐标,制得多糖标准曲线。
样品溶液中多糖含量的测定:为消除待测液pH值对显色的影响,测定前用稀盐酸调节粗多糖溶液pH值为6.0。精密量取样品溶液1.0 mL,加入质量浓度为50.0 g/L的苯酚溶液1.0 mL及浓硫酸5.0 mL,充分摇匀后,放入85℃水浴锅中加热20 min,取出冷却至室温。另以1.0 mL蒸馏水加质量浓度为50.0 g/L的苯酚溶液1.0 mL及浓硫酸5.0 mL同上述操作(作为空白对照),于490 nm处测定溶液吸光度值。根据标准曲线得出溶液中多糖浓度,并按(2)式计算多糖保留率:

W2——吸附结束后溶液中多糖保留率;C0——吸附前溶液中多糖的质量浓度;Ct——吸附后溶液中多糖的质量浓度。
1.3.4 脱色率的测定 取10 g/L芦笋多糖溶液,以蒸馏水作参比进行紫外全波长扫描,结果表明,该溶液无最大吸收波长。由互补色原理可知,溶液呈现的颜色是其吸收光的互补色。芦笋粗多糖溶液为橙黄色,故该溶液主要吸收蓝紫色波段可见光。因此对400~500 nm波长范围内每隔10 nm测定脱色率,计算所测定的脱色率平均值,以脱色率最接近该平均值的450 nm作为测定波长。并按(3)式计算脱色率:

W3——脱色率;A0——吸附前溶液的吸光度;At——吸附后溶液的吸光度。
1.3.5 综合吸附效应指数的计算 整合分析(meta-analysis)是对同一主题下多个独立实验结果进行综合的统计学方法,被认为是目前最好的数量综合方法,其统计量为效应值。为客观评价脱色脱蛋白方法的有效性,引入综合吸附效应指数ζ(0≤ζ≤1),其物理意义为脱蛋白率、多糖保留率以及脱色率的加权和。ζ为一个无量纲的值,其值越大表明活性炭综合处理能力越好。其计算方法如下:

ζi表征活性炭的综合吸附效应指数;Wij为脱蛋白率(j=1)、多糖保留率(j=2)、脱色率 (j=3)实验数据;X1,X2,X3分别表示脱蛋白、多糖保留、脱色能力的权重。由于本次研究旨在考察活性炭对多糖溶液的脱色能力,但需兼顾处理方法对脱蛋白及对多糖的保留能力,故依重要性设定其值依次为0.2,0.3,0.5。
1.3.6 芦笋多糖活性炭脱色单因素试验
①温度对活性炭吸附性能的影响分别取多糖溶液10.0mL置于三角瓶中,在活性炭质量浓度为15 g/L,pH 值为6的条件下,设置脱色温度分别为30,40,50,60,70,80 ℃,恒温振荡脱色60 min,离心,取上清液,测定吸光度,计算脱色率、多糖保留率、蛋白质脱除率及综合吸附效应指数。
②时间对活性炭吸附性能的影响分别取多糖溶液10.0 mL置于三角瓶中,在温度为70℃,活性炭质量浓度为15 g/L,pH值为6的条件下,设置脱色时间分别为20,30,40,50,60 min,恒温振荡脱色,离心,取上清液,测定吸光度,计算脱色率、多糖保留率、蛋白质脱除率及综合吸附效应指数,确定时间对活性炭吸附性能的影响。
③活性炭质量浓度对活性炭吸附性能的影响分别取多糖溶液20.0 mL置于三角瓶中,在温度为70℃,脱色时间为60 min,pH值为6的条件下,添加活性炭,使多糖溶液中活性炭的质量浓度为5,10,15,20,25,30 g/L。恒温振荡脱色,离心,取上清液,测定吸光度,计算脱色率、多糖保留率、蛋白质脱除率及综合吸附效应指数,确定活性炭质量浓度对活性炭吸附性能的影响。
④pH值对活性炭吸附性能的影响分别取多糖溶液10.0 mL置于三角瓶中,在温度为70℃,脱色时间为60 min,活性炭质量浓度为15 g/L,设置pH值分别为5,6,7,8,9。恒温振荡脱色,离心,取上清液,测定吸光度度,计算脱色率、多糖保留率、蛋白质脱除率及综合吸附效应指数,确定pH值对活性炭吸附性能的影响。
1.3.7 芦笋多糖活性炭脱色均匀设计实验 在单因素试验基础上,对影响芦笋多糖脱色效果的主要因素——温度、时间、活性炭质量浓度、pH值进行均匀设计试验。因素水平见表1。
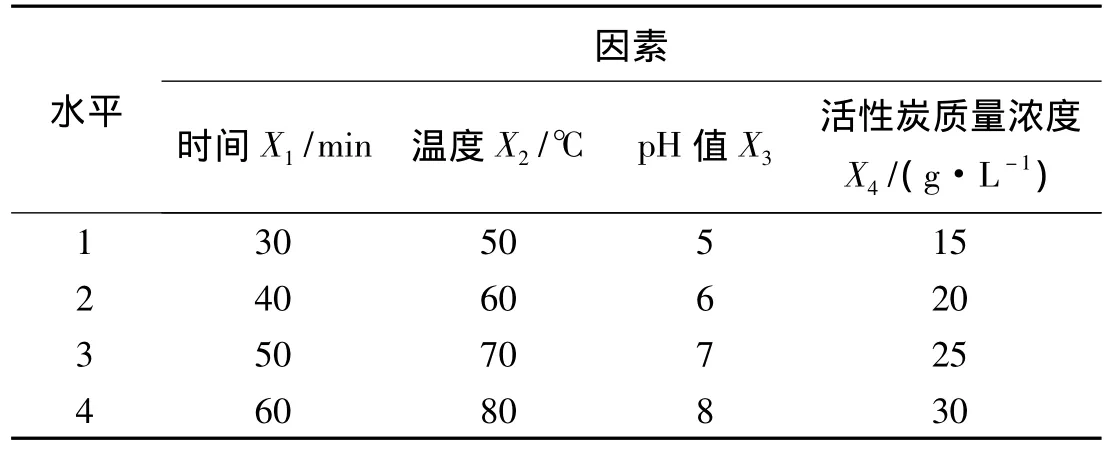
表1 芦笋多糖活性炭脱色均匀设计试验因素水平
1.3.8 芦笋多糖活性炭脱色验证实验 分别取多糖溶液10.0 mL置于5个三角瓶中,在均匀设计试验最优条件下进行芦笋多糖脱色试验,测定吸光度,计算脱色率、多糖保留率、蛋白质脱除率及综合吸附效应指数。
1.3.9 数据处理 图表中实验数据以平均值表示,ζ值由实验数据的平均值计算得到,数据处理软件为 DPSV6.55,作图软件为 ORINGIN 8.0。
2 结果与讨论
2.1 标准曲线的绘制
以牛血清蛋白质量浓度(g·L-1)为横坐标,吸光度值为纵坐标,芦笋蛋白质含量标准曲线回归方程为 y=1.450 0 x﹢0.290 0,R2=0.995 6(图1);以多糖的质量浓度(g·L-1)为横坐标,吸光度值为纵坐标,芦笋多糖含量标准曲线回归方程为 y=2.897 4 x-0.001 0,R2=0.999 7(图2)。

图1 芦芛蛋白质含量标准曲线

图2 芦芛多糖含量标准曲线
2.2 芦笋多糖活性炭脱色单因素试验结果
2.2.1 温度对活性炭吸附性能的影响 脱色率在脱色温度在30~50℃范围内,随温度升高明显增大,在50℃达到最大,后随温度升高缓慢下降;多糖保留率随温度增加呈先上升后下降趋势,在60℃时达到最高;蛋白质脱除率随温度增加呈先上升后下降趋势,在70℃时达到最高;综合吸附效应指数随温度增加呈先上升后下降趋势,在70℃时达到最大(图3)。参考综合吸附效应指数,确定脱色温度70℃为最佳脱色条件。
2.2.2 时间对活性炭吸附性能的影响 脱色率随时间增加呈先上升后下降趋势,50 min时达到最高;多糖保留率随时间增加呈先上升后下降趋势,在40 min时达到最高;蛋白质脱除率在20~30 min呈上升趋势,在30 min时达到最高,随后达到平衡;综合吸附效应指数随时间增加呈先上升后下降趋势,在40 min时达到最大(图4)。参考综合吸附效应指数,确定脱色时间40 min为最佳脱色条件。

图3 温度对活性炭吸附性能的影响

图4 时间对活性炭吸附性能的影响
2.2.3 活性炭质量浓度对活性炭吸附性能的影响 脱色率在活性炭的质量浓度为5~25 g/L范围内,随用量增加明显增大,随后达到平衡;多糖保留率随用量增加呈不断下降趋势;蛋白质脱除率随用量增加而升高,在活性炭的质量浓度为25 g/L时达到最高,随后下降;综合吸附效应指数随活性炭的质量浓度升高而升高,在活性炭的质量浓度为25 g/L时达到平衡(图5)。参考综合吸附效应指数,确定活性炭的质量浓度25 g/L为最佳脱色条件。
2.2.4 pH值对活性炭吸附性能的影响 脱色率受pH值影响较小,在pH值为7时出现拐点,呈下降趋势;多糖保留率在pH值为5~6时增加显著,随后呈缓慢增加趋势;蛋白质脱除率随pH值增大呈先升高后降低趋势,在pH值为7时达到最高;综合吸附效应指数随pH值增加呈先升高后降低趋势,在pH值为7时达到最大(图6)。参考综合吸附效应指数,确定最佳脱色条件为pH值为7。

图5 活性炭质量浓度对活性炭吸附性能的影响
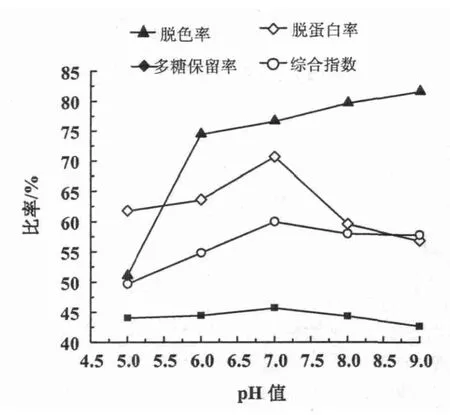
图6 pH值对活性炭吸附性能的影响
2.3 芦笋多糖活性炭脱色均匀设计实验结果
根据表1设定的因素水平,利用DPSV6.55软件进行均匀设计试验。试验结果见表2,各因变量与各自变量标准回归系数关系见表3,对模型以综合吸附效应指数为目标函数进行求解见表4。
以综合吸附效应指数为目标函数,对试验结果(表2)进行偏最小二乘建模。采用偏最小二乘二次多项式回归分析,其模型如下:

通过对回归系数绝对值(表3)进行比较,4个因素对综合吸附效应指数的影响程度的相对由大到小的顺序为:活性炭质量浓度,时间,温度,pH值。
对模型以综合吸附效应指数为目标函数进行求解,确定各变量最优值(表4)。
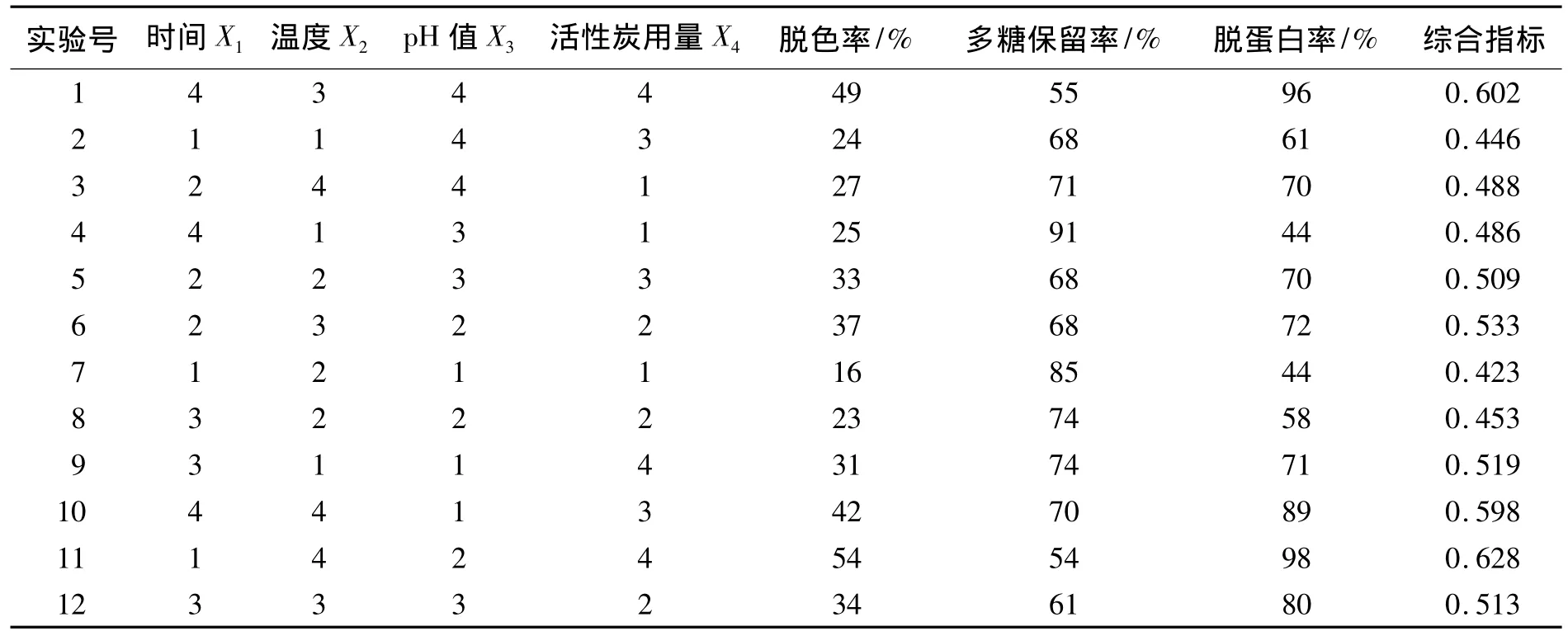
表2 芦笋多糖活性炭脱色的均匀设计试验结果

表3 芦笋多糖活性炭脱色各因变量与各自变量标准回归系数关系
2.4 芦笋多糖活性炭脱色验证实验结果
在活性炭的质量浓度为25 g/L,时间60 min,温度80℃,pH值为5.6最佳条件下进行验证实验,综合指标为0.682 4(脱色率为67%,脱蛋白率89%,多糖保留率56%),与模型所得的目标函数(0.655 8)误差为3.9%,认定该模型有效。

表4 芦笋多糖活性炭脱色最佳提取条件
3 结 论
本试验中,以活性炭为脱色剂,考察活性炭用量、时间及温度等因素对多糖脱色效果的影响。试验结果表明,各因素影响顺序由大到小依次为:活性炭的质量浓度,时间,温度,pH值。其最佳脱色工艺条件为:活性炭的质量浓度25 g/L,时间60 min,温度80℃,pH值为7.0。在此条件下,脱色率为67%,脱蛋白率89%,多糖保留率56%,综合吸附效应指数为68.24%。我国芦笋资源丰富,且其具有较高的营养价值。活性炭法工艺简单、成本低,适合工业化生产的需要,研究其脱色工艺对于芦笋多糖的工业化生产提供可靠的理论依据,确保芦笋保健食品的原料供给充足和高品质。
[1] 陈旋,张翼,张剑波.植物多糖的研究进展[J].中国新药杂志,2007,16(13):1 000-1 005.
[2] 孙春艳,赵伯涛,郁志芳,等.芦笋的化学成分及药理作用研究进展[J].中国野生植物资源,2004,23(5):1-5.
[3] Mabel MJ,Sangeetha P T,Hatel K,et a1.Physicochemical characterization of fructooligosaccharides and evaluation of their suitability as a potential sweetener for diabe tics[J].Carbohydrate Research,2008,343(1):56-66.
[4] Kooh N,Jeong H J,Choi JY,et al.Inhibition of tumor necrosisfactorα-induced apoptosis by Asparagus cochinchinensis in Hep G2cells[J].Journal of Ethnopharmacology,2000,73(1/2):137-143.
[5] 卢国勇,孟江,廖华卫.鱼腥草多糖双氧水脱色工艺研究[J].时珍国医国药,2011,22(3):671-673.
[6] 孔凡利,张名位,于淑娟,等.荔枝多糖活性炭脱色方法研究[J].食品科技,2008(6):115-117.
[7] Bradford MM.Arapid and sensitivemethod for the quantitation ofmicrogram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72(7):248-254.
[8] 钟方晓,任海华,李岩.多糖含量测定方法比较[J].时珍国医国药,2007,18(8):1 916-1 917.

