肉桂醛对番茄采后灰霉病的抑制作用及其对品质的影响
张娜娜,张 辉,马 丽,唐 坚,乔勇进,*
(1.上海市农业科学院作物育种栽培研究所,上海 201403;2.上海师范大学生命与环境科学学院,植物种质资源开发中心,上海 200234)
肉桂醛对番茄采后灰霉病的抑制作用及其对品质的影响
张娜娜1,2,张 辉1,马 丽1,唐 坚2,乔勇进1,*
(1.上海市农业科学院作物育种栽培研究所,上海 201403;2.上海师范大学生命与环境科学学院,植物种质资源开发中心,上海 200234)
为研究肉桂醛对番茄采后灰霉病的抑制作用及其对番茄果实品质的影响,在离体条件下分别研究肉桂醛对灰 葡萄孢菌菌丝生长、孢子萌发的抑制作用,采用人工活体接种法研究肉桂醛对番茄果实灰霉病斑的控制作用,及其对番茄自然发病果实的品质的影响。结果表明,肉桂醛对灰葡萄孢菌的菌丝生长和孢子萌发均有较好的抑制作用,对菌丝生长的EC50值为95.6 μg/mL,质量浓度为60 μg/mL时对孢子萌发抑制率为100%;活体条件下肉桂醛能够有效地抑制番茄果实采后灰霉病病斑的扩展,以4 000 μg/mL效果最好,且在此质量浓度条件下,对于降低果实质量损失率,维持番茄硬度、可溶性固形物、可滴定酸和VC含量均具有较好的效果。4 000 μg/mL肉桂醛处理能够有效地控制番茄采后灰霉病的发生及延长其保鲜期。
肉桂醛;番茄;灰霉病;生理品质
番 茄为茄科草本植物,浆果,皮薄肉厚,含水量达95%。在采摘和运输过程中极易受到机械损伤,从而易受真菌入侵。番茄灰霉病是引起番茄采后病害的主要病害,病原菌为半知菌亚门葡萄孢属的灰葡萄孢菌(Botrytis cinerea Pers. ex Fr.),因其产孢量大、繁殖迅速、发病周期短,可在茄果类、瓜类、葱蒜类等多种作物间交叉传播感染[1]。随着在世界各地的广泛种植,番茄已然成为最重要的经济作物之一,为了提高番茄的产量和经济效益,对番茄灰霉病的防治已经成为世界各国保护生产发展的关键措施。目前对番茄灰霉病的防治仍然是以化学防治为主,但在越来越注重食品安全的现在,化学农药的污染重,成本高,残留多以及极易产生抗药性,催生越来越多的生物农药的问世,番茄 采后病害生物防治技术逐渐成为采后防腐保鲜研究的热点[2-4]。
近些年来,植物精油作为一种天然的抑菌剂受到人们的广泛关注。对于植物精油在果蔬保鲜方面的应用,前人也做了不少研究。丁香精油的主要成分丁香酚能够抑制冬枣表面的致病微生物并能诱导其抗病性[5];用茶树油进行熏蒸能够有效地抑制草莓灰霉病致病菌的菌丝生长和孢子萌发,并能够维持草莓果实的品质,延长其保鲜期[6]。肉桂精油是从月桂(Laurus nobilis)中提取的,它具有杀菌、抑菌和抗氧化功效[7],肉桂提取物对多种果蔬致病菌具有较好的抑制作用[8]。肉桂精油中的肉桂醛是主要的抗真菌物质[9],肉桂醛对人体无毒或低毒,对微生物的繁殖能起到较强的抑制作用[10]。柳风等[11]发现肉桂醛能间接减少炭疽病菌侵染的杧果体内活性氧等物质含量的上升,减少病菌侵染导致防御酶系统发生紊乱的程度,从而抑制和减轻杧果炭疽病害的发生。Smid等[12]研究表明肉桂醛能够明显降低番茄果实表面和萼部的细菌和真菌的数量,从而达到对番茄表面进行消毒的目的。Sivakumar等[13]研究表明,肉桂醛对红毛丹的蒂腐病菌、炭疽病菌和褐腐病菌均有较好的抑制效果。迄今为止,肉桂醛对番茄灰霉病的抑制作用鲜有报道。鉴于此,本实验研究了肉桂醛对番茄采后灰霉病菌菌丝及分生孢子的抑制作用,及其对番茄果实生理品质的影响,以期为番茄果实采后生物防腐保鲜提供理论依据。
1 材料与方法
1.1 材料与试剂
番茄品种为“浦粉1号”,购自上海浦南番茄标准园,选择当天采摘、大小和成熟度基本一致、无病虫害和机械损伤的番茄果实供试;灰葡萄孢菌(Botrytis cinerea)是分离自典型发病的番茄果实,4 ℃条件下斜面保存备用。
2,6-二氯靛蓝、NaOH、无水乙醇、吐温-80(均为分析纯)、95%肉桂醛(用无水乙醇和吐温-80将其配制成10%的肉桂醛母液) 国药集团化学试剂有限公司。
1.2 仪器与设备
SPX-250B-Z恒温培养箱 上海博讯有限公司;HVE-50高压蒸汽灭菌锅 日本托米公司;CA-1480超净工作台 上海上净净化设备有限公司;血球计数板 上海求精生化仪器有限公司;BX51摄像显微镜 日本奥林巴斯有限公司;GY-3硬度计 浙江托普仪器有限公司;N-1α手持折光仪 日本Atago公司。
1.3 方法
1.3.1 肉桂醛在离体条件下对灰葡萄孢菌菌丝生长的抑制作用
用琼胶平板法测定肉桂醛的抑菌活性[14]。首先制备系列质量浓度50、100、150、200 μg/mL的带毒培养基,以加入相同量无菌水的培养基中作为空白对照,在超净工作台上用直径为5 mm的灭菌打孔器在培养3 d的灰葡萄孢菌菌落的边缘处打取菌饼,并反接在以上各质量浓度冷却后的带毒平板中央,封口膜密封,在25 ℃恒温培养箱中培养,待对照平板菌落长至近2/3平皿时,用十字交叉法测量各处理菌落直径,并根据公式(1)计算菌落相对抑制率。用SPSS 19.0软件,根据质量浓度对数(X)和菌落生长相对抑制率的几率值(Y),求肉桂醛对灰葡萄孢菌菌丝生长的毒力回归方程Y=a+bX和相关系数(r2),并计算抑菌有效中浓度EC50及其95%置信区间。每个处理设3 个平行,重复3 次。
1.3.2 肉桂醛对灰葡萄孢菌孢子萌发的抑制作用
分生孢子悬浮液的制备:将斜面保存的灰葡萄孢菌接种到马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基上,25 ℃条件下培养7 d。用体积分数0.05%的吐温-80配制成的无菌水冲洗孢子,并用血球计数板调整至1×106个/mL的孢子悬浮液备用。
按照1.3.1节制备质量浓度分别为10、20、40、60 μg/mL的带毒PDA平板,用移液枪取10 μL浓度为1×106个/mL的孢子悬浮液于平板中央,无菌条件下均匀涂布,以加入无菌水的处理为空白对照,12 h后观察孢子萌发情况,并根据公式(2)、(3)计算孢子萌发抑制率。每个处理设3 个平行,实验重复3 次。
1.3.3 肉桂醛处理对番茄果实活体接种发病率的影响
选择外观整齐、无病虫害和机械损伤的番茄果实,用自来水将果面冲洗干净,然后用0.2%的次氯酸钠溶液消毒后用无菌水冲洗晾干。在番茄最大直径处表面刺深约3 mm,直径约2 mm的圆形伤口,分别注入5 μL浓度为1×106个/mL的孢子悬液,将接种后的番茄放入0.03 mm的聚乙烯保鲜袋后置于塑料托盘中,放在25 ℃条件下培养12 h后,分别将番茄放入质量浓度分别为1 000、2 000、4 000 μg/mL的肉桂醛溶液中浸泡2~3 min,以无菌水浸泡作为空白对照,晾干并包装后,置于上述条件下继续培养。每个处理20 个果实,重复3 次。培养2 d后每天调查各处理果实的发病情况,测量病斑直径。
1.3.4 肉桂醛对自然发病番茄果实的品质影响
选择番茄果实,标准及消毒方式同1.3.3节,根据1.3.3节实验结果,用质量浓度分别为1 000、2 000、4 000 μg/mL的肉桂醛溶液浸泡番茄果实2~3 min,用无菌水浸泡作为空白对照,晾干并用0.03 mm聚乙烯保鲜袋包装后放入1.3.3节相同的条件下贮存,隔3 d测定番茄果实的品质。对番茄果实进行称质量,并按照公式(4)计算果实的质量损失率。
硬度:用GY-3硬度计测定;总可溶性固形物(total soluble sol ids,TSS)含量:用N-1α手持折光仪测定;可滴定酸(titratable acid,TA)含量:参照李合生[15]酸碱滴定的方法测定,按照苹果酸的折算系数来计算;VC含量:参照李合生[15]的2,6-二氯靛蓝法进行测定。实验重复3 次,结果用SPSS 19.0软件进行多重比较分析。
2 结果与分析
2.1 肉桂醛对灰葡萄孢菌菌丝生长的影响

表1 肉桂醛对灰葡萄孢菌菌丝生长的抑制毒力Table 1 Antifungal effect of cinnamaldehyde against mycelila growth ooff Botrytis c inerreeaa

图1 肉桂醛对灰葡萄孢菌菌落扩展的影响Fig.1 Effect of cinamaldehyde on colony expansion of Botrytis cinerea
由表1可以看出,肉桂醛的质量浓度与其抑菌效果呈正相关,肉桂醛对灰葡萄孢菌菌丝生长的EC50值为95.6 μg/mL,不同质量浓度的肉桂醛处理对灰葡萄孢菌菌丝生长具有不同程度的抑制作用,且呈现明显的剂量效应,随着肉桂醛质量浓度的增加,其抑菌效果逐渐增强(图1)。150 μg/mL对菌丝的抑制率达85.6%,200 μg/mL可完全抑制菌丝的生长。从表观形态看,对照组菌丝生长旺盛,菌丝分布均匀,色素呈深褐色;而处理组菌丝长势较弱,菌丝呈现向中间生长的趋势,色素颜色浅,呈浅褐色。可见,肉桂醛对灰葡萄孢菌菌丝生长具有较好的抑制效果。
2.2 肉桂醛对灰葡萄孢菌孢子萌发的影响

图2 肉桂醛对灰葡萄孢菌孢子萌发的抑制率Fig.2 Inhibitory effect of cinnamaldehyde on spore germination of Botrytis cinerea
肉桂醛对灰葡萄孢菌的孢子萌发具有显著的抑制作用(图2),在10~60 μg/mL范围内孢子萌发抑制率呈不断上升的趋势,在40 μg/mL时抑制率已经达到80%以上,在60 μg/mL时已经能够完全抑制孢子的萌发。在显微镜下(200×),对照组孢子圆形或椭圆形,芽管壁光滑,芽管细长;处理组孢子萌发畸形,芽管短小或没有,顶部缢缩,菌丝粗短,生长迟缓。
2.3 肉桂醛处理对番茄果实活体接种病斑直径的影响

图3 肉桂醛处理对番茄活体接种灰葡萄孢菌病斑直径的影响Fig.3 Effect of cinnamaldehyde on lesion diameter of tomato fruits inoculated with Botrytis cinerea
由图3可见,肉桂醛处理可以不同程度地控制番茄灰霉病病斑的扩展,质量浓度越高控制作用越明显,对照组番茄在接种后第1天就有明显的病斑出现,而经过4 000 μg/mL处理的番茄果实在第3天时才开始发病,且在此质量浓度下番茄发病缓慢。结果表明,肉桂醛抑制番茄灰霉病的最佳质量浓度为4 000 μg/mL。
2.4 肉桂醛对自然发病番茄果实品质的影响
2.4.1 肉桂醛处理对番茄质量损失率和硬度的影响
由于番茄采后依然会进行较强的呼吸作用和蒸腾作用,水分和某些营养物质含量也会随着贮藏时间的延长而降低,所以质量损失率是评价水果品质的重要指标之一。图4a显示,肉桂醛处理对番茄果实的质量损失率有明显的抑制作用。对照处理的果实质量损失率在贮藏第15天达到4%以上,而4 000 μg/mL处理的番茄果实一直保持在1%以下,与对照组差异极显著(P<0.01),而1 000、2 000 μg/mL处理与对照差异不显著(P>0.05),说明4 000 μg/mL是维持番茄果实质量损失率的最适质量浓度。

图4 肉桂醛处理对番茄果实质量损失率(a)和硬度(b)的影响Fig.4 Effect of cinnamaldehyde on weight loss and hardness of tomato fruits
硬度是鉴定果实品质优劣最直接的方法,肉桂醛处理能够明显抑制番茄果实软化(图4b),且随着肉桂醛质量浓度增加,对果实软化的抑制作用增强。4 000 μg/mL处理效果最好,在此质量浓度下番茄果实硬度下降缓慢,且与对照组差异显著(P<0.05)。在贮藏第9天,对照组番茄硬度已经下降50%,此时番茄果实组织软化严重,已不具备商品价值;而4 000 μg/mL处理的番茄在贮藏第15天仅下降不到40%,番茄果实仍饱满圆润,具有极好的外观品质。1 000 μg/mL和2 000 μg/mL的处理也能在一定程度上维持果实硬度,但与对照组差异不明显(P>0.05),所以4 000 μg/mL是维持番茄果实硬度,提高其品质的最佳处理。
2.4.2 肉桂醛处理对番茄TSS和TA含量的影响
TSS包括可溶性的糖、有机酸、抗坏血酸、胡萝卜素和番茄红素等营养物质,所以TSS的含量与其营养价值呈正相关的关系[16]。图5a显示,在番茄贮藏过程中,TSS含量时逐渐下降的,但是随着肉桂醛质量浓度的升高,其下降程度不同,对照组下降最快,在贮藏第15天已经下降了58.2 %,4 000 μg/mL处理下降了27.8%,对照组与4 000 μg/mL处理差异显著(P<0.05),而1 000 μg/mL和2 000 μg/mL处理与对照组差异不显著(P>0.05),说明4 000 μg/mL处理能够较好地维持番茄果实TSS含量,保持其品质。
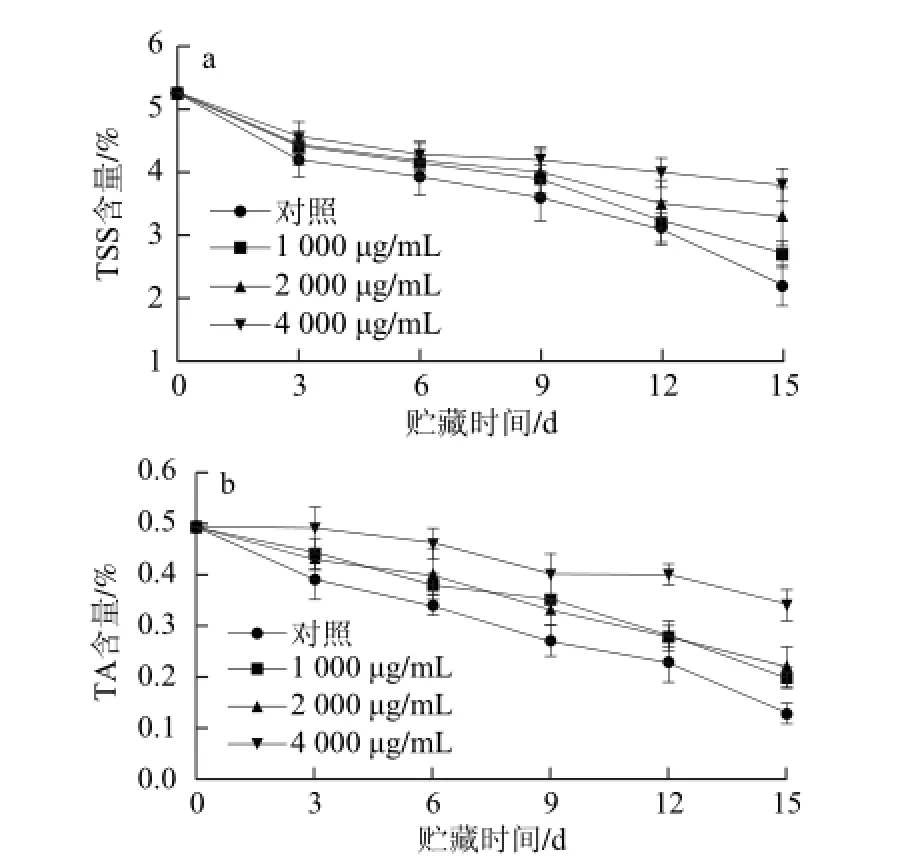
图5 肉桂醛对番茄果实TSS(a)和TA(b)含量的影响Fig.5 Effect of cinnamaldehyde on total soluble solids and titratable acid contents of tomato fruits
TA是果实中所有有机酸的统称,番茄中的有机酸主要是苹果酸和柠檬酸,在番茄果实成熟到衰老过程中,苹果酸含量最高[17]。图5b显示,高质量浓度的肉桂醛处理能够有效地抑制TA含量的下降,对照组番茄在贮藏第15天时已经下降73.5%,而4 000 μg/mL处理的番茄仅下降30.6%,显著高于对照组(P<0.05),1 000 μg/mL和2 000 μg/mL处理在贮藏第15天TA含量分别下降了59.2%和55.1%,4 000 μg/mL处理明显优于1 000 μg/mL和2 000 μg/mL的处理组,因此4 000 μg/mL是维持番茄TA含量的最佳质量浓度。
2.4.3 肉桂醛处理对番茄VC含量的影响

图6 肉桂醛处理对番茄VC含量的影响Fig.6 Effect of cinnamaldehyde on vitamin C content of tomato fruits
番茄果实中含有丰富的VC,VC作为一种抗氧化物质,能够清除番茄果实内部氧化生成的自由基,延缓果实衰老。随着贮藏期的延长,对照组和处理组抗坏血酸含量均有所降低(图6),但处理组下降速率明显低于对照组,其中以4 000 μg/mL处理效果最佳,在贮藏第15天,对照组果实中抗坏血酸含量下降到7 mg/100 g,2 000 μg/mL和4 000 μg/mL分别高达12 mg/100 g和14 mg/100 g,两者与对照均差异极显著(P<0.01),可见,肉桂醛对于维持番茄果实内的VC含量、延缓衰老具有很好的效果。
3 讨 论
大量研究表明,从芳香植物或中草药中提取的精油类物质具有抑菌或杀菌的活性,可以作为一种天然无添加、无毒、无抗性的食品防腐剂[18]。本实验采用菌丝生长速率法和孢子萌发法测定了肉桂醛对灰葡萄孢菌的影响,结果表明,肉桂醛对抑制灰葡萄孢菌的菌丝生长和孢子萌发具有显著的作用。从菌丝的生长形态来看,肉桂醛处理的菌落长势较弱,出现边缘菌丝稀少、中间菌丝突起的现象,菌落色素呈浅褐色,且产孢量少,在显微镜下(200×)菌丝内部细胞质凝集,菌丝空泡化、发黑变粗、萎缩,原生质体渗漏,这与Soylu等[19]研究结果一致;而对照菌丝生长旺盛,且分布均匀,产孢多,色素呈深褐色,显微镜下菌丝内容物分布均匀,无细胞质凝集等异常现象。这可能是因为肉桂醛能够通过特异性地抑制真菌细胞壁葡聚糖和几丁质的合成,抑制真菌细胞的生长[20]。而Abbas等[21]认为肉桂醛是一种亲水物质,它能够溶解在细胞膜疏水域的相邻脂酰链之间,使外层膜裂解,增强细胞膜的渗透性,使致病菌细胞中的三磷酸腺苷外渗,最终导致细胞死亡,也可能是由于肉桂醛与真菌的细胞膜作用引发膜的脂质过氧化而导致膜损伤[22],从而抑制真菌的生长,同时延缓了番茄果实的发病进程。在食品实际应用中所需的浓度往往要比在离体培养基中高,是因为食品所处的环境及其基体组织与药剂互相作用的结果[22]。在活体条件下,抑制番茄病斑形成的最佳质量浓度为4 000 μg/mL。肉桂醛通过抑制果实致病菌的生长,抑制果实病斑的扩展。这种作用可以有效地防止灰葡萄孢菌对番茄果实的侵染和再侵染。
番茄是典型的呼吸跃变型浆果[23],采收后仍会进行强烈的呼吸作用和蒸腾作用,水分和营养物质也会随之减少,从而影响番茄果实的品质和商品价值。肉桂醛处理能够较好地维持番茄果实的品质,且以4 000 μg/mL处理效果最佳。在此质量浓度下,番茄果实的质量损失率最低,硬度、TSS、TA含量下降最慢,且能维持较高的VC含量。肉桂醛能够维持番茄的品质原因可能有两方面:一是肉桂醛能够抑制或杀死番茄表面的致病微生物,防止微生物从伤口或果蒂入侵[12];另一方面可能是由于肉桂醛能够渗透到膜结合蛋白酶结合,通过抑制酶促反应来抑制呼吸链中的电子传递,抑制果实氧化[24-25],使番茄果实保持较好的品质。
肉桂醛是一种挥发性物质,贮藏后期残留量低,对于怎样维持高质量浓度的肉桂醛,来延长番茄果实的保鲜期仍有待研究。
4 结 论
4.1 肉桂醛处理能够抑制番茄灰霉病致病菌灰葡萄孢菌的菌丝生长和孢子萌发,对菌丝生长的EC50值为95.6 μg/mL,最适抑菌质量浓度为150 μg/mL,最适杀菌质量浓度为200 μg/mL,在60 μg/mL时孢子萌发抑制率为100%。
4.2 肉桂醛处理能够降低人工接种灰葡萄孢菌的番茄果实的发病率,抑制番茄果实病斑的扩展,延缓其发病进程,以4 000 μg/mL的效果最好。
4.3 肉桂醛处理自然发病番茄果实结果表明,4 000 μg/mL的肉桂醛能够有效地保持番茄果实的品质,抑制其质量损失,维持其硬度、TSS、TA和VC含量,延缓番茄果实采后的衰老进程,延长其货架期。
[1] 刘向阳, 刘美菊. 番茄灰霉病的发生及防治措施[J]. 中国园艺文摘, 2012(4): 141-142.
[2] 童蕴慧, 郭桂萍, 徐敬友, 等. 拮抗细菌诱导番茄植株抗灰霉病机理研究[J]. 植物病理学报, 2004, 34(6): 507-511.
[3] 张新虎, 何静, 沈慧敏. 苍耳提取物对番茄灰霉病菌的抑制作用及抑菌机理初探[J]. 草业学报, 2008, 17(3): 99-104.
[4] 尹晓东, 魏松红, 刘冰, 等. 大蒜提取液对番茄两种真菌病害的抑制作用[J]. 沈阳农业大学学报, 2008, 39(1): 89-91.
[5] 李宁, 关文强, 阎瑞香. 丁香精油对冷藏冬枣果实腐烂及诱导抗病相关酶活性的影响[J]. 西北植物学报, 2012, 32(2): 324-329.
[6] 程塞, 邵兴锋, 郭安南, 等. 茶树油熏蒸对草莓采后病害和品质的影响[J]. 农业工程学报, 2011, 27(4): 383-388.
[7] 郑虎占, 董泽宏, 余靖. 中药现代研究与应用[M]. 北京: 学苑出版社, 1997: 1871-1891.
[8] 李科玮, 毕阳, 张忠, 等. 肉桂提取液对果蔬致病菌的体外抑菌试验[J].甘肃农业大学学报, 2010, 45(3): 81-84.
[9] JHAM G N, DHINGRA O D, JARDIM C M, et al. Identification of the major fungitoxic component of cinnamon bark oil[J]. Fitopatologia Brasileira, 2005, 30(4): 404-407.
[10] 阮海燕. 肉桂醛在香精香料、日用化学品及食品添加剂行业中的应用[M]. 精细与专用化学品, 2005, 13(3): 9-13.
[11] 柳风, 詹儒林, 何衍彪, 等. 抑菌物质肉桂醛防治杧果炭疽病机制研究[J]. 果树学报, 2011, 28(4): 651-656.
[12] SMID E J, HENDRIKS L, BOERRIGTER H A M. Surface disinfection of tomatoes using the natural plant compound transcinnamaldehyde[J]. Postharvest Biology and Technology, 1996, 9: 343-350.
[13] SIVAKUMAR D, WILSON-WIJERATNAM R S, WIJERATNAM R L C. Control of postharvest diseases of rambutan using cinnamaldehyde[J]. Crop Protection, 2002, 21: 847-852.
[14] 何衍彪, 詹儒林, 赵艳龙, 等. 20 种植物提取物对芒果炭疽病菌的抑制作用[J]. 热带作物学报, 2005, 26(3): 86-89.
[15] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
[16] 张旭伟, 徐明磊, 李红艳, 等. 番茄可溶性固形物的作用及研究概况[J].科技资讯, 2011(15): 160-161.
[17] MOUNET F, LEMAIRE-CHAMLEY M, MAUCOURT M, et al. Quantitative metabolic profiles of tomato flesh and seeds during fruit development: complementary analysis with ANN and PCA[J]. Metabolomics, 2007, 3(3): 273-288.
[18] ANTUNES M D C, CAVACO A M. The use of essential oils for postharvest decay control[J]. Flavour and Fragrance Journal, 2010, 25: 351-366.
[19] SOYLU E M, KURT S, SOYLU S. In vitro and in vivo antifungal activities of the essential oils of various plants against tomato grey mould disease agent Botrytis cinerea[J]. Food Microbiology, 2010, 143: 183-189.
[20] 汪琨, 徐峥, 汪倩雯, 等. 肉桂醛特异性抑制酵母细胞壁合成的作用机理[J]. 食品发酵与工业, 2012, 38(3): 68-71.
[21] ABBAS H, ZOHREH F, YOUBERT G, et al. Evaluation of plant essential oils for control of postharvest brown and gray mold rots on apricot[J]. Journal of Food Safety, 2012, 32: 94-101.
[22] 戴向荣, 蒋立科, 罗曼. 肉桂醛抑制黄曲霉机理初探[J]. 食品科学, 2008, 29(1): 36-40.
[23] 康钰, 左嘉伟. 番茄贮藏保鲜技术[J]. 四川农业科技, 2013(1): 50-51.
[24] SHAN Bin, CAI Yizhong, BRO OKS J D, et al. Antibacterial properties and major bioactive components of cinnamon stick (Cinnamomun burmannii): activity against foodborne pathogenic bacteria[J]. Journal of Agriculture and Food Chemistry, 2007, 55: 5484-5490.
[25] 刘晓艳, 白卫东. 肉桂油抑菌及抗氧化作用的研究进展[J]. 食品与机械, 2010, 26(5): 169-172.
Effects of Cinnamaldehyde on Inhibiting Postharvest Gray Mold and Maintaining the Quality of Tomato Fruits
ZHANG Na-na1,2, ZHANG Hui1, MA Li1, TANG Jian2, QIAO Yong-jin1,*
(1. Crop Breeding and Cultivation Research Institute, Shanghai Academy of Agricultural Sciences, Shanghai 201403, China; 2. Development Center of Plant Germplasm Resources, College of Life and Evironmental Sicences, Shanghai Normal University, Shanghai 200234, China)
In order to study the inhibitory effect of cinnamaldehyde on postharvest gray mold and its effect on quality maintenance of tomato fruits, the inhibitory effect of the antimicrobial compound on spore germination and mycelial growth of Botrytis cinerea cultured under detached conditions was investigated as well as the suppressive effect on the development of blue gray lesions by artificial inoculation and the effect on the quality of naturally infected fruits. The results showed that cinnamaldehyde treatment was significantly effectives against spore germination and mycelial growth of Botrytis cinerea. The EC50was 95.6 μg/mL in growth inhibition assays, and the spore germination was completely inhibited by 60 μg/mL cinnamaldehyde. Cinnamaldehyde treatment also suppressed the development of postharvest blue gray lesions in tomato fruits and 4 000 μg/mL was the most effective concentration. The fruits maintained lower weight loss and higher hardness, total soluble solids (TSS), titratable acid (TA) and ascorbic acid content at this concentration. This study indicates that cinnamaldehyde treatment at 4 000 μg/mL can effectively control postharvest gray mold and prolong the shelf life of tomato fruits.
cinnamaldehyde; tomato; grey mold; physiological quality
S641.2
A
1002-6630(2014)14-0251-05
10.7506/spkx1002-6630-201414048
2013-08-20
上海市科委国际合作计划项目(073907003)
张娜娜(1988—),女,硕士研究生,研究方向为农产品保鲜与加工。E-mail:zhangnana88@126.com
*通信作者:乔勇进(1967—),男,研究员,博士,研究方向为农产品保鲜与加工。E-mail:yjqiao2002@126.com

