软脑膜侧支循环对症状性大脑中动脉狭窄或闭塞患者卒中复发及死亡事件影响研究
张幼林,冀瑞俊,王春娟,王拥军
大脑中动脉(middle cerebral artery,MCA)直接延续于颈内动脉(internal carotid artery,ICA)末端,位于Willis环之后,MCA狭窄或闭塞后由于无法通过初级侧支循环(Willis环)和眼动脉(ophthalmic artery,OA)代偿,此时软脑膜动脉(leptomeningeal anastomoses,LMA)开放和建立,提供代偿血流,为灌注缺乏区供血,成为主要的代偿方式,使得LMA有可能是缺血性卒中复发等不同预后的影响因素之一[1]。目前对不同LMA代偿途径行分析探讨的研究较少,本研究利用磁共振血管成像(magnetic resonance angiography,MRA)评价MCA重度狭窄或闭塞患者不同途径LMA代偿情况,并对入组患者进行1年随访,探讨不同途径LMA代偿与患者预后的关系。
1 对象与方法
1.1 病例选择 本研究为前瞻性研究,选择2009年1月~2012年1月首都医科大学附属北京天坛医院神经内科住院治疗的单侧症状性MCA狭窄或闭塞病例。入组标准:①30 d内的缺血性卒中,包括脑梗死和短暂性脑缺血发作(transient ischemic attack,TIA)患者[2-3];②单侧MCA重度狭窄或闭塞(狭窄率70%~100%)[4];③接受规范的抗栓治疗以及降脂治疗:阿司匹林、氯吡格雷或二者联合抗血小板治疗(包括超急性期动、静脉溶栓)等;④头磁共振成像(magnetic resonance imaging,M R I)或计算机断层扫描(co m p u te d tomography,CT)、MRA等影像资料完整;⑤病历资料完整并完成随访。
排除标准:①在住院期间或随访期内行任一血管再通手术治疗;②伴其他系统严重疾病者(随访期间发现者除外);③非动脉粥样硬化性动脉狭窄;④对侧颅内大动脉及基底动脉中重度狭窄(狭窄率大于50%);⑤经头MRI、心脏超声、心电图等证实为心房颤动或心源性栓塞;⑥同侧ICA中重度狭窄(狭窄率大于50%)导致的串联病变;⑦住院期间死亡或因家属放弃治疗而死亡。最终入组并完成随访患者为249例,其中男性174例,女性75例。
1.2 MRA评价MCA重度狭窄或闭塞及LMA的标准 头MRI及MRA影像均采用Siemens公司的Sonata 1.5T超导型磁共振扫描机。MRA采用的是3D-TOF法,MRA对MCA狭窄的诊断参照Samuels的标准,重度狭窄:血管管径减少>70%或局限性血流信号消失[4]。①大脑后动脉(posterior cerebral artery,PCA)途径LMA代偿:与对侧比较,同侧PCA主干增粗、分支增多、末梢延长,即P3段、P4段二者或其中之一增粗、延长;②大脑前动脉(anterior cerebral artery,ACA)途径LMA代偿:与对侧比较,同侧ACA主干增粗、分支增多、末梢延长,即额底、额前内侧动脉增粗、延长[5]。针对特殊情况的处理:①同侧ACA或PCA出现中重度狭窄或闭塞,认为该动脉途径LMA代偿阴性;②患侧ACA由对侧发出时,等同于MCA狭窄或闭塞同侧发出;③虽有基底动脉(basilar artery,BA)、PCA狭窄或闭塞,但存在胚胎大脑后动脉,无论是单侧还是双侧,均认为病变同侧起源PCA,再根据与对侧对比评价LMA代偿情况。阅片由2名经MRA阅片培训的经验丰富的高年资神经内科医师承担MRA影像分析,分别统计LMA双途径LMA代偿病例60例(24.1%),ACA途径LMA代偿46例(18.5%),PCA途径LMA代偿60例(24.1%),无LMA代偿83例(33.3%)。左、右侧MCA受累基本一致(表1)。
2.2 不同途径LMA代偿组不良事件分布 随访1年中有17例缺血性卒中复发事件,复发率为6.83%。其中脑梗死15例、TIA 2例。脑梗死分布为:双代偿途径组1例、ACA代偿途径0例、PCA代偿途径组4例、无代偿组10例;而TIA分布为:双代偿途径组0例;ACA代偿途径组1例;PCA代偿途径组1例;无代偿组0例。共6例患者死亡,死亡率为2.4%,其中双代偿途径组0例、ACA代偿途径1例(1例心源性死亡)、PCA代偿途径组1例(1例肿瘤性死亡)、无代偿组4例(1代偿途径情况,如意见不统一时通过会商确定。根据LMA代偿情况,共分4组:无LMA代偿组、ACA途径代偿组、PCA途径代偿组、双途径代偿组。
1.3 缺血性卒中危险因素的定义 高血压诊断按照2004年中国高血压防治指南标准[6];糖尿病诊断按照中国2型糖尿病防治指南(2007年版)的标准[7];冠状动脉粥样硬化性心脏病诊断按照心血管病诊疗指南解读标准[8];吸烟的定义为每日吸烟不少于1支,连续1年以上;饮酒的定义为每周饮酒量折合酒精≥50 g。
1.4 随访 采用电话随访及来院复诊相结合,随访期限为1年,其中6个月及12个月分别随访1次,随访内容至少包括:脑梗死复发及TIA(确认为责任血管同侧受累)、脑出血(intracerebral hemorrhage,ICH)、全因死亡,并记录以上不良事件的具体时间。
1.5 统计方法 采用SPSS 16.0统计软件进行统计分析,对计量资料行正态性检验,符合正态分布的计量资料应用(s)来描述;计数资料用频数及百分比来描述,对预后等计数资料组间比较采用Kaplan-Meier乘积极限法,P<0.05提示差异具有显著性;并对差异有显著性的组别进行组内两两比较。合并后的二分类计数资料采用χ2检验,P<0.05提示差异有显著性。

表1 全部患者基本特征
2 结果
2.1 患者一般资料 资料完整并最后完成随访的共249例患者,年龄28~82岁,平均(57.63±11.57)岁,脑梗死患者216例(86.7%),TIA患者33例(13.3%)。MCA闭塞122例(49.0%),MCA重度狭窄127例(51.0%)。其中男性174例(69.9%),年龄(56.01±11.61)岁;女性75例(30.1%),年龄(61.39±10.63)岁。合并危险因素由高到低依次为:高血压病、吸烟、饮酒者、糖尿病、冠状动脉粥样硬化性心脏病。例心源性死亡、3例不明原因死亡)。而在随访中4个代偿途径组均无脑出血事件发生。在无代偿组中缺血性卒中复发、全因死亡及总事件方面均最多,而在双代偿途径组中缺血性卒中复发、全因死亡及总的不良事件最少(表2)。
2.3 不同途径LMA代偿组间不良事件的对比 在4组不同途径LMA代偿组间,缺血性卒中(χ2=7.824、P=0.0497)、总的不良事件(χ2=11.238、P=0.011)等预后存在显著差异。进一步组内两两对比发现:在缺血性卒中方面无代偿组与双代偿途径组间差异存在显著性,P为0.022,而组内其他两者之间差异无显著性。在总事件方面:无代偿组与双代偿途径组、无代偿组与ACA代偿途径组之间差异存在显著性,P值分别为0.004和0.04,而组内其他两者之间差异无显著性。将单途径代偿组及双代偿途径组合并为有代偿组,并与无代偿组对比分析:有代偿组与无代偿组在缺血性卒中、总事件等方面差异存在显著性(P值分别为0.021和0.003),而两组间脑出血、全因死亡等差异未见显著性(图1~2)。
3 讨论
评价症状性MCA粥样硬化狭窄或闭塞患者LMA的方法众多,数字减影血管造影(digital subtraction angiography,DSA)为金标准,可直接显示LMA是否存在、血流方向、代偿范围及程度等,检测LMA有绝对优势,但属有创检查,存在一定的技术难度,费时且有并发症,目前不适宜普遍推广[9]。MRA具备无创、安全、简单、成像时间短等优势,3D-TOF法最为常用,但是,LMA这种血管吻合非常细小,3D-TOF MRA无法对其直观观察、评价,通过观察MCA狭窄或闭塞患者MRA影像,发现病变同侧ACA,PCA较对侧血管增粗,分支增多,末梢延长等,称之为“偏侧优势”,间接代表了MCA狭窄或闭塞时有效LMA形成;通过对MRA与DSA的比较,发现“偏侧优势”对DSA出现丰富LMA的阳性预测值为99.9%[5,10]。通过对“偏侧优势”进行分级研究,已经被广泛应用于临床研究。其他的评价方法包括CT血管造影、灌注CT、动态CT血管造影、动脉自旋标记、经颅多普勒等,但动态CT血管造影在目前被认为是无创检查中最具优势的评价方法[11-13]。
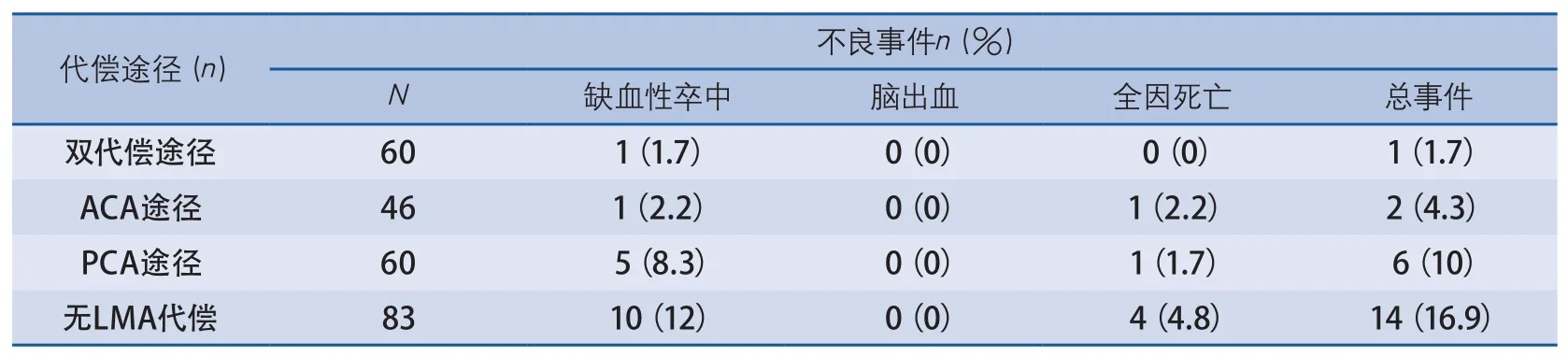
表2 不同代偿途径各不良事件分布情况

图1 不同途径代偿患者缺血性卒中复发比较
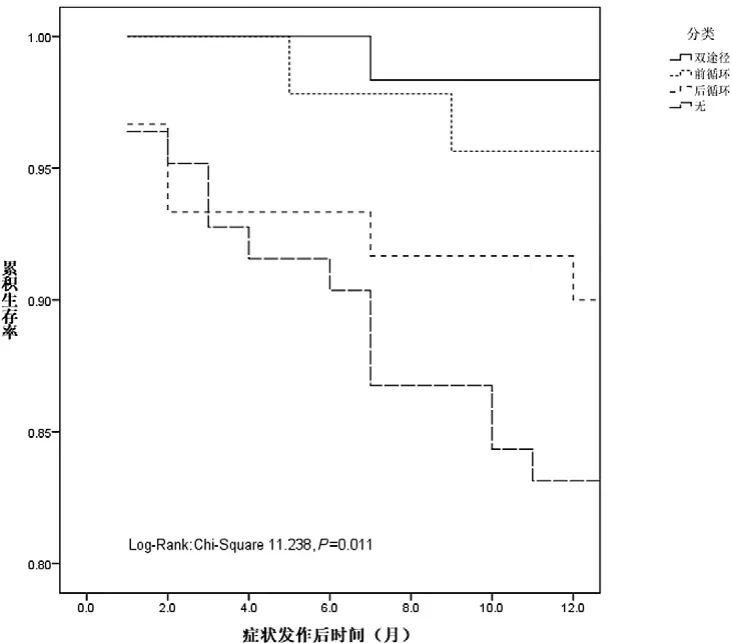
图2 不同途径代偿患者总事件的比较
有联合经颅多普勒(transcranial Doppler sonography,TCD)及MRA的研究发现:存在ACA来源或ACA和PCA双重来源的LMA代偿者,发病21 d时美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评分改善良好,而无代偿或仅通过PCA源LMA代偿者改善不明显,提示了LMA代偿重要性,同时说明MCA狭窄时ACA代偿较PCA代偿更为重要[14]。华法林和阿司匹林治疗症状性颅内疾病的研究组分析:在287例颅内动脉狭窄的患者中(84例为MCA狭窄或闭塞),侧支循环良好者与侧支循环差者相比,缺血性卒中发生的危险比:单变量分析时为4.36,多变量分析时为4.78[1]。良好的LMA代偿可以改善脑梗死患者急性期功能:改良Rankin量表(modified Rankin Scale,mRS)评分降低或mRS评分小于2的比例、NIHSS评分,减小了梗死面积,扩大急性期错配面积、减小24 h后梗死面积扩展等[15]。Ashfaq Shuaib[9]在通过对不同研究结论的再分析后认为:在脑内主要大动脉闭塞后数小时内侧支循环可以稳定脑组织血流,增加和维持LMA代偿血流是急性脑梗死一个潜在的治疗靶点。在MCA狭窄或闭塞时LMA可以提供一定的前向血流,维持缺血组织(皮层)的部分血供,避免部分缺血半暗带组织进展为不可逆性细胞死亡阶段;近期研究表明,在前循环梗死的静脉溶栓患者中,良好侧支循环患者3个月mRS评分0~2分比例显著高于对照组,优势比(odds ratio,OR)为9.3,95%可信区间(confidence interval,CI)为2.4~35.8[16]。而基于量化的Careggi Collateral Score评分系统[17],亦能很好预测前循环脑梗死3个月预后,并被推荐为血管内治疗患者预后良好的评价工具。良好的侧支循环具有有效的保护作用。所以,对伴MCA狭窄或闭塞的脑梗死患者动静脉溶栓前,对LMA代偿状况进行充分的评价就显得尤为重要。本组病例中,与无LMA代偿组相比,存在LMA代偿的症状性MCA狭窄或闭塞患者1年内缺血性卒中、总的不良事件复发明显减少;在全因死亡方面,虽未达统计学意义,但LMA代偿病例组亦高于无LMA代偿组,双途径LMA代偿有益作用更为明显。
虽有借助TCD研究证实双途径LMA代偿功能预后优于无LMA代偿[14]。但到目前为止还没有专门针对MCA狭窄或闭塞后基于MRA评价不同途径或程度的LMA对同侧缺血性脑血管病复发或死亡影响的临床研究。症状性MCA粥样硬化狭窄或闭塞患者缺血性卒中年再发率达9.1%,远高于非症状组的1.4%,提示MCA狭窄或闭塞本身的特点决定着卒中的复发[18]。本研究发现病变血管同侧缺血性卒中在第1年的复发率为6.83%,与上述研究相比较低。本研究提示:PCA途径及ACA途径的LMA代偿对缺血性卒中复发的影响并无显著差异;与无LMA代偿组相比,PCA或ACA来源的单途径LMA代偿减少缺血性卒中复发均未达到统计学意义,只有双途径代偿才能有效减少缺血性卒中复发。一般认为:在MCA闭塞或严重狭窄时,来源于ACA的LMA代偿血流占优势,故其在避免缺血性卒中复发方面存在一定优势。但MCA闭塞或狭窄时,供血区远端血流严重受限,PCA或ACA途径LMA虽然发挥一定的代偿作用,但单一途径LMA代偿作用并不充分,因此对全部的缺血性卒中复发并不能起到完全的阻止作用。
本研究证实LMA对症状性MCA狭窄或闭塞患者远期脑出血事件并无影响,提示不同LMA途径代偿及LMA状态与自发性脑出血事件无关。不同LMA代偿虽然影响脑梗死急性期出血转化的发生,但目前尚无LMA与脑出血关系的报道。自发性脑出血多位于穿支动脉区或脑叶内,而LMA对穿支动脉血流影响有限,且不能改变穿支动脉本身结构,对出血的病理生理学无实质影响。
在1年随访期间内,全部的249例患者中仅6例死亡,死亡率为2.4%。对比发现全因死亡在不同LMA途径代偿组之间并无显著差异,因此认为不同途径LMA代偿对症状性MCA狭窄或闭塞患者1年内全因死亡无影响。对于症状性MCA狭窄或闭塞的缺血性卒中患者1年内的全因死亡率,目前的报道并不太高:一组韩国患者资料表明症状性MCA狭窄或闭塞患者1年内死亡率为2.9%[19],略高于本研究。从死亡原因上看,本研究无脑血管病源性死亡,可能是全因死亡率较低的一个原因。
有研究显示,在规范治疗前提下,孤立的MCA狭窄或闭塞的卒中患者1年内缺血性卒中和全因死亡总的发生率为14.0%[20],高于本研究的9.24%(23/249),可能与其纳入病例时间范围较窄有关(症状发作7 d内),由于部分重症症状性MCA狭窄或闭塞的脑梗死患者在急性期存在较高的死亡风险,而本组病例入选时间更宽泛,可能是死亡例数较少的原因之一。本研究表明:存在LMA代偿时,总的不良事件发生率明显减低,与无LMA代偿相比,ACA或PCA单途径代偿、双途径代偿均能有效减少总的不良事件的发生。
本研究虽为前瞻性随访研究,但是存在较多局限:本研究采用3D-TOF法MRA评价MCA狭窄或闭塞,由于MRA主要是利用血液的流空效应来对血管进行显示,所以它对慢流速血流不敏感,存在一定的病变夸大效应,会造成假阴性或假阳性。与采用DSA相比,存在一定的差距;其次MRA对LMA的评价仅采用定性的方法,未将LMA定量或半定量分析,无法确切反映LMA的实际代偿能力;再次,纳入的病例数有限,分组后实际病例数与设计时有一定差距,存在一定的偏倚;对所有入组的患者随访期间未进行统一的、规范的药物干预,对包括药物在内的影响卒中后不良事件的因素未进一步分析;MCA闭塞后除了LMA代偿外,还有脑膜中动脉等少见的代偿,本研究未加考虑;最后,本研究随访时间短,无法全部显示出不良事件的长期结果。
1 Liebeskind DS, Cotsonis GA, Saver JL, et al.Collateral dramatically alter stroke risk in intracranial astherosclerosis[J]. Ann Neurol, 2011, 69:963-974.
2 Easton JD, Saver JL, Albers GW, et al. Definition and evaluation of transient ischemic attack[J]. Stroke,2009, 40:2276-2293.
3 中华神经科学会, 中华神经外科学会. 各类脑血管疾病诊断要点[J]. 中华神经科杂志, 1996, 29:379-380.
4 Samuels OB, Joseph GJ, Lynn MJ, et al. A standardized method for measuring intracranial arterial stenosis[J]. AJNR Am J Neuroradiol, 2000,21:643-646.
5 向先俊, 邹立秋, 刘鹏程, 等. 3D-TOF MRA对大脑中动脉闭塞后侧枝循环及其与脑梗死相关性研究[J]. 中国CT和MRI杂志, 2011, 39:4-7.
6 中国高血压防治指南修订委员会. 2004年中国高血压防治指南(实用本)[J]. 中华心血管病杂志, 2004,32:1060-1064.
7 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2007年版)[J]. 中华医学杂志, 2008, 88:1227-1245.
8 赵水平, 胡大一. 心血管病诊疗指南解读[M]. 北京:人民卫生出版社, 2004:248-263.
9 Shuaib A, Butcher K, Mohammad AA, et al.Collaterals blood vessels in acute ischemic stroke:a potential therapeutic target[J]. Lancet Neurol, 2011,10:909-921.
10 Uemura A1, O'uchi T, Kikuchi Y, et al. Prominent laterality of the posterior cerebral artery at threedimensional time-of-flight MR angiography in M1-segment middle cerebral artery occlusion[J]. AJNR Am J Neuroradiol, 2004, 25:88-91.
11 Martinon E, Lefevre PH, Thouant P, et al. Collateral circulation in acute stroke:Assessing methods and impact:A literature review[J]. J Neuroradiol, 2014,41:97-107.
12 孙勇, 魏微, 李莹, 等. CTA MIP对急性大脑中动脉闭塞脑梗死侧支循环及预后的评估[J]. 中风与神经疾病杂志, 2014, 31:196-199.
13 Liu LP, Xu AD, Wong LKS, et al. Chinese consensus statement on the evaluation and intervention of collateral circulation for ischemic stroke[J]. CNS Neurosci Ther, 2014, 20:202-208.
14 王利, 王长德, 肖辉, 等. 大脑中动脉供血区梗死侧支循环与神经功能[J]. 山东医药, 2011, 9:10-12.
15 Miteff F, Levi CR, Bateman GA, et al. The independent predictive utility of computed tomography angiographic collateral status in acute ischemic stroke[J]. Brain, 2009, 132:2231-2238.
16 Saarinen JT, Rusanen H, Sillanpää N. Collateral score complements clot location in predicting the outcome of intravenous thrombolysis[J]. AJNR Am J Neuroradiol, 2014, 41:97-107.
17 Mangiafico S, Consoli A, Renieri L, et al. Semiquantitative and qualitative evaluation of pial leptomeningeal collateral circulation in acute ischemic stroke of the anterior circulation:the Careggi Collateral Score[J]. Ital J Anat Embryol, 2013,118:277-287.
18 Kern R, Steinke W, Daffertshofer M, et al. Stroke recurrence in patients with symptomatic vs asymptomatic middle cerebral artery disease[J].Neurology, 2005, 65:859-864.
19 Kang BS, Kwon HM, Ryu WS, et al. Prognosis of symptomatic and asymptomatic middle cerebral artery occlusion[J]. Cerebrovasc Dis, 2008, 26:489-493.
20 Oh MS, Yu KH, Chu MK, et al. Long-term prognosis of symptomatic isolated middle cerebral artery disease in Korean stroke patients[J]. BMC Neurol,2011, doi:10.1186/1471-2377-11-17.

