实时三维超声心动图评估二尖瓣反流严重程度的方法
王吴刚(综述) 王 浩(审校)
实时三维超声心动图评估二尖瓣反流严重程度的方法
王吴刚(综述) 王 浩(审校)
二尖瓣闭锁不全;超声心动描记术,三维;综述
二尖瓣反流(mitral regurgitation, MR)是心血管疾病中最常见的病理生理现象之一[1],中至重度MR可以进展为左心室功能不全,而未经治疗、无症状的MR患者5年内心血管疾病病死率为14%[2]。外科治疗可以显著改善MR患者的预期寿命[2,3]。MR患者的危险分层、预后预测及手术时机的选择均依赖对疾病严重程度的准确评估,实时三维超声心动图(real-time three-dimensional echocardiography, RT3DE)为精确评估MR的严重程度提供了新的工具。
早期三维彩色多普勒血流成像是采用门控的方法,应用机械旋转的经胸壁探头或电子驱动的经食管探头采集图像。这种方法需要二尖瓣反流束位于扇形图像的中央区域,于患者呼气末和心电图门控下180°范围内每隔3°~5°旋转探头,连续采集二维彩色多普勒血流图像;之后将获得的二维图像输入计算机三维重建工作站,依据心电图用帧频捕捉器确定用于重建的二维图像。三维重建二尖瓣反流束可以评估反流束的方向、形态、与周围结构的关系,甚至可以评估二尖瓣反流束的体积。然而该方法采集时间较长,可能会导致呼吸和运动伪像;且三维重建过程复杂、耗时,所以临床应用受限。
近年来,随着电子技术、全容积矩阵型三维探头技术及图像后处理技术的发展,RT3DE对MR严重程度的评估已取得长足的进展。目前RT3DE评估MR严重程度的指标主要有:①二尖瓣反流束的最小截面宽度(vena contracta width, VCW)或者二尖瓣反流束最小截面面积(vena contracta area, VCA);②采用三维近端等速表面积(proximal isovelocity surface area, PISA)法测量的有效反流口面积(effective regurgitant orifce area, EROA);③采用三维重建法测量的解剖反流口面积(anatomic regurgitation orifce area, AROA);④MR体积及反流分数;⑤三维重建反流束形态及体积。
1 RT3DE平面法测量VCW或VCA
VCW在评估EROA的基础上对MR严重程度进行分级[4]。二维超声心动图评估VCA只能在左心室长轴或心尖切面测量,应用圆形或椭圆形的几何假设,将VCW代入相关公式计算VCA,其受VCW的影响[5,6]。大多数MR,尤其是功能性MR,二尖瓣反流束最小截面的横截面是非圆形,或不规则形的[6]。因而,二维超声心动图利用假设几何模型代入VCW计算的VCA与真实的VCA之间存在差异,影响对MR严重程度的评估。RT3DE可以对二尖瓣反流束进行三维成像,将图像进行多平面重建及切割后,在短轴切面应用平面法描绘反流束彩色多普勒血流信号轮廓直接计算VCA(图1)。评估MR严重程度时,RT3DE平面法测量的VCA较二维超声更准确[7-9]。RT3DE平面法测量的VCA界值定为0.41 cm²,可以将重度MR和中度MR区分,其敏感度为82%,特异度为96%[9]。
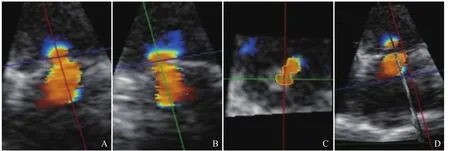
图1 RT3DE平面法测量VCA。A、B.三维重建及切割后显示的不同切面二尖瓣反流束的最小截面宽度;C.短轴切面描绘反流束彩色多普勒血流信号轮廓,可以直接测量VCA;D.三维模式显示二尖瓣反流束
RT3DE平面法的优势在于,测量VCA时无需任何几何学假设,这对功能性MR尤其适用,因为在功能性MR中,反流口呈细裂缝状,沿二尖瓣闭合线延伸;另外,对于反流口是非圆形的MR,该方法同样适用[5,6]。与二维超声测量的EROA或VCW相比,RT3DE平面法测量的VCA可能对
2 RT3DE PISA法测量EROA
理论上,RT3DE PISA法的优势是可以在三维空间的三个平面对PISA的不同径线(宽度、长度和半径)进行测量(图2)[12];或应用三维导航,获取PISA的最大半径,而无需对PISA形态进行几何学假设[6,13]。对RT3DE PISA法的研究多以二维超声心动图为参考标准,该标准内在的局限性限制了RT3DE PISA法的准确性[14-16]。近来,de Agustín等[17]应用单心动周期RT3DE PISA法评估MR的严重程度,以经食管RT3DE平面法测量的EROA为参考标准,发现二维PISA法始终低估EROA,尤其是对偏心性MR;而RT3DE PISA法与参考方法相比,相关性较好(r=0.99)。
虽然RT3DE可以直接测量PISA的宽度、长度和半径,改进PISA法评估EROA的准确性,但其仍需要对PISA的几何形态进行假设[14-16]。在Little等[18]和Matsumura等[15]尝试获取三维PISA面积的研究中,前者在体外模型中通过测量PISA的多个径向平面以重建PISA的面积;后者通过测量PISA的多条径线以重建PISA的面积,但这两者对PISA的重建过程耗时耗力。一些新的研究应用软件自动量化PISA的面积,结果的准确性仍需要进一步证实[19,20]。另外,RT3DE PISA法的多普勒角度依赖问题及EROA动态变化问题仍旧未解决[11,12]。

图2 RT3DE测量PISA法的不同径线。A. D1示PISA的宽度;B. D2示PISA的长度,D3示PISA的半径;C. 短轴切面示PISA的三维形态;D.三维模式示二尖瓣反流束
3 RT3DE平面法测量AROA
通过对三维数据集的切割及重建,可以获取显示解剖反流口的短轴切面,在该切面上应用RT3DE平面法可以测量AROA。Hamada等[21]以MRI测量的MR体积为参考标准,采用RT3DE平面法测量AROA,计算MR体积,结果显示该法趋于高估MR体积(平均高估约20 ml)。需要注意的是,理论上AROA大于EROA[22]。
RT3DE在短轴切面重建解剖反流口,用平面法测量AROA,评估MR严重程度,可以对多个解剖反流口进行测量,将测量结果相加,并且不需要对血流动力学或反流口的几何学形态进行假设。然而,RT3DE平面法测量AROA面临对心动周期测量时相的选择、获取最好的解剖反流口短轴切面以及三维图像的有缝拼接等问题[11,12]。
4 RT3DE测量MR体积及反流分数
RT3DE测量的VCA、EROA或者AROA分别乘以MR速度时间积分可以用来评估MR体积。RT3DE测量左心室舒张与收缩末期容积之差可以用来评估舒张期二尖瓣前向血流体积,MR体积除以二尖瓣前向血流体积即为MR反流分数。另外,也可以应用RT3DE测量的左心室搏出体积结合二维超声心动图测量的左心室流出道搏出体积计算MR体积和MR分数[4]。
RT3DE测量的二尖瓣及左心室流出道前向血流体积即为MR体积[23]。RT3DE计算二尖瓣环及左心室流出道横截面积是基于彩色多普勒在每个瓣口的三维空间分配,再结合彩色多普勒的速度分配计算经过每个瓣口的前向血流体积。与二维多普勒方法相比,RT3DE计算结果更准确,重复性更好[23,24]。这种新的三维彩色多普勒技术量化评估左心室搏出体积有着独特的优势;①脉冲多普勒测量瓣口血流速度时,取样容积范围一般在2~5 mm,而新方法综合了经过二尖瓣环或左心室流出道的所有血流速度成分计算左心室搏出体积[23,24];②不用对二尖瓣环或左心室流出道的几何形态进行假设;③新方法的自动角度校正技术或半球形的取样平面可以克服彩色多普勒血流的角度依赖性;④新方法手动或自动的混叠算法可以克服彩色多普勒混叠现象。
虽然RT3DE很适合评估MR体积和MR分数,但其仍然具有局限性:①只在单纯MR患者中经过验证,在MR伴随其他相关病变时准确性有待证实;②在经过主动脉瓣和二尖瓣的血流速度升高时,自动或手动混叠算法的准确性并未得到验证;③三维彩色多普勒图像采集仍旧受限于帧频较低,若患者心率过快,会造成数据准确性降低;④仪器的侧向分辨率、组织优先设置、二尖瓣环或左心室流出道不完整的彩色多普勒数据采集均会影响这种方法的准确性[4]。因此,在其应用于临床量化评估MR之前,仍需要进一步研究。
5 GI3DQ法测量二尖瓣反流束体积
随着探头技术及软件技术的发展,RT3DE可以直接测量二尖瓣反流束体积。近来,Sugeng等[25]应用TomTec GmbH软件,将二尖瓣反流束分为8个等角度的切面,进行反流束重建和体积测量,以PISA法计算的MR体积作为对照,结果显示二者具有相关性(r=0.7);RT3DE直接测量二尖瓣反流束体积评估MR体积较PISA法平均低估约8 ml。我们采用全身成像三维量化(general imaging three-dimensional quantifcation, GI3DQ)法将二尖瓣反流束分为15个等厚度的薄切片平面,进行反流束重建和体积测量(图3),结果发现,中心性MR组GI3DQ法和参考方法相比轻微低估MR体积(r=0.956, P<0.05;平均低估0.38 ml);偏心性MR组GI3DQ法和参考方法相比明显低估MR体积(r=0.914, P<0.05;平均低估约10.55 ml)。
采用GI3DQ法测量二尖瓣反流束体积评估MR体积的优势在于:不受主动脉瓣反流的影响;不用对反流束进行几何学假设,适用于任意形状的体积测量。需要注意的是,该方法评估MR体积时,一定要选择心动周期二尖瓣反流束最大时相测量,否则容易低估MR的严重程度。该方法的局限性在于:①三维彩色多普勒显像帧频较低,且触发的采集模式会产生时间上的伪差,可能造成血流信号的部分丢失,从而引起低估。②由于该方法主要是对反流束进行分析,因此,Coanda效应可能会低估偏心性反流束体积[26]。
总之,RT3DE评估MR的指标和方法部分弥补了二维彩色多普勒超声心动图的缺陷,提高了MR的评估精确度;但RT3DE评估MR严重程度依旧面临许多问题,而且RT3DE评估MR严重程度的指标并未在临床上获得广泛验证。相信随着电子技术、超声探头技术及软件技术的发展以及相关研究的进一步深入,RT3DE在评估MR严重程度方面会发挥越来越重要的作用。参考文献

图3 GI3DQ法测量二尖瓣反流束体积。A.二尖瓣反流束被分为15个等厚度的薄切片平面;B.在每一切面描绘二尖瓣反流束横截面积;C.二尖瓣反流束二维形态;D.二尖瓣反流束三维立体形态
[1] Nkomo VT, Gardin JM, Skelton TN, et al. Burden of valvular heart diseases: a population-based study. Lancet, 2006, 368(9540): 1005-1011.
[2] Enriquez-Sarano M, Avierinos JF, Messika-Zeitoun D, et al. Quantitative determinants of the outcome of asymptomatic mitral regurgitation. N Engl J Med, 2005, 352(9): 875-883.
[3] Tribouilloy CM, Enriquez-Sarano M, Schaff HV, et al. Impact of preoperative symptoms on survival after surgical correction of organic mitral regurgitation: rationale for optimizing surgical indications. Circulation, 1999, 99(3): 400-405.
[4] Thavendiranathan P, Phelan D, Thomas JD, et al. Quantitative assessment of mitral regurgitation: validation of new methods. J Am Coll Cardiol, 2012, 60(16): 1470-1483.
[5] Marsan NA, Westenberg JJ, Ypenburg C, et al. Quantifcation of functional mitral regurgitation by real-time 3D echocardiography: comparison with 3D velocity-encoded cardiac magnetic resonance. JACC Cardiovasc Imaging, 2009, 2(11): 1245-1252.
[6] Kahlert P, Plicht B, Schenk IM, et al. Direct assessment of size and shape of noncircular vena contracta area in functional versus organic mitral regurgitation using real-time three-dimensional echocardiography. J Am Soc Echocardiogr, 2008, 21(8): 912-921.
[7] Shanks M, Siebelink HM, Delgado V, et al. Quantitative assessment of mitral regurgitation: comparison between threedimensional transesophageal echocardiography and magnetic resonance imaging. Circ Cardiovasc Imaging, 2010, 3(6): 694-700.
[8] Yosefy C, Hung J, Chua S, et al. Direct measurement of vena contracta area by real-time 3-dimensional echocardiography for assessing severity of mitral regurgitation. Am J Cardiol, 2009, 104(7): 978-983.
[9] Zeng X, Levine RA, Hua L, et al. Diagnostic value of vena contracta area in the quantifcation of mitral regurgitation severity by color Doppler 3D echocardiography. Circ Cardiovasc Imaging, 2011, 4(5): 506-513.
[10] Little SH, Pirat B, Kumar R, et al. Three-dimensional color Doppler echocardiography for direct measurement of vena contracta area in mitral regurgitation: in vitro validation and clinical experience. JACC Cardiovasc Imaging, 2008, 1(6): 695-704.
[11] Buck T, Plicht B, Kahlert P, et al. Effect of dynamic fow rate and orifce area on mitral regurgitant stroke volume quantifcation using the proximal isovelocity surface area method. J Am Coll Cardiol, 2008, 52(9): 767-778.
[12] Yosefy C, Levine RA, Solis J, et al. Proximal flow convergence region as assessed by real-time 3-dimensional echocardiography: challenging the hemispheric Assumption. J Am Soc Echocardiogr, 2007, 20(4): 389-396.
[13] Matsumura Y, Saracino G, Sugioka K, et al. Determination of regurgitant orifice area with the use of a new three-dimensional flow convergence geometric assumption in functional mitral regurgitation. J Am Soc Echocardiogr, 2008, 21(11): 1251-1256.
[14] Plicht B, Kahlert P, Goldwasser R, et al. Direct quantifcation of mitral regurgitant flow volume by real-time three-dimensional echocardiography using dealiasing of color Doppler flow at the vena contracta. J Am Soc Echocardiogr, 2008, 21(12): 1337-1346.
[15] Matsumura Y, Fukuda S, Tran H, et al. Geometry of the proximal isovelocity surface area in mitral regurgitation by 3-dimensional color Doppler echocardiography: difference between functional mitral regurgitation and prolapse regurgitation. Am Heart J, 2008, 155(2): 231-238.
[16] Altiok E, Hamada S, van Hall S, et al. Comparison of direct planimetry of mitral valve regurgitation orifice area by threedimensional transesophageal echocardiography to effective regurgitant orifice area obtained by proximal flow convergence method and vena contracta area determined by color Doppler echocardiography. Am J Cardiol, 2011, 107(3): 452-458.
[17] de Agustín JA, Marcos-Alberca P, Fernandez-Golfin C, et al. Direct measurement of proximal isovelocity surface area by singlebeat three-dimensional color Doppler echocardiography in mitral regurgitation: a validation study. J Am Soc Echocardiogr, 2012, 25(8): 815-823.
[18] Little SH, Igo SR, Pirat B, et al. In vitro validation of real-time three-dimensional color Doppler echocardiography for direct measurement of proximal isovelocity surface area in mitral regurgitation. Am J Cardiol, 2007, 99(10): 1440-1447.
[19] Thavendiranathan P, Liu S, Datta S,et al. Automated quantifcation of mitral inflow and aortic outflow stroke volumes by threedimensional real-time volume color-flow Doppler transthoracic echocardiography: comparison with pulsed-wave Doppler and cardiac magnetic resonance imaging. J Am Soc Echocardiogr, 2012, 25(1): 56-65.
[20] Grady L, Datta S, Kutter O, et al. Regurgitation quantification using 3D PISA in volume echocardiography. Med Image Comput Comput Assist Interv, 2011, 14(Pt 3): 512-519.
[21] Hamada S, Altiok E, Frick M, et al. Comparison of accuracy of mitral valve regurgitation volume determined by three-dimensional transesophageal echocardiography versus cardiac magnetic resonance imaging. Am J Cardiol, 2012, 110(7): 1015-1020.
[22] Chandra S, Salgo IS, Sugeng L, et al. A three-dimensional insight into the complexity of flow convergence in mitral regurgitation: adjunctive benefit of anatomic regurgitant orifice area. Am J Physiol Heart Circ Physiol, 2011, 301(3): H1015-H1024.
[23] Thavendiranathan P, Liu S, Datta S,et al. Automated quantifcation of mitral inflow and aortic outflow stroke volumes by threedimensional real-time volume color-flow Doppler transthoracic echocardiography: comparison with pulsed-wave Doppler and cardiac magnetic resonance imaging. J Am Soc Echocardiogr, 2012, 25(1): 56-65.
[24] Lodato JA, Weinert L, Baumann R, et al. Use of 3-dimensional color Doppler echocardiography to measure stroke volume in human beings: comparison with thermodilution. J Am Soc Echocardiogr, 2007, 20(2): 103-112.
[25] Sugeng L, Weinert L, Lang RM. Real-time 3-dimensional color Doppler fow of mitral and tricuspid regurgitation: feasibility and initial quantitative comparison with 2-dimensional methods. J Am Soc Echocardiogr, 2007, 20(9): 1050-1057.
[26] Chao K, Moises VA, Shandas R, et al. Infuence of the Coanda effect on color Doppler jet area and color encoding. In vitro studies using color Doppler fow mapping. Circulation, 1992, 85(1): 333-341.
R453;R445.1
国家自然科学基金面上项目(81071161)。
北京协和医学院,中国医学科学院心血管病研究所,阜外心血管病医院超声科 北京 100037
王 浩 E-mail: fwanghao@sina.cn患者MR严重程度的分类更为精确[7-9]。RT3DE平面法评估VCA仍具有局限性:①由于空间分辨率的限制,三维重建及切割平面时可能会得到较小的反流口面积或EROA[7,10];②心动周期收缩期测量时相的选择依赖于MR的病因,可能会影响RT3DE平面法对VCA的评估,从而使研究者之间产生较大的变异[11];③RT3DE平面法测量VCA时需要多平面三维重建,以获取切割平面,可能影响VCA的测量结果;该影响对偏心性MR尤其显著,因为当MR高度偏心时,若切割平面不正交,则会高估VCA[4];④RT3DE平面法测量VCA其实测量的是反流束最小截面的彩色多普勒反流信号的轮廓,因此,若彩色多普勒反流信号渗入到周围的灰阶图像中,则会高估VCA[4];⑤RT3DE平面法主要采用触发的采集模式,可能产生时间伪差,导致由若干个亚容积组成的全容积图像出现有缝拼接,从而影响VCA测值,虽然无缝拼接RT3DE技术可以克服这些缺点,但其空间和时间分辨率尚未达到分析要求[4]。
2013-05-29
2013-10-24
(责任编辑 唐 洁)
10.3969/j.issn.1005-5185.2014.01.014

