BTEX污染含水层中氧化还原环境的空间变化
苏 燕,孙 超,赵勇胜,周 睿,王 霄,生 贺
(吉林大学a.地下水资源与环境教育部重点实验室;b.环境与资源学院环境工程,长春 130021)
BTEX污染含水层中氧化还原环境的空间变化
苏 燕a,孙 超a,赵勇胜b,周 睿b,王 霄a,生 贺a
(吉林大学a.地下水资源与环境教育部重点实验室;b.环境与资源学院环境工程,长春 130021)
采用一维柱实验模拟方法,研究了地下水受BTEX污染过程初期,含水层中顺序氧化还原环境的空间变化规律,并对模拟柱不同高度出水中BTEX各组分的浓度进行监测。结果表明,模拟柱中各氧化还原灵敏性指标的浓度分布呈现以下规律:距离污染源80~98 cm处的氧还原环境较强;60~80 cm之间硝酸盐还原环境较强;35~60 cm之间以铁还原环境为主;24~50 cm之间形成硫酸盐还原环境;0~30 cm处HCO-3的浓度最低则产甲烷作用较明显。BTEX各组分从模拟柱底部至顶部呈急剧减少规律,其中苯、甲苯、乙苯、对二甲苯和间邻二甲苯的去除率分别达到99.94%、99.96%、99.94%、99.49%和98.3%。
地下水;BTEX;自然衰减;氧化还原条件
苯、甲苯、乙苯和二甲苯(简称BTEX)是石油化工原料的重要组成部分,来源于燃料油,广泛存在于地下储油罐泄露和石油加工冶炼工厂管道等的泄露处土壤和地下水中,同时在垃圾填埋场所产生的渗滤液中也大量存在[1]。它们作为重要的工业原料,在开采、储存、运输和加工的过程中正在以各种不同的方式威胁着地下水的安全[2]。
自然衰减也称作内在的或被动的修复,根据目标污染物最终去向的不同被学者们冠以很多方面的解释[3-5],通常的定义是:在没有任何人为干扰的情况下,由于物理的、化学的、生物的或者生物化学的作用使污染物质的毒性和数量降低或进行迁移转化使其浓度减少的过程[6]。许多学者证实在地下环境中存在着BTEX的自然衰减作用,使BTEX各污染组分浓度降低同时也使BTEX污染地下水的污染羽的扩散速度降低[7-8]。另一些学者通过向包气带和含水层中通入氧气,添加营养和电子受体等方式来强化BTEX自然衰减。然而针对BTEX在含水层中生物地球化学作用的机理鲜有报道。中国在对地下环境有机污染的治理问题上的研究刚刚开始,这些研究大多从水文地质角度对有机物锋面运移、分布规律、锋面扩展和透镜体形状进行模型模拟与试验模拟,很少从生物地球化学角度对污染物迁移转化规律进行分析。本研究通过设置室内模拟柱实验,得出在BTEX污染初期阶段BTEX各组分的空间衰减规律及氧化还原灵敏性指标的空间变化规律以及定量的分析BTEX各污染组分在模拟柱空间上的衰减规律。从而得出BTEX在含水层中生物地球化学作用下得衰减情况,为研究BTEX在含水层中的自然衰减提供依据。
1 材料及方法
1.1 供试材料
所用地下水取自某省宾馆,实验所用BTEX污染地下水是实验室配制水,在地下水中加入BTEX各组分,模拟进水的p H是7.12,性质如表1所示。实验所用介质取自东北某市农田旁的细砂,经过风干后装填模拟柱,其性质如表2所示。
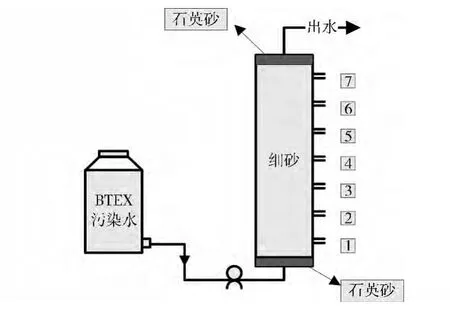
图1 实验装置图

表1 BTEX污染地下水理化性质 mg·L-1
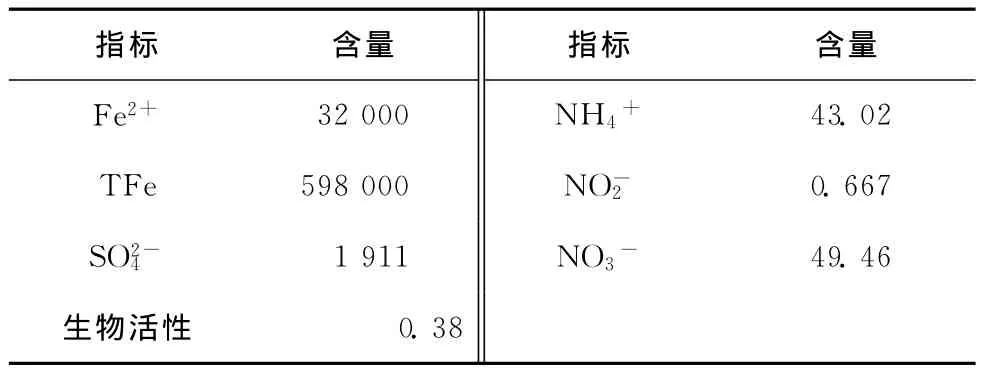
表2 细砂的理化性质 mg·kg-1
1.2 实验装置与方法
实验装置是一个长98 cm,内径14 cm有机玻璃柱,模拟柱底端用乳胶管经蠕动泵与上部的马氏瓶相连。模拟柱从下而上装填1 cm石英砂,98 cm风干后的细砂和1 cm石英砂,在模拟柱顶部和底部设有衬网以均匀布水,模拟柱侧部均匀布置七个取样孔,侧面各取样口1、2、3、4、5、6、7分别距进水口11、24、37、50、63、76、89 cm,以检测模拟柱不同位置氧化还原灵敏性指标的变化,实验装置如图1所示。为了避免污染物质的光解,整个模拟柱均用黑色聚乙烯薄膜包裹,马氏瓶选用棕色试剂瓶。实验进水方式由下向上,流速为8 cm/d,进水为实验室配制BTEX污染地下水,实验过程中模拟柱一直处于饱水状态,出水从模拟柱顶部出水孔流出。取样过程中应密封取样,防止溶解氧和氧化还原电位的变化。实验以7 d为一个周期,分别对各个取样孔中溶解氧、N和N、Fe3+和Fe2+、氧化还原电位、S和S2-、HC、BTEX等进行分析,在实验进行至143 d时,得到模拟柱中各氧化还原灵敏性指标的空间变化规律以及BTEX各组分的空间变化情况。
1.3 水样分析方法
水样中BTEX各组分的浓度采用气相色谱法分析[9],分析条件是:采用岛津 GC 2010进行测样,进样口温度200℃;检测器温度:220℃;分流进样,分流比为2∶ 1;载气:氮气,纯度99.999%;程序升温:初始温度60℃,保持1 min,5℃/min升温至105℃;每次进样1μL。N、N、Fe3+、Fe2+、S、S2-和HCO3-等灵敏性指标根据水和废水监测分析方法(四)进行测定。p H和ORP分别用p H计和ORP仪进行监测。
2 结果分析和讨论
2.1 模拟柱中氧化还原灵敏性指标的空间分布规律
2.1.1 溶解氧和氧化还原电位的空间变化情况 溶解氧的空间变化情况如图2所示。原水中溶解氧是7.92,而距离进水口11 cm处降到3.1,从污染源到距离进水口76 cm处,溶解氧的含量逐渐减少,表明好氧微生物在此过程中利用溶解氧降解BTEX各组分。靠近取样口处溶解氧含量受外界干扰较大,导致溶解氧在89 cm处再次升高。资料表明,利用土著微生物降解有机物为无机物质,必须依靠外部电子受体,此时溶解氧作为电子受体具有较低能量容易得到电子,从而为微生物的生长保存能量[10]。模拟柱中溶解氧的空间变化说明好氧微生物利用原水中的溶解氧作为电子受体来降解BTEX各组分。
氧化还原电位(ORP)是指示环境氧化还原条件变化的最直接指标,模拟柱各取样孔的氧化还原电位变化如图2所示。从进水口到污染羽的边缘呈逐渐升高的趋势,由于BTEX进入模拟柱后,微生物利用其作为碳源和能源并将电子传递给系统中的氧化性物质,如N、Fe3+、S、O2等,从而生成还原性物质,如N、Fe2+、S2-、H2O等,同时BTEX各组分被氧化去除。可见在BTEX污染区域内污染越重,ORP越低,偏向于还原环境;污染越轻,ORP越高,还原环境逐渐减弱。

图2 模拟柱出水中溶解氧和ORP空间变化曲线

图3 模拟柱出水中NO-3和NO-2的空间变化曲线
2.1.3 出水中Fe3+和Fe2+的空间变化情况 图4是Fe3+和Fe2+在模拟柱中的空间变化规律。原水中Fe3+的浓度是0.15 mg/L,Fe2+并未检出。在进水过程中介质中的Fe(Ⅲ)溶出,使溶液中的Fe3+在距离进水口11 cm处达到最大值0.225 mg/L。在距离进水口20~50 cm处Fe3+浓度逐渐减少并达到0.15 mg/L,而这个范围内的Fe2+的浓度逐渐增大并达到最大值0.117 mg/L,可见在此过程中介质中的微生物利用BTEX各组分为碳源和能源将Fe3+还原为Fe2+。而后Fe3+升高主要是溶出了介质中的Fe(Ⅲ)所致。Fe2+的下降是由于它与S2-结合生成了FeS沉淀的缘故,这种作用又促使Fe3+向着转化为Fe2+的方向移动从而使Fe3+减少,Fe2+增高。由此可知,在35~60 cm处Fe(Ⅲ)还原作用较明显。Fe(Ⅲ)是地下环境中存在的最丰富的电子受体之一,因此微生物很容易利用其作为电子受体降解 BTEX 各组分[11]。
2.1.1与2.1.2中所述的O2和NO-3还原作用较明显是距离进水口60 cm以上部分,而Fe(Ⅲ)还原作用较明显的区域是距离进水口35~60 cm处,原因主要是O2和NO-3可以抑制兼性厌氧Fe(Ⅲ)还原微生物的作用。由于微生物对O2的优先利用主要是获能上的优势。而NO-3对Fe(Ⅲ)还原的作用抑制可能是由于其产生的NO-2将生成的Fe(Ⅱ)氧化成为Fe(Ⅲ)的缘故[12]。还有研究者发现在添加NO-3之后乙酸盐与丁酸盐的生成会延迟[13],而乙酸盐又是某种Fe(Ⅲ)还原微生物利用的电子供体,因此NO-3延缓了Fe(Ⅲ)还原作用。
2.1.4 出水中SO2-4和S2-的空间变化情况 研究得出模拟柱出水中SO2-4和S2-的空间变化情况,如图5所示。原水中的SO2-4的浓度是25.3 mg/L,S2-并未检出。在模拟柱进水口0~11 cm之间,99%的BTEX由于吸附作用以及氧还原、硝酸盐还原、Fe(Ⅲ)还原等生物地球化学作用发生衰减,距离进水口11 cm处,SO24-的浓度升高至68 mg/L,11~50 cm之间SO24-的浓度逐渐降低,直到50 cm处达到最低值41.9 mg/L,而后升高。。而S2-浓度在此范围内呈现先增高后降低的趋势,说明在此过程中,硫酸盐还原菌开始发挥作用利用BTEX各组分作为碳源和能源将SO24-还原为S2-,使BTEX的浓度持续降低,见图7中所示。空间检测的SO24-的浓度均大于原水中该离子的浓度主要是由于介质中的硫酸盐溶入到模拟水中的缘故。如2.1.3中所述,50 cm后,S2-降低是由于与Fe2+结合生成了FeS沉淀的缘故。由此可知,在距离污染源30-50 cm处微生物利用硫酸盐作为电子受体将BTEX各组分去除,此区间硫酸盐还原作用明显。

图4 模拟柱出水中Fe3+和Fe2+的空间变化曲线
硫酸盐还原菌(SRB)的重要的生理特点就是能利用硫酸盐作为电子受体,将其还原为H2S,同时利用有机物为碳源和能源,为细菌提供电子以满足微生物生长的需要。有研究者发现硫酸盐可以促进Fe(Ⅲ)还原微生物的生长[13],因此,硫酸盐还原作用与Fe(Ⅲ)还原作用基本上是同时进行的,在两者作用于模拟柱距离上体现出一定的重合度。

图5 模拟柱出水中SO24- 和S2-的空间变化曲线
2.1.5 出水中HCO-3的空间变化情况 由于实验条件的限制,本研究没有对气体成分CH4进行监测分析。由于产甲烷过程中会发生反应2CH2O→CH4+CO2和HCO-3+H++4H2→CH4+3H2O,所以,在生成大量甲烷的同时也生成了很多HCO-3。所以,实验中HCO-3的大量积累可以作为微生物利用BTEX为碳源和能源生成甲烷过程的一个重要标志。如图6所示,在柱子底部距离进水口11 cm处HCO-3的浓度达到最高值256.28 mg/L,在距离污染源越远的位置HCO-3的浓度逐渐降低。这也说明在柱子底端强还原环境中发生了产甲烷反应,形成产甲烷带。

图6 模拟柱出水中HCO-3的空间变化曲线
2.2 模拟柱出水中BTEX各污染组分浓度的空间变化规律
如图7所示,模拟柱侧部各取样口出水中BTEX各污染组分的浓度明显降低。苯、甲苯、乙苯、对二甲苯和间邻二甲苯的初始浓度分别是214.04、128.84、26.83、22.76和1.24 mg/L。而在距离进水口89 cm处的浓度分别为0.127 7、0.046 1、0.014 8、0.114 3和0.017 6 mg/L。在BTEX污染初期的出水中,它们的衰减率分别达到了99.94%、99.96%、99.94%、99.49%和98.3%。得出 BTEX各组分在模拟地下介质中的衰减率很高,甲苯的衰减率最高达到99.96%,苯、乙苯和对二甲苯的衰减率其次,邻间二甲苯的衰减率最低亦达到98.3%。

图7 模拟柱出水中BTEX各污染组分的空间变化曲线
由图7可知,BTEX各污染组分的衰减主要发生在进水口和第一个取样口之间,距离进水口11 cm处苯、甲苯、乙苯、对二甲苯和间邻二甲苯的衰减率分别 达 到 99.39%、99.8%、99.59%、98.14% 和92.24%。介质对BTEX各污染组分的吸附和降解作用很大,同时由HCO-3在此处的浓度可知产甲烷作用在此处对BTEX各污染组分的衰减也发挥了巨大作用[14]。在模拟柱中从污染严重处到污染晕边缘依次形成微生物对电子受体的顺序利用,从而使BTEX各污染组分的浓度下降。
3 结论
1)微生物以苯、甲苯、乙苯和二甲苯作为碳源和能源,以DO、NO3-、Fe3+、SO24-和CO2作为电子受体进行一系列生物地球化学作用,使BTEX污染的含水层中发生了氧化还原环境的变化。模拟柱中从污染源到污染羽边缘依次形成还原性强的环境向还原性弱的环境转化,即污染严重的模拟柱底部还原环境更强,而在污染晕边缘还原性减弱。
2)BTEX污染含水层中的微生物在利用电子受体的过程中会优先选择产能大的电子受体,因此通过对模拟柱各个取样口的各种氧化还原性指标如DO和 ORP、NO3-和NO2-、Fe3+和Fe2+、SO24-和S2-、HCO3-的浓度进行监测,得出在模拟柱中形成各种电子受体的顺序利用现象,即依次利用氧化性指标O2、NO3-、Fe3+、SO24-和CO2等物质并将其转化为H2O、NO2-、Fe2+、S2-和HCO3-等物质。也就在模拟柱中形成了顺序氧化还原区域,距离进水口0~30 cm产甲烷作用占主导地位、24~50 cm硫酸盐还原作用较明显、35~60 cm铁还原作用占优势、60~80 cm硝酸盐还原作用较强烈,80~98 cm氧还原作用较强烈。
3)BTEX各组分在经过模拟柱介质时发生了吸附和降解作用,因此在BTEX污染初期出水中,苯、甲苯、乙苯、对二甲苯和间邻二甲苯的衰减率依次达到99.94%、99.96%、99.94%、99.49%和 98.3%,其中最大部分的衰减发生在污染源到距离模拟柱底部11 cm之间。
[1]刘秀丽.地下水中BTEX的迁移规律及其原位生物修复技术研究[D].天津:天津大学,2010.
[2]Kate M S,Kristin A H.Natural attenuation and enhance bioremediation of organic contaminants in groundwater[J].Current Opinion in Biotechnoogy.2005,16(3):246-253.
[3]Mehrdad F, Cedric V, David D,et al.In situ bioremediation of monoaromatic pollutants in groundwater:A review [J].Bioresource Techno-logy,2008,99:5296-5308.
[4]Jordi B A,Serge B.Benzene dispersion and natural attenuation in an alluvial aquifer with strong interactions with surface water[J].Journal of Hydrology,2009,369(3/4):305-317.
[5]Choi H M,Lee J Y.Groundwater contamination and natural attenuation capacity at a petroleum spilled facility in Korea[J].Journal of Environmental Sciences,2011,23(10):1650-1659.
[6]Lou Z Y,Zhao Y C,et al.Natural attenuation and characterization of contaminants composition in landfill leachate under different disposing ages[J].Science of the Total Environment,2009,407:3385-3391.
[7]GB/T 5750.1—5750.13—2006#生活饮用水标准检验方法[S].
[8]周睿,赵勇胜,任何军,等.BTEX在地下环境中的自然衰减[J].环境科学,2009,30(9),2804-2808.
[9]Kamal M A, Klein P.Estimation of BTEX in groundwater by using gas chromatography-mass spectrometry[J].Saudi Journal of Biological Sciences,2010,17:205-208.
[10]Chen K F,Kao C M,et al.Control of petroleumhydrocarbon contaminated groundwater by intrinsic and enhanced bioremediation [J].Journal of Environmental Sciences,2010,22(6):864-871.
[11]Baedecker M J,Back W.Modern marine sediments as a natural analog to the chemically stressed environment of a landfill[J].Journal of Hydrology,1979,43:393-414.
[12]Cooper D C,Picardal F W,Schimmelmann A,et al.Chemical and biological interactions during nitrate and goethite reduction by Shewanella putrefaciens 200[J].Applied Environmental Microbiology,2003,69(6):3517-3525.
[13]Scheid D,Stubner S,Conrad R.Identification of rice root associated nitrate,sulfate and ferric iron reducing bacteria during root decomposition [J].FEMS Microbiology Ecology,2004,50(2):101-110.
[14]Mehrdad F, Ce'dric V, David D,et al.In situ bioremediation of monoaromatic pollutants in groundwater:A review [J].Bio-resource Technology,2008,99:5296-5308.
(编辑 胡 玲)
Spatial Changes of Redox Environment in Aquifer Contaminated by BTEX
Su Yana,Sun Chaoa,Zhao Yongshengb,Zhou Ruib,Wang Xiaoa,Sheng Hea
(a.Key Laboratory of Groundwater Resources and Environment,Ministry of Education;b.College of Environment and Resources,Jilin University,Changchun 130021,P.R.China)
The changes of redox environment conditions and the concentrations of BTEX in different conditions are monitored in this study through setting simulated column.The results showed that the concentration of redox components presented zoning in the simulated column.Oxygen reduction zone formatted in 80~98 cm away from the source,Nitrate reduction zone formatted in 60~80 cm,Iron reduction zone formatted in 35~60 cm,and Sulfate reduction zone formatted in 30~50 cm.At the bottom of the column,the methane zone formatted in 0~30 cm because of the decreasing of HCO3-.The concentration of BTEX components showed a sharp decline.The degradation rates of benzene,toluene,ethylbenzene,xylene and o-xylene reached 99.94%,99.96%,99.94%,99.49%and 98.3%,respectively.
groundwater;BTEX;natural attenuation;redox condition
X523
A
1674-4764(2014)02-0126-05
10.11835/j.issn.1674-4764.2014.02.020
2013-10-25
国家环保公益性行业科研专项重大项目(201009009);吉林省科技发展计划项目(201101020);吉林大学基本科研业务费项目(200903152、200903156)。
苏 燕(1986-),女,博士生,主要从事水土污染的控制与治理研究,(E-mail)sy19861029@sina.com。
赵勇胜(通信作者),男,教授,博士生导师,(E-mail)zhaoyongsheng@jlu.edu.cn。

