硫化氢通过PI3K/AKT-NF-κB通路调节重症急性胰腺炎
饶春燕,胡昌伦,付兰英,赵晓晏△
(1.第三军医大学新桥医院消化内科,重庆400037;2.武警重庆总队医院内分泌科,重庆400061;3.重庆市中医院脾胃科400021)
重症急性胰腺炎(severe acute pancreatitis,SAP)是伴随着胰周或全身性炎症,并可发展为多器官功能障碍综合征(multiorgan dysfunction syndrome,MODS)的胰腺炎症过程,病死率高达20%~60%[1]。其发病机制复杂,胰酶、氧化损伤、炎症介质等均参与其中。目前认为SAP 发生时各种促炎细胞因子是导致全身炎症反应综合征(systemic inflammation response syndrome,SIRS)发生的关键因素,而SIRS 是造成MODS 的重要原因。如何才能有效调节细胞因子的产生和相互作用,阻断SIRS 和MODS 的发生,对于防止急性胰腺炎(acute pancreatitis,AP)发展为SAP 具有重要的意义。
硫化氢(hydrogen sulfide,H2S)被认为是继CO、NO后的第3 种新型气体分子,H2S 主要以L-半胱氨酸为底物通过激活5′-磷酸吡哆醛依赖性酶:胱硫醚-γ裂解酶(cystathionineγlyase,CSE,EC 4.4.1.1)和胱硫醚-β合成酶(cystathionineβsynthase,CBS,EC 4.2.1.22)而生成[2];同时,还可以以α酮戊二酸为底物通过3-巯基丙酮酸盐硫转移酶(3-Mercaptopyruvate sulfurtransferase,3MTS)而产生[3]。H2S 在体内可能有2种存在形式:1/3以气体H2S 形式存 在,2/3以Na HS(HS-)形式存在。大多数CBS 存在于中枢神经系统中,而外周组织中CSE 活性较高。已有大量研究证实H2S 调节血管、胃肠道、心肌收缩,神经传递和胰岛素分泌[4-5]等方面起着重要的作用。近年来,学者们也开始通过多种不同的炎症模型来研究H2S在炎症过程中的意义,但结果不一。
1 材料与方法
1.1 材料 96 只6 周龄SPF 级SD雄性大鼠购自第三军医大学大坪医院野战外科研究所实验动物中心,体质量202~243 g。左旋精氨酸(中国上海生物有限公司),wortmannin(以下简写W)、考马斯亮蓝G-250、溴酚蓝(美国Sigma 公司),髓过氧化物酶测试盒(中国南京建成生物有限公司),IL-6 ELISA试剂盒(美国R&D公司),兔抗大鼠p-AKT单克隆抗体、辣根过氧化物酶标记的山羊抗兔IgG(美国Santa 公司),兔抗大鼠IκBα单克隆抗体、辣根过氧化物酶标记的山羊抗兔IgG(英国Abcam公司),小鼠抗大鼠GAPDH单克隆抗体、辣根标记的山羊抗小鼠IgG为美国Pr oMab 公司产品,BCA蛋白浓度检测试剂盒、EMSA检测试剂盒(美国Pierce 公司),甲基磺酰氟(PMSF)(美国Sigma 公司),核蛋白提取试剂盒(中国南京凯基生物科技有限公司)。
1.2 方法
1.2.1 大鼠模型构建及分组 构建模型前用普通饲料适应性喂养SD大鼠5 d,术前12 h禁食不禁水。大鼠分为对照组(n=6)、SAP组(n=10)、PAG+SAP组(n=10)、5 mg/kg Na HS+SAP 组(n=10)、10 mg/kg Na HS+SAP组(n=10)、20 mg/kg Na HS+SAP组(n=10)、100 mg/kg Na HS+SAP组(n=10)、W+SAP组(n=10)、5 mg/kg Na HS+W+SAP组(n=10)和100 mg/kg Na HS+W+SAP组(n=10)。参照赖铭裕等[6]的方法建立SAP 模型。SAP 组及干预组均采用经腹腔注射6%左旋精氨酸溶液诱导模型;PAG组建模前1 h 经腹腔注射PAG 50 mg/kg;各Na HS 组建模前1h 经腹腔分别注射Na HS 5、10、20、100 mg/kg[7];各 组 注 射 左 旋 精 氨 酸 前0.5 h 大鼠腹腔注射1.4 mg/kg[8]。对照组以生理盐水代替左旋精氨酸。各组大鼠注射后禁食,自由饮水。
1.2.2 标本采集及处理 建模24 h 后,用2%戊巴比妥钠腹腔注射麻醉大鼠,抽右心血离心后检测IL-6;钝性分离胰腺后立即冻存于液氮内,以备胰腺髓过氧化物酶(myeloperoxidas,MPO)活性、胰腺磷酸化丝/苏氨酸蛋白激酶(p-AKT)、核因子抑制蛋白-κB(IκBα)表达水平和核转录因子-κB(NF-κB)活性检测。
1.2.3 ELISA法测定血浆I L-6按照试剂盒说明书检测血浆IL-6 水平。
1.2.4 胰腺组织M P O活性检测 将液氮冻存胰腺组织剪成小块,称质量,加入9倍质量的生理盐水于Dounce 匀浆机匀浆,制成10%胰腺组织匀浆,按照MPO检测试剂盒说明书步骤检测MPO活性。
1.2.5 Western blot 法检测胰腺组织p-AKT、IκBα表达水平 胰腺组织加入RIPA缓冲液和PMSF后组织匀浆,12000 r/min 离心10 min,取上清液,BCA蛋白浓度检测试剂盒测定总蛋白量。每孔加样20μg 蛋白,加入等量上样缓冲液,混匀,煮沸3 min 使蛋白变性,上样于12%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,电泳完毕后,电转法将蛋白转移至聚偏氟乙烯(PVDF)膜,并用新鲜配制的含3% 脱脂奶粉的PBS 液封闭过夜,然后加入p-AKT单克隆抗体(1∶300),IκBα单克隆抗体(1∶500)及抗GAPDH抗体(1∶8000),4℃过夜。将膜取出后用PBS 冲洗3 次,加入辣根过氧化物酶标记的二抗孵育,最后用化学发光法显影,凝胶成像仪扫描图像。
1.2.6 EMSA法检测胰腺组织NF-κB 活性 按核蛋白 提 取试剂盒说明书提取胰腺核蛋白。采用生物素3′末端标记法将选取核苷酸序列为5′-TCA ACT CCC CTG AAA GGG TCC G-3′,3′-AGT TGA GGG GAC TTT CCC AGG C-5′(湖南远泰生物有限公司合成)。将8μg 核蛋白与20 fm生物素标记的探针充分结合,上样于5%PAGE电泳后,转移至带正电荷的尼龙膜上,紫外线交联15 min,封闭15 min 后与结合液孵育,用化学发光法显影,凝胶成像仪扫描图像。
1.3 统计学处理 采用SPSS13.0 统计软件进行数据分析,计量资料以±s表示,进行单因素方差分析和LSD-q 检验,以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组大鼠血浆IL-6 水平 SAP 组和PAG+SAP 组血浆IL-6 水平较对照组明显升高(P<0.05),且PAG+SAP组高于SAP 组(P<0.05);不同剂量NaHS+SAP组血浆IL-6 水平随着Na HS 浓度升高逐渐降低,其中5 mg/kg Na HS+SAP组与SAP 组差异无统计学意义(P>0.05),10 mg/kg Na HS+SAP、20 mg/kg Na HS+SAP、100 mg/kg Na HS+SAP 组均低于SAP 组(P<0.05),但仍高于对照组(P<0.05);给予W后,W+SAP 组较SAP组大鼠血浆I L-6水平明显降低(P<0.05);5 mg/kg Na HS+W+SAP 组与5 mg/kg Na HS+SAP组相比,血浆IL-6 水平明显降低(P<0.05),100 mg/kg Na HS+W+SAP 组较100mg/kg NaHS+SAP 组血浆IL-6 水平也有明显下降(P<0.05),见图1A、表1。
2.2 各组大鼠胰腺MPO活性 S A P组和P AG+S A P组胰腺MPO活性较对照组明显升高(P<0.05),且PAG+SAP 组高于SAP 组(P<0.05);不同剂量NaHS 组胰腺MPO活性随着Na HS 浓度升高逐渐降低,其中5mg/kg NaHS+SAP 组与SAP 组差异 无统计学意 义(P>0.05),10 mg/kg Na HS+SAP、20 mg/kg Na HS+SAP、100 mg/kg Na HS+SAP 组均低于ANP 组(P<0.05),但仍高于对照组(P<0.05);与SAP 组比较,W+SAP 组大鼠胰腺MPO活性明显降低(P<0.05);与5 mg/kg Na HS+SAP 组和100 mg/kg Na HS+SAP组比较,给予W后胰腺MPO活性均有明显降低(P<0.05),见图1A,表1。
2.3 大鼠胰腺p-AKT蛋白表达 与对照组(55.741±0.786)比较,SAP 组(154.230±1.719)和PAG+SAP组(181.950±2.372)p-AKT表达明显增强(P<0.05),且后者较前者更高(P<0.05);给予不同剂量Na HS 后,p-AKT表达逐渐减弱强,且各组均低于对照组(P<0.05),高于SAP组(P<0.05);给予W后,W+SAP组(121.543±1.198)、5 mg/kg Na HS+W+SAP 组(94.587±0.921)及100mg/kg NaHS+W+SAP 组(60.149±0.812)分别与SAP组(154.230±1.719)、5 mg/kg Na HS +SAP组(129.710±1.241)和100 mg/kg Na HS +SAP 组(67.149±0.767)比较,p-AKT蛋白表达均有明显减弱(P<0.05),见图2A。
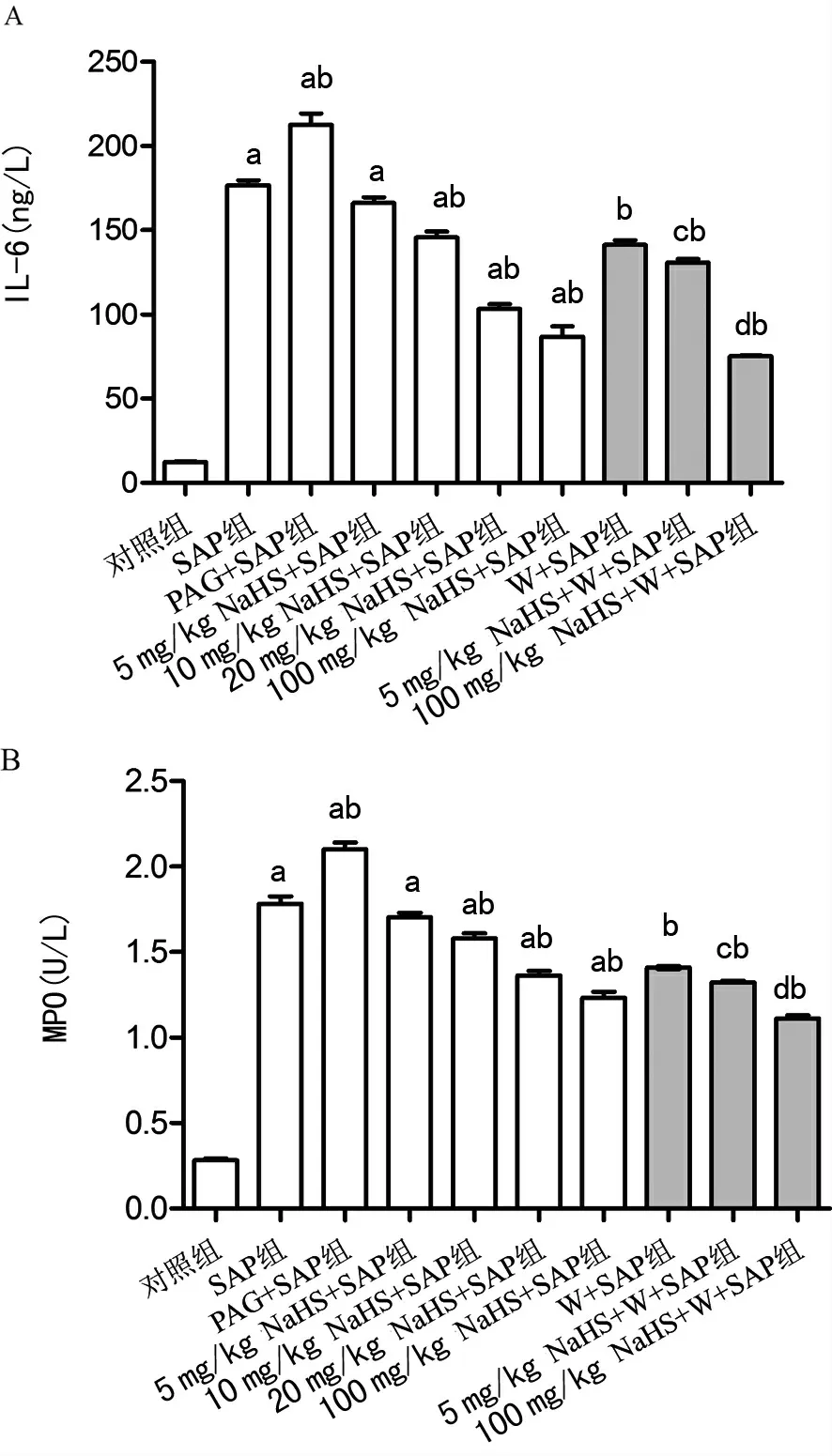
图1 各组大鼠血浆IL-6 水平和MPO活性分析图
表1 各组大鼠血浆IL-6 水平、胰腺MPO活性(±s)
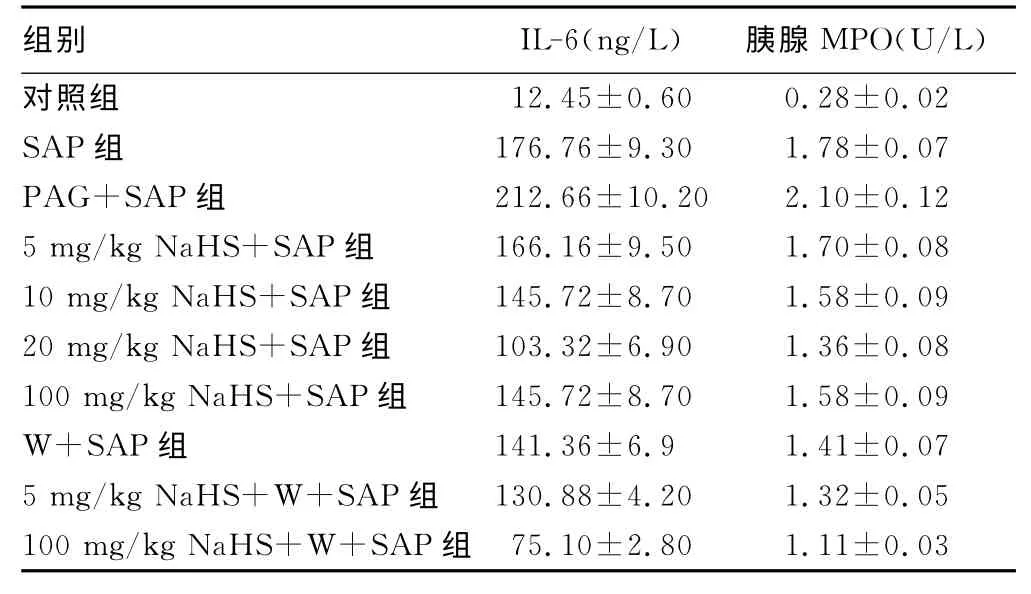
表1 各组大鼠血浆IL-6 水平、胰腺MPO活性(±s)
组别 IL-6(ng/L) 胰腺MPO(U/L)12.45±0.600.28±0.02 SAP 组 176.76±9.301.78±0.07 PAG+SAP 组 212.66±10.202.10±0.125 mg/kg Na HS+SAP 组 166.16±9.501.70±0.0810 mg/kg Na HS+SAP 组 145.72±8.701.58±0.0920 mg/kg Na HS+SAP 组 103.32±6.901.36±0.08100 mg/kg Na HS+SAP 组 145.72±8.701.58±0.09 W+SAP 组 141.36±6.91.41±0.075 mg/kg Na HS+W+SAP 组 130.88±4.201.32±0.05100 mg/kg Na HS+W+SAP 组对照组75.10±2.801.11±0.03
2.4 各组大鼠胰腺IκBα蛋白表达与对照组(195.350±2.320)比较,SAP组(90.671±1.217)和PAG+SAP组(63.065±0.679)IκBα表达明显减弱(P<0.05),且后者较前者更低(P<0.05);给予不同剂量Na HS 后,IκBα表达逐渐增强,且各组均低于对照组(P<0.05),高于SAP 组(P<0.05);给予W后,W+SAP组(115.900±1.314)、5 mg/kg Na HS+W+SAP 组(158.710±1.697)及100 mg/kg Na HS+W+SAP组(174.950±1.879)分 别 与SAP组(90.671±1.217)、5 mg/kg Na HS+SAP组(146.000±1.676)和100 mg/kg Na HS+SAP 组(161.460±1.743)相比,IκBα蛋白表达均有明显减弱(P<0.05),见图2B。
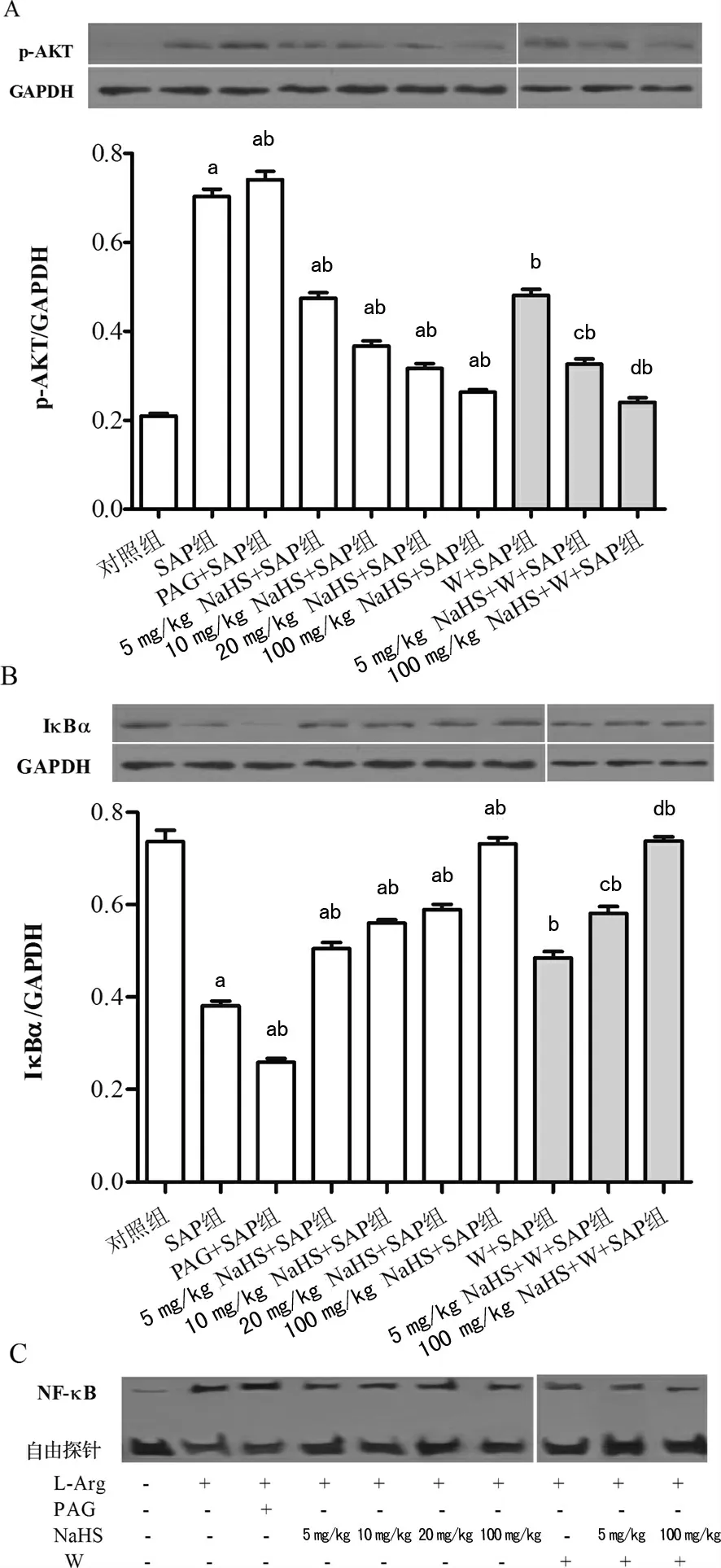
图2 各组大鼠胰腺p-AKT、IκBα蛋白表达及灰度比、NF-κB 活性
2.5 各组大鼠胰 腺NF-κB活性 与 对照组相比,SAP组 和PAG+SAP 组NF-κB 活性明显增强,给予NaHS 后,NF-κB 活性逐渐减弱;给予W后,W+SAP组、5 mg/kg Na HS+W+SAP 组及100 mg/kg Na HS+W+SAP组 分别与SAP组、5 mg/kg Na HS+SAP组 和100 mg/kg NaHS+SAP组 比 较,NF-κB 活性均有不同程度减弱,图2C。
3 讨 论
近来有研究显示,H2S 通过介导AKT激活从而提高心动指数和减少心肌梗死面积,同时使用LY294002 抑制AKT则会消除H2S 产生的这种心脏保护作用[9]。Ramasamy 等[10]也认为H2S 在雨蛙肽处理的胰腺腺泡细胞中通过PI3K/AKT通路起着抑制TNF-α、IL-1β等炎症因子的产生,并且该作用不会引起p38、Jun、MAPK 磷酸化。这与本实验结果相符,认为H2S可以通过PI3K/AKT 通路在炎性反应中起到抑制作用。
NF-κB 是一种广泛存在与细胞中易被诱导的核转录因子,它是参与调节细胞生长、免疫应答、炎性反应和凋亡等信号通路的关键 细 胞 因 子[11]。PI3K/AKT是调节NF-κB及 下 游 依赖基因表达的重要介质,而大量研究证实AP的发生、发展有赖于NF-κB 转录,它在调节炎症介质及基因表达中起着重要作用[12-13]。更有研究证实,人单核细胞中,NF-κB 转录是外源性H2S 导致细胞因子表达的核心部分[14]。本研究发现H2S在SAP 大鼠模型中的调节作用与抑制IκBα降解,并下调NFκB 及转录相关的促炎基因表达有关;并且,给予PI3K抑制剂W后,NF-κB 进一步下降,血浆IL-6 水平及胰腺MPO活性也明显降低。TNF-α处理的人脐静脉内皮细胞[15]、LPS 处理的星状细胞[16]等体外细胞培养中,Na HS 可以通过抑制IκBα降解和NF-κB 核转位而产生保护性作用。在静脉注射Na HS 能够抑制NO和超氧化物的产生,从而在失血性休克复苏再灌注早期时维持平均动脉压,下调NF-κB 活性剂iNOS 和ICAM-1水平[17]。
AKT是PI 3K调节的主要效应因子,它的激活有赖于依赖磷酸肌醇的激酶(PDK-1)使Thr308和Ser473发生磷酸化[17]。一但AKT被激活,即可产生广泛的作用调节细胞存活、增殖和生长[17]。虽然AKT不是由PI 3K直接激活磷酸化的,但是其下游调控的信号转导是严格按照PI3K的活性来调节的。H2S 能使培养的内皮 细胞[18]、结肠 癌 细 胞[19]、雨 蛙 肽处理的胰腺腺泡细胞[10]及大鼠下肢缺血肌肉[20]中的AKT活化,并且在局部缺血心肌组织中给予少量Na HS即可引起AKT活化,从而减轻心肌损伤[21]。本实验也认为外源性H2S(Na HS)能够通过AKT作用于炎症因子,但不同的是,本实验中H2S 是通过抑制AKT磷酸化,从而下调炎症因子的表达。之前的研究认为激活PI3K/AKT通路能产生抗炎作用,这正与作者的观点一致[22-23]。在本实验先给予外源性H2S,0.5 h后再给予W,二者起到了加强的作用,说明H2S可能是通过PI3K下游的某因子来调节AKT活性的,但是其具体机制还需要进一步研究证实。
迄今为止,不少学者通过局部水肿、胰腺炎、败血症等多种动物模型和细胞培养研究认为H2S 在体内具有促炎作用。外源性H2S(Na HS 或Na2S)能使血浆、组织中炎症因子和趋化因子表达增加,而给予PAG后能逆转H2S 的促炎作用[24-28]。H2S 的促炎作用可以通过pSFKs-NF-κB[26]及ERK-NF-κB通路[29]调节炎性反应。在动物模型中,Na HS作用于IFN-γ处理的人单核细胞系U937 后也能通过激活活化NF-κBp 65 上调炎症因子[30]。但是在本实验中,给予Na HS后,能够降低ANP 时血浆IL-6 水平,胰腺MPO活性。证明H2S 在大鼠精氨酸诱导的ANP模型中产生抗炎作用。研究发现治疗性给予H2S 能通过抑制促炎因子IL-6 产生,增加抗炎因子IL-10水平,改善肺组织蛋白质氧化作用,从而减轻急性吸入性肺损伤程度[31]。上述研究充分显示出H2S 在多种炎症过程中能发挥一定的抗炎作用,与本实验结果相符。
本实验中不仅发现H2S 对SAP 有一定的抗炎作用,而且认为抗炎作用在Na HS 50~100 mg/kg 范围内会随着H2S 浓度的升高而逐渐增强,但不知道H2S 的作用是否会随着浓度的升高不断加强。然而,Sidhapuriwala 等[32]通过雨蛙肽诱导的AP 模型发现,给予10mg/kg NaHS 能降低血淀粉酶水平、胰腺及肺组织MPO活性及血浆中炎症趋化因子(CCL2、CCL3、CXCL1)和黏附分子(E选择素、P选择素、ICAM-1、VCAM-1)表达,而给予5 mg/kg Na HS 不会对胰腺及肺损伤产生明显的作用,同时,15 mg/kg Na HS 并不会使NaHS 的抗炎作用增强。预先给予胰腺腺泡细胞5μmol/L Na HS 后再用雨蛙肽处理,研究者发现IκBα降解减少,NF-κB活性降低,炎症因子减少;而给予10μmol/L和20μmol/L Na HS 时,该作用并未得到加强,甚至未见Na HS 产生明显的作用[10]。吸入1 ppmol 或5ppmol H2S 并不会减轻呼吸机肺损伤,但是吸入60 ppmol H2S 时却能加速呼吸机肺损伤的炎性反应[33]。甚至,在缺血再灌注模型中,给予不同剂量、不同浓度的Na HS,其对模型作用会出现剂量依赖性的U型改变[34-35]。之所以会出现这种情况,可能与H2S 直接释放的多少有关系。但具体机制如何,仍有待进一步研究。
本研究认为内源性H2S 的减少参与了SAP的病理生理过程;给予一定量的外源性H2S(Na HS)可通过抑制AKT磷酸化,进而使IκBα降解减少,NF-κB 转录活性降低,使血浆IL-6 水平下调,胰腺损伤程度减轻,对ANP 炎性反应有一定的抑制作用;并且在一定范围内,H2S 抑制SAP 炎症反应的作用随着其浓度的升高而逐渐增强。虽然目前的研究尚不能对H2S在炎症过程中的作用定论,但是这已经充分显示出H2S 的重要作用,也为今后治疗SAP 提供了一条新的思路。
[1] Al Mofleh IA.Severe acute pancreatitis:Pathogenetic aspects and prognostic factors[J].World J Gastroenterol,2008,14(5):675-684.
[2] Moore PK,Bhatia M,Moochhala S.Hydrogen sulfide:from the smell of the past to the mediator of the future?[J].Trends Pharmacol Sci,2003,24(12):609-611.
[3] Shibuya N,Tanaka M,Yoshida M,et al.3-Mercaptopyruvate sulfurtransferase produces Hydrogen sulfide and bound sulfane Sulfur in the brain[J].Antioxid Redox Signal,2009,11(4):703-714.
[4] Bhatia M.Hydrogen sulfide as a vasodilator[J].IUBMB Life,2005,57(9):603-606.
[5] 张宁,王于理,郑勇,等.内源性硫化氢在不同时期大鼠肝硬化中的作用[J].世界华人消化杂志,2009,17(3):307-311.
[6] 赖铭裕,梁志海,唐国都,等.腹腔注射左旋精氨酸诱导急性坏死性胰腺炎大鼠模型[J].世界华人消化杂志,2006,14(22):2233-2236.
[7] Sidhapuriwala JN,Ng SW,Bhatia M.Effects of hydrogen sulfide on inflammation in caerulein-induced acute pancreatitis[J].J Inflamm(Lond),2009,6:35.
[8] Singh VP,Saluja AK,Bhagat L,et al.Phosphatidylinositol 3-kinase-dependent activation of trypsinogen modulates the severity of acute pancreatitis[J].J Clin Invest,2001,108(9):1387-1395.
[9] Yong QC,Lee SW,Foo CS,et al.Endogenous Hydrogen sulphide mediates the cardioprotection induced by ische-mic postconditioning[J].Am J Physiol Heart Circ Physiol,2008,295(3):H1330-H1340.
[10] Ramasamy T,Jia S,Yung-Hua K,et al.Effect of Hydrogen sulfide on the phosphatidylinositol 3-kinase-protein kinase B pathway and on caerulein-induced cytokine production in isolated mouse pancreatic acinar cells[J].J Pharmacol Exp Ther,2009,329(3):1166-1177.
[11] Hayden MS,Ghosh S.Shared principles in NF-kappaB signaling[J].Cell,2008,132(3):344-362.
[12] Lee M,Schwab C,Yu S,et al.Astrocytes produce the antiinflammatory and neuroprotective agent Hydrogen sulfide[J].Neurobiol Aging,2009,30(10):1523-1534.
[13] Ganster F,Burban M,De La Bourdonnaye M,et al.Effects of Hydrogen sulfide on hemodynamics,inflammatory response and oxidative stress during resuscitated hemorrhagic shock in rats[J].Crit Care,2010,14(5):R165.
[14] Cai WJ,Wang MJ,Moore PK,et al.The novel proangiogenic effect of Hydrogen sulfide is dependent on Akt phosphorylation[J].Cardiovasc Res,2007,76(1):29-40.
[15] Cai WJ,Wang MJ,Ju LH,et al.Hydrogen sulfide induces human colon cancer cell proliferation:role of Akt,ERK and p21[J].Cell Biol Int,2010,34(6):565-572.
[16] Wang MJ,Cai WJ,Li N,et al.The Hydrogen sulfide donor Na HS promotes angiogenesis in a rat model of hind limb ischemia[J].Antioxid Redox Signal,2010,12(9):1065-1077.
[17] Yong QC,Lee SW,Foo CS,et al.Endogenous Hydrogen sulphide mediates the cardioprotection induced by ischemic postconditioning[J].Am J Physiol Heart Circ Physiol,2008,295(3):H1330-1340.
[18] Luyendyk JP,Schabbauer GA,Tencati MA,et al.Genetic analysis of the role of the PI3K-Akt pathway in lipopolysaccharide-induced cytokine and tissue factor gene expression in monocytes/macrophages[J].J Immunol,2008,180(6):4218-4226.
[19] Tarassishin L,Suh HS,Lee SC.Interferon regulatory factor 3 plays an anti-inflammatory role in microglia by activating the PI3K/Akt pathway[J].J Neuroinflammation,2011,8(1):187.
[20] Ramasamy Tamizhselvi PK,Bhatia M.Inhibition of Hydrogen sulfide synthesis attenuates chemokine production and protects mice against acute pancreatitis and associated lung injury[J].Pancreas,2008,36(4):e24-31.
[21] Bhatia M,Sidhapuriwala JN,Ng SW,et al.Pro-inflammatory effects of Hydrogen sulphide on substance P in caerulein-induced acute pancreatitis[J].J Cell Mol Med,2008,12(2):580-590.
[22] Tamizhselvi R,Koh YH,Sun J,et al.Hydrogen sulfide induces ICAM-1 expression and neutrophil adhesion to caerulein-treated pancreatic acinar cells through NF-kappa B and Src-family kinases pathway[J].Exp Cell Res,2010,316(9):1625-1636.
[23] Zhang H,Zhi L,Moochhala S,et al.Hydrogen sulfide acts as an inflammatory mediator in cecal ligation and puncture-induced sepsis in mice by upregulating the production of cytokines and chemokines via NF-kappaB[J].Am J Physiol Lung Cell Mol Physiol,2007,292(4):L960-L971.
[24] Zhang H,Zhi L,Moochhala SM,et al.Endogenous Hydrogen sulfide regulates leukocyte trafficking in cecal ligation and puncture-induced sepsis[J].J Leukoc Biol,2007,82(4):894-905.
[25] Zhang H,Moochhala SM,Bhatia M.Endogenous Hydrogen sulfide regulates inflammatory response by activating the ERK pathway in polymicrobial sepsis[J].J Immunol,2008,181(6):4320-4331.
[26] Zhi L,Ang AD,Zhang H,et al.Hydrogen sulfide induces the synthesis of proinflammatory cytokines in human monocyte cell line U937 via ERK-NF-κB pathway[J].J Leuk Biol,2007,81(5):1322-1332.
[27] Esechie A,Kiss L,Olah G,et al.Protective effect of Hydrogen sulfide in a murine model of acute lung injury induced by combined burn and smoke inhalation[J].Clin Sci,2008,115(3):91-97.
[28] Kang K,Zhao MY,Jiang HC,et al.Role of Hydrogen sulfide in hepatic Ischemia-Reperfusion-Induced injury in rats[J].Liver Transpl,2009,15(10):1306-1314.
[29] Li L,Rossoni G,Sparatore A,et al.Anti-inflammatory and gastrointestinal effects of a novel diclofenac derivative[J].Free Radic Biol Med,2007,42(5):706-719.
[30] Whiteman M,Li L,Rose P,et al.The effect of Hydrogen sulfide donors on lipopolysaccharide-induced formation of inflammatory mediators in macrophages[J].Antioxid Redox Signal,2010,12(10):1147-1154.
[31] Fiorucci S,Orlandi S,Mencarelli A,et al.Enhanced activity of a Hydrogen sulphide-releasing derivative of mesalamine(ATB-429)in a mouse model of colitis[J].Br J Pharmacol,2007,150(8):996-1002.
[32] Sidhapuriwala JN,Ng SW,Bhatia M.Effects of hydrogen sulfide on inflammation in caerulein-induced acute pancreatitis[J].J Inflamm(Lond),2009,6:35.
[33] Francis RC,Vaporidi K,Bloch KD,et al.Protective and detrimental effects of Sodium sulfide and Hydrogen sulfide in murine ventilator-induced lung injury[J].Anesthesiology,2011,115(5):1012-1021.
[34] Elrod JW,Calvert JW,Morrison J,et al.Hydrogen sulfide attenuates myocardial ischemia-reperfusion injury by preservation of mitochondrial function[J].Proc Natl Acad Sci U S A,2007,104(39):15560-15565.
[35] Ji Y,Pang QF,Xu G,et al.Exogenous Hydrogen sulfide postconditioning protects isolated rat hearts against ischemia-reperfusion injury[J].Eur J Pharmacol,2008,587(1/3):1-7.

