HBsAg定量检测在派罗欣治疗慢性乙型病毒性肝炎中的意义
汤力
江苏省睢宁县人民医院感染内科,江苏徐州221200
HBsAg定量检测在派罗欣治疗慢性乙型病毒性肝炎中的意义
汤力
江苏省睢宁县人民医院感染内科,江苏徐州221200
目的探究HBsAg定量检测在派罗欣治疗慢性乙型病毒性肝炎中的意义。方法该研究选取2008年5月—2012年1月在该院诊治的慢性乙型病毒性肝炎患者52例,按照随机数字表方法分成两组,予HBsAg消除20例作研究组,未予HBsAg消除32例作对照组,均进行干扰素派罗欣治疗,分析两组不同治疗时间HBsAg、HBV DNA和ALT指标。结果两组治疗前HBsAg指标,与治疗后12周、24周和48周明显下降,且研究组停药24周、48周HBsAg指标为阴性,研究组停药24周、48周HBsAg指标表现为阴性,但对照组停药24周、48周HBsAg指标(320±317)IU/mL、(201±196)IU/mL表现低水平的表达,两组比较差异有统计学意义(P<0.05)。结论派罗欣治疗慢性乙型病毒性肝炎患者HBsAg指标,会随治疗时间变化,具有一定临床研究和应用价值。
HBsAg;定量检测;派罗欣;慢性乙型病毒性肝炎
慢性病毒性乙型肝炎属于临床常见疾病,指的是感染乙型的肝炎病毒超过半年,且病毒并没有彻底清除,体内相关乙肝病毒的潜伏或造成肝炎的发病。临床主要表现为恶心、厌食、腹胀以及严重乏力等,严重影响人们正常生活健康。为进一步掌握HBsAg定量检测在派罗欣治疗慢性乙型病毒性肝炎中的意义,该研究主要对2008年5月—2012年1月在该院予干扰素派罗欣治疗的慢性乙型病毒性肝炎患者行HBsAg定量检测结果进行分析,现报道如下。
1 资料与方法
1.1 一般资料
资料选自在该院诊治的慢性乙型病毒性肝炎患者52例,按照随机数字表方法分成研究组和对照组,其中对照组32例,男性21例,女性11例,年龄24~59岁,平均年龄(38±8.46)岁,平均病程(3.2±1.6)年;研究组20例,男性13例,女性7例,年龄26~58岁,平均年龄(39±8.52)岁,平均病程(3.4±1.7)年。两组年龄、性别、病程等基线资料比较无明显差异(P>0.05)。
1.2 诊断标准
诊断标准:患者的临床症状均与相关《慢性乙型肝炎防治指南》(2010年版)标准中慢性乙型病毒性肝炎的诊断标准相符合,且均经过CT、超声等检查的临床确诊[1]。
1.3 纳入和排除标准
纳入标准:确诊为慢性乙型病毒性肝炎者;均签署治疗和护理方案的知情同意书;无应用干扰素派罗欣禁忌症;没有应用免疫调节剂;没有予以抗病毒治疗。排除标准:严重的心肝肾脏等内科疾病;甲丙丁等病毒感染;合并药物性、代谢性、酒精性、自身免疫性的肝脏;原发性的肝癌;精神和心理疾病者;不配合治疗和护理方案实施者;资料不完整者[2]。
1.4 方法
两组患者均予180 ug派罗欣(PEG-IFNa-2b)的皮下注射,每周进行一次,共计疗程48周,定期测量患者HBsAg、HBV DNA和ALT指标变化。将52例患者按照随机数字表方法分成两组,予HBsAg消除20例作研究组,未予HBsAg消除32例作对照组。
1.4.1 HBsAg指标测定患者均予以不同时间点的HBsAg指标测定,仪器选择Roche Cobase 601的电化学的发光免疫相关分析系统(ECLIA),并选择相关配套的原装试剂,检出的最低限度小于0.05 IU/mL3]。
1.4.2 HBV DNA和ALT指标测定患者均予以不同时间点的血清HBV DNA和ALT指标测定,其中血清HBV DNA的测定,仪器选择美国的ABI 7000 PCR型,试剂均经过上海科华生产,其中最低的检出限小于103copies/mL。血清ALT生化指标测定,仪器选择Beckman Couiter DXC800型全自动的生化相关分析仪,试剂为原装配套,正常的参考范围低于40 U/L[4]。
1.5 观察指标
观察并统计分析两组患者治疗前、治疗后第12周、24周、48周,以及停药24周、48周的机体HBsAg、HBV DNA和ALT指标变化情况。
1.6 统计方法
数据用SPSS 19.0软件包统计,计量资料应用标准差(±s)表示,应用t检验,计数资料应用(%)表示。
2 结果
2.1 两组不同治疗时间点的HBsAg变化情况
两组HBsAg指标治疗前分别为(6295±2047)IU/mL、(7084± 1085)IU/mL治疗后12周(3712±1220)IU/mL、(4025±1526)IU/mL、24周(1084±418)IU/mL、(2783±1436)IU/mL和48周(47±12)IU/mL、(1127±1022)IU/mL出现明显下降,研究组停药24周、48周HBsAg指标表现为阴性,但对照组停药24周、48周HBsAg指标(320± 317)IU/mL、(201±196)IU/mL表现低水平的表达;两组比较差异有统计学意义(P<0.05),见表1。
表1 两组不同治疗时间点的HBsAg变化情况[(±s),IU/mL]
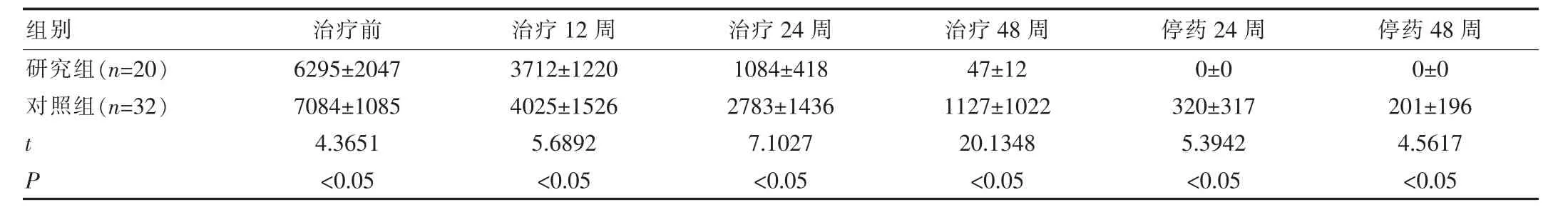
表1 两组不同治疗时间点的HBsAg变化情况[(±s),IU/mL]
组别研究组(n = 2 0)对照组(n = 3 2)t P治疗前6 2 9 5 ± 2 0 4 7 7 0 8 4 ± 1 0 8 5 4 . 3 6 5 1<0 . 0 5治疗1 2周3 7 1 2 ± 1 2 2 0 4 0 2 5 ± 1 5 2 6 5 . 6 8 9 2<0 . 0 5治疗2 4周1 0 8 4 ± 4 1 8 2 7 8 3 ± 1 4 3 6 7 . 1 0 2 7<0 . 0 5治疗4 8周4 7 ± 1 2 1 1 2 7 ± 1 0 2 2 2 0 . 1 3 4 8<0 . 0 5停药2 4周停药4 8周0 ± 0 3 2 0 ± 3 1 7 5 . 3 9 4 2<0 . 0 5 0 ± 0 2 0 1 ± 1 9 6 4 . 5 6 1 7<0 . 0 5
2.2 两组不同治疗时间点的HBV DNA和ALT指标变化情况
两组治疗前HBV DNA和ALT指标,与治疗后12周、24周和48周出现明显下降(P<0.05);且HBV DNA和ALT指标停药后24周两组分别(0.3±0.1)(103copies/ml)、(3.1±0.1)(103copies/mL)和(30.1±2.4)U/L、(33.6±3.5)U/L和48周(0.3±0.1)(103copies/mL)、(3.2±0.2)(103copies/mL)和(33.2±1.6)U/L、(32.3±3.2)U/L均呈现低水平表达;同时两组不同时间点HBV DNA和ALT指标无明显差异(P>0.05),见表2。
表2 两组不同治疗时间点的HBV DNA和ALT指标变化情况(±s)
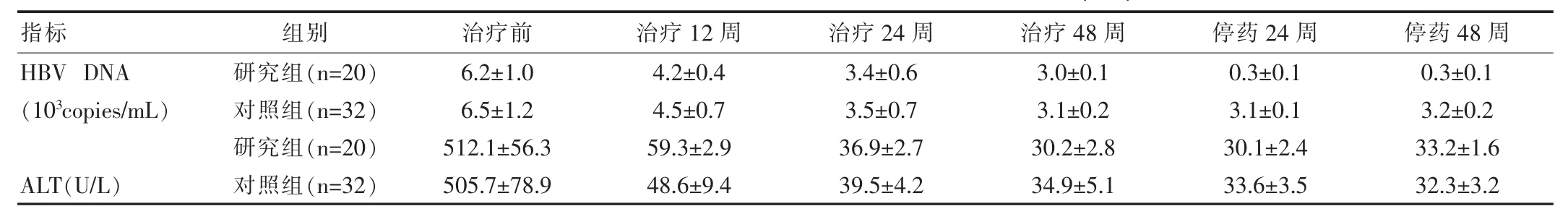
表2 两组不同治疗时间点的HBV DNA和ALT指标变化情况(±s)
指标H B V D N A(1 03c o p i e s / m L)A L T(U / L)组别研究组(n = 2 0)对照组(n = 3 2)研究组(n = 2 0)对照组(n = 3 2)治疗前治疗1 2周治疗2 4周治疗4 8周6 . 2 ± 1 . 0 6 . 5 ± 1 . 2 5 1 2 . 1 ± 5 6 . 3 5 0 5 . 7 ± 7 8 . 9 4 . 2 ± 0 . 4 4 . 5 ± 0 . 7 5 9 . 3 ± 2 . 9 4 8 . 6 ± 9 . 4 3 . 4 ± 0 . 6 3 . 5 ± 0 . 7 3 6 . 9 ± 2 . 7 3 9 . 5 ± 4 . 2 3 . 0 ± 0 . 1 3 . 1 ± 0 . 2 3 0 . 2 ± 2 . 8 3 4 . 9 ± 5 . 1停药2 4周停药4 8周0 . 3 ± 0 . 1 3 . 1 ± 0 . 1 3 0 . 1 ± 2 . 4 3 3 . 6 ± 3 . 5 0 . 3 ± 0 . 1 3 . 2 ± 0 . 2 3 3 . 2 ± 1 . 6 3 2 . 3 ± 3 . 2
3 讨论
依据现行慢性的乙型肝炎的防治指南,患者出现完全的应答以后再予24周治疗后可停用干扰素,但是患者在干扰素停用以后可出现部分患者复发情况,特别核苷类的药物较明显[5]。通过大量临床实践研究发现,患者复发的主要原因可能和肝细胞核内共价闭合环状的DNA没有完全清除相关,也可能和不同个体病毒对药物敏感性差异具有相关性[6]。
随着医疗技术的不断发展,临床相关HBsAg和HBV DNA定量检测的文献研究越来越多,但是均没有的定论[7]。在郝志强等研究中,得出血清HBsAg和HBV DNA具有总体相关性,但HBsAg在不同状态的患者血清中HBeAg不同患者的血清内HBsAg的滴数和HBV DNA相关性具有明显差异,因此表明HBsAg的定量检测作临床指标的预测具有实际应用价值[8]。两组HBsAg指标治疗后12周(3712±1220)IU/mL、(4025±1526)IU/mL、24周(1084± 418)IU/mL、(2783±1436)IU/mL和48周(47±12)IU/mL、(1127± 1022)IU/mL相比治疗前出现明显下降,研究组停药24周、48周HBsAg指标表现为阴性,但对照组停药24周、48周HBsAg指标(320± 317)IU/mL、(201±196)IU/mL表现低水平的表达;两组比较差异有统计学意义(P<0.05)。该研究结果与周方满的研究结果相符合,进而有效证实HBsAg定量检测的临床应用可行性[9]。
同时,该研究中对患者治疗前后血清HBV DNA和ALT指标进行分析,得出两组患者治疗前HBV DNA和ALT指标,与治疗后12周、24周和48周出现明显下降,比较差异具统计学意义;且HBV DNA和ALT指标停药后24周两组分别(0.3±0.1)(103copies/mL)、(3.1±0.1)(103copies/mL)和(30.1±2.4)U/L、(33.6± 3.5)U/L和48周(0.3±0.1)(103copies/mL)、(3.2±0.2)(103copies/mL)和(33.2±1.6)U/L、(32.3±3.2)U/L均呈现低水平表达;同时两组不同时间点HBV DNA和ALT指标比较无明显差异。研究结果与临床相关文献的结果相符合,进而表明HBV DNA和ALT指标随着患者干扰素治疗时间的变化情况。关于HBsAg定量检测在派罗欣治疗慢性乙型病毒性肝炎中深入价值,需要以后临床进一步的研究证实和验证。
综上所述,对派罗欣治疗慢性乙型病毒性肝炎患者的HBsAg指标,会随患者治疗时间产生变化,HBsAg定量检测可作为慢性乙型病毒性肝炎的有效预测指标,具有一定临床研究和应用价值。
[1]东立.乙肝血清标志物与HBV-DNA定量检测对诊治乙肝的临床价值[J].河北医学,2013,27(5):345-348.
[2]张秋红.乙型病毒性肝炎患者血清HBV-M与HBV-DNA联合检测的临床意义[J].实用医学杂志,2011,31(1):431-435.
[3]吕迎霞.乙肝五项定量检测及罕见模式分析[J].检验医学与临床,2012,23 (14):261-263.
[4]邓良准.HBV-DNA乙型病毒性肝炎前S1抗原与HBV血清标志物的相关性[J].实用临床医药杂志,2011,27(1):281-283.
[5]王晓英.慢性乙肝患者肝组织HBVcccDNA与血清HBV DNA及其标志物相关性的研究[J].宁夏医科大学学报,2013,19(8):518-520.
[6]李传杰.干扰素治疗成人慢性乙型病毒性肝炎的体会[J].中华全科医学,2009,32(4):375-378.
[7]丁丽敏.乙型病毒性肝炎患者血清HBV标志物检测分析[J].中国误诊学杂志,2011,27(30):537-539.
[8]郝志强.干扰素治疗慢性乙型病毒性肝炎患者HBsAg定量水平的变化[J].江苏医药,2013,32(19):712-714.
[9]周方满.乙型病毒性肝炎患者血清学标志物和HBV DNA定量相关性分析[J].上海预防医学,2013,31(8):363-365.
R512.6
A
1672-5654(2014)12(b)-0179-03
2014-09-17)
汤力(1972-),男,江苏睢宁人,本科,副主任医师,主要从事慢性乙肝的抗病毒治疗和慢性重症肝炎的综合治疗。