白细胞介素17对大鼠肝星状细胞胶原代谢的影响
余盼攀,张启瑜,金慧成
(1.杭州市第一人民医院 普外科,浙江 杭州 310000;2.温州医科大学附属第一医院 普外科,浙江温州 325015)
白细胞介素17对大鼠肝星状细胞胶原代谢的影响
余盼攀1,张启瑜2,金慧成1
(1.杭州市第一人民医院 普外科,浙江 杭州 310000;2.温州医科大学附属第一医院 普外科,浙江温州 325015)
目的:探讨白细胞介素17(IL-17)对大鼠肝星状细胞(HSCs)增殖及基质金属蛋白酶-9(MMP-9)和基质金属蛋白酶组织抑制剂-1(TIMP-1)表达的影响及其与肝纤维化的关系。方法:采用Optiprep密度梯度离心法分离HSCs并进行鉴定、传代。采用免疫细胞化学法检测IL-17作用HSCs 72 h后α肌动蛋白(α-SMA)表达的影响。采用MTT法检测IL-17作用HSCs 24、48和72 h后细胞的增殖情况。采用RT-PCR法和ELISA法分别检测IL-17作用HSCs后MMP-9、TIMP-1 mRNA和蛋白表达的影响。结果:成功分离并培养HSCs,一定浓度的IL-17能促进HSCs α-SMA的表达并且促进HSCs增殖。IL-17能提高HSCs MMP-9和TIMP-1 mRNA和蛋白的分泌,呈浓度依赖性,且TIMP-1/MMP-9比值随IL-17浓度增加而递增。结论:IL-17不仅促进HSCs增殖,还能促进α-SMA、MMP-9和TIMP-1的表达,同时提高TIMP-1与MMP-9的比值,可能在肝纤维化中扮演重要角色。
白细胞介素17;肝星状细胞;α肌白蛋白;基质金属蛋白酶-9;基质金属蛋白酶组织抑制剂-1;大鼠
肝星状细胞(hepatic stellate cells,HSCs)主要位于肝窦周围间隙内,在生理情况下参与体内维生素A的代谢。HSCs的活化、增殖、凋亡及分泌细胞外基质(extracellular matrixc,ECM)与肝纤维化的关系目前已经形成共识[1]。ECM的动态平衡主要由基质金属蛋白酶(MMPs)及其抑制因子(TIMPs)调节。而白细胞介素(IL-17)是由新型Th17细胞分泌的一种炎症因子,是介导炎症反应的主要细胞因子之一。研究显示,IL-17与多种肝脏疾病的发生发展存在密切关系[2-5],但具体机制尚不清楚。本研究旨在观察IL-17对HSCs的增殖及胶原代谢的影响,进一步阐述IL-17与肝纤维化的关系。
1 材料和方法
1.1 材料
1.1.1 实验动物:健康成年雄性SD大鼠10只(温州医科大学动物实验中心提供),无特定病原菌级,体质量200~250 g,普通喂养,自由进食。
1.1.2 主要试剂:IV型胶原酶、DNA酶I均购自美国Sigma公司。Optiprep分离介质购自挪威Axisshield公司。大鼠α肌动蛋白(α-SMA)单克隆抗体、山羊抗小鼠IgG二抗购自武汉博士德公司。鼠源重组IL-17购自英国PeproTech公司。DMEM培养基和胎牛血清购自美国Gibco公司。四甲偶氮唑盐(MTT)和二甲基亚砜(DMSO)购自Solarbio北京公司。大鼠MMP-9和TIMP-1 ELISA试剂盒购自美国R&D公司。反转录试剂盒和Trizol试剂盒均购自美国invitrogen公司。大鼠MMP-9和TIMP-1和内参GAPDH PCR引物由上海捷瑞生物工程有限公司合成。
1.1.3 主要仪器:超净工作台(苏州净化),PCR仪(德国Biometra公司),紫外分光光度计(美国Beckman公司),相差显微镜(日本Olympus公司),高速离心机(美国Beckman公司),CO2培养箱(SANYO公司),恒温水浴箱(丹麦Heto公司),荧光显微镜(日本Olympus公司)。
1.2 方法
1.2.1 细胞分离及分组:采用改良的Optiprep密度梯度法[6]分离大鼠HSCs。将细胞以5×105/mL接种于25 mL培养瓶中,于37 ℃,5% CO2培养箱中培养,24 h后首次换液去除未贴壁的细胞。以后每2~3 d换液1次,待细胞长满瓶底时0.25%胰酶消化传代。将细胞分为5个处理组:对照组、1 ng/mL IL-17组、10 ng/mL IL-17组、100 ng/mL IL-17组、500 ng/ mL IL-17组。
1.2.2 免疫细胞化学法检测HSCs、α-SMA表达:将对数生长期的HSCs以每孔3×104/mL接种入6孔板中进行细胞爬片,并加入IL-l7(100 ng/mL)进行处理,对照组加入等量0.9%氯化钠溶液,培养72 h后取出进行染色,PBS冲洗3次后4%多聚甲醛固定15 min,3% Triton X-100透膜30 min,封闭,滴加一抗(4 ℃过夜),PBS冲洗,滴加二抗孵育30 min,DAB试剂盒进行显色,苏木素染色2 min,依次在75%、85%、95%、100%乙醇中脱水,封片观察。
1.2.3 MTT法检测细胞增殖情况:将对数生长期的HSCs以每孔3×103/mL细胞接种入96孔板中,培养24 h,换无血清的DMEN饥饿过夜使细胞同步化。按照上述分组进行处理,每组设6个复孔。于37 ℃、5% CO2条件下继续培养24、48和72 h后弃上清,每孔加入浓度为5 mg/mL的MTT 20μL,37 ℃作用4 h后弃作用液,各孔加入DMSO 150μL,震荡10 min,使结晶充分溶解,全自动酶标仪于490 nm波长检测各孔吸光度(OD)。
1.2.4 RT-PCR法检测细胞MMP-9和TIMP-1mRNA表达水平:取对数生长期HSCs,按1×105/mL细胞接种于六孔板内培养,按照上述分组处理,培养24 h后收集细胞用于总RNA提取,RNA提取采用Trizol法。取等量的RNA按照反转录试剂盒说明书进行反转录。对反转录的cDNA进行PCR扩增:引物序列GAPDH引物上游5’-GTGCGATGGCGTGCTATG-3’,下游5’-GGGTGG TCCAGGGTTTCTTA-3’,片段长度280 bp;TIMP-1引物上游5’-TCCTCTTGTTGCTATCATTGATAGCTT-3’,下游5’-CGCTGGTATAAGGTGGTCTCGAT-3’,片段长度148 bp;MMP-9引物上游5’-CAGTGTAGGCGTGGGTCCAGTA-3’,下游5’-CCAAGAACTTCCGACTATCCAATGA-3’,片段长度110 bp。反应条件:95 ℃预变性5 min,95 ℃变性30 s,59 ℃退火30 s,72 ℃延伸30 s,循环30~35次。PCR产物用2%琼脂糖凝胶电泳,利用Gel-Pro分析软件分析条带。
1.2.5 ELISA法检测细胞培养上清MMP-9和TIMP-1蛋白量:HSCs以3×105/mL接种于24孔板中,待细胞贴壁并同步化后按上述分组处理细胞24 h终止培养,取细胞培养液离心去除沉淀,取上清,按照ELISA试剂盒说明书进行操作。每组设3个复孔,操作结束后将ELISA板置于酶标仪上450 nm波长下读取各孔吸光度值,根据标准曲线计算出MMP-9和TIMP-1的含量。
1.3 统计学处理方法 应用SPSS17.0统计学软件。数据用±s表示,多组间比较采用单因素方差分析(one-way ANOVA)。P<0.05为差异有统计学意义。
2 结果
2.1 HSCs的分离、培养及鉴定 采用Optiprep密度梯度离心法分离HSCs,平均细胞得率2×107个/肝。经0.4%锥虫蓝染色,细胞存活率在90%以上。荧光显微镜下新分离的细胞自发淡蓝色荧光,见图1。相差显微镜下,新分离的HSCs呈圆形,具有很强的折光性,体积明显小于肝细胞,培养至5 d左右细胞外观呈现出明显的梭形,胞浆内颗粒减少,细胞逐渐融合成片状生长,见图2。

图1 新分离HSCs自发荧光(×400)图2 相差显微镜下培养5 d的HSCs(×200)
2.2 IL-17促进HSCs α-SMA的表达 IL-17作用体外培养5 d的HSCs 72 h,免疫细胞化学染色法测定α-SMA在HSCs中表达情况,可见阳性染色的α-SMA位于胞质内,呈高张力纤维状分布,IL-17(100 ng/ mL)处理组比空白对照组HSCs α-SMA的表达量明显升高,差异有统计学意义(P<0.01),结果见图3。
2.3 IL-17促进HSCs增殖 MTT结果显示,在一定时间和浓度下,IL-17具有促进HSCs增殖的作用。IL-17作用HSCs 24 h后,随药物浓度的增高,细胞的增殖有增高的趋势,但各浓度组与对照组比差异均无统计学意义(P>0.05)。当作用48、72 h,药物浓度在10、100和500 ng/mL时,随着作用时间的延长和药物浓度的增加,增殖作用越显著,各组与对照组比差异有统计学意义(P<0.01)。IL-17作用HSCs 72 h,100 ng/mL与500 ng/mL组比差异无统计学意义(P>0.05),说明在作用72 h后IL-17促HSCs增殖作用可能在100 ng/mL时基本达到饱和,见表1。

图3 培养5 d HSCs α-SMA免疫染色(×400)
表1 不同浓度IL-17作用HSCs不同时间细胞增殖OD值(n=6,±s)

表1 不同浓度IL-17作用HSCs不同时间细胞增殖OD值(n=6,±s)
组别24 h48 h72 h 10.304±0.0280.367±0.0300.671±0.027 20.307±0.0270.372±0.0320.717±0.048 30.321±0.0130.411±0.024a0.765±0.037a40.324±0.0120.500±0.018a0.853±0.038a50.326±0.0290.524±0.017a0.871±0.046a注:1:对照组;2:1 ng/mL IL-17组;3:10 ng/mL IL-17组;4:100 ng/ mL IL-17组;5:500 ng/mL IL-17组。与对照组比:aP<0.01
2.4 IL-17促进HSCs MMP-9和TIMP-1 mRNA表达RT-PCR结果显示,IL-17作用于HSCs 24 h能明显促进MMP-9和TIMP-1 mRNA表达,除1 ng/mL组外,其余各浓度组与对照组比差异均有统计学意义(P<0.01),并且呈浓度依赖性。如图4-5可知,TIMP-1 mRNA表达量明显强于MMP-9 mRNA表达量,且TIMP-1/ MMP-9 mRNA比值随浓度增加而递增,差异有统计学意义(P<0.05)。

图4 不同浓度IL-17对HSCs MMP-9 mRNA表达的影响

图5 不同浓度IL-17对HSCs TIMP-1 mRNA表达的影响
2.5 IL-17对HSCs分泌MMP-9和TIMP-1蛋白的影响如表2所示,IL-17能明显促进HSCs MMP-9、TIMP-1蛋白的分泌,除1 ng/mL组外,其余各浓度组与对照组比均明显增强,差异有统计学意义(P<0.01),并且随着作用浓度的提高,MMP-9和TIMP-1蛋白量也逐渐提高,呈浓度依赖性。下表可知TIMP-1蛋白含量明显高于MMP-9,TIMP-1/MMP-9比值随浓度增加而递增,差异有统计学意义(P<0.01)。见表2。
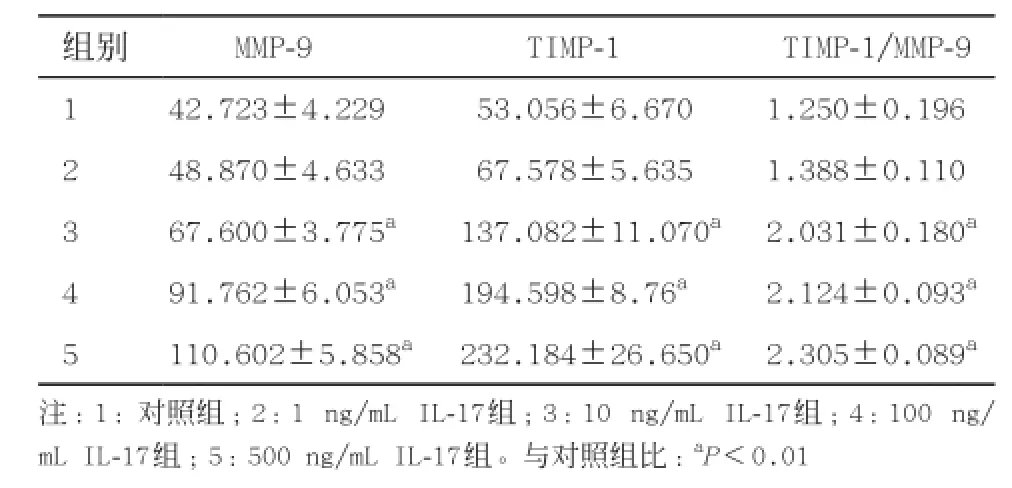
表2 不同浓度IL-17作用大鼠HSCs后MMP-9和TIMP-1蛋白水平(n=6,±s)
3 讨论
肝纤维化是一个慢性的病理过程,是肝硬化的中间环节,是一种可逆的损伤-修复反应[7]。虽然多种因素能够引起肝纤维化,但HSCs的激活、增殖及分泌ECM仍然是肝纤维化形成的重要过程[8]。HSCs被激活后,转变为肌成纤维细胞并特异性表达α-SMA,说明α-SMA是HSCs活化的标志,也是提示肝纤维化严重程度的指标之一[9]。目前研究证实,多种细胞因子如转化生长因子β(TGF-β)、血小板源性生长因子(PDGF)、肿瘤坏死因子(TNF)、IL-1、IL-6等都能经过多种途径促进HSCs的活化、增殖及胶原合成,从而引起肝纤维化[10]。MMPs是调节ECM动态平衡的重要酶系,TIMPs是一种能抑制MMPs功能的活性多肽[11]。在肝组织中MMPs和TIMPs主要由活化的HSCs产生。由于肝脏ECM代谢主要由MMPs和TIMPs共同调节,目前观点认为MMPs和TIMPs的失衡也是肝纤维化形成的重要因素[12]。MMP-9是一种明胶酶B。有研究表明,在肝纤维化早期MMP-9的基因表达显著增强,但在肝硬化期表达量则呈下降趋势,说明MMP-9对肝硬化的发生发展具有双重的调节作用。MMP-9不仅能降解异常沉积的ECM,还可降解由IV型胶原构成的肝脏正常的基底膜及正常的肝组织,从而破坏HSCs与ECM间的动态平衡,激活并促进HSCs增殖。TIMP-1则不仅能抑制降解异常ECM的MMPs的活性,而且还可以抑制酶原的激活使ECM降解减少,两者共同促进肝纤维化的发生、发展。
IL-17细胞因子家族包括IL-17A、IL-17B、IL-17C、IL-17D、IL-17E(IL-25)和IL-17F。通常我们研究的IL-17为IL-17A。IL-17是一类由CD4+ T细胞亚型—Th17细胞分泌的前炎症因子,其对中性粒细胞有强大的趋化作用,促进多种前炎症因子(IL-6、IL-8、MCP-1等)释放,在介导炎症反应过程中发挥重要的作用[13]。研究表明,各种肝脏疾病患者血清IL-17水平较正常组显著升高,说明IL-17在多种肝病的发生发展中起重要作用。但IL-17是否能通过促进HSCs活化、增殖及MMP-9和TIMP-1的表达从而促进肝纤维化的发生发展目前鲜有报道。
本实验观察到,IL-17在一定浓度能促进HSCs α-SMA的表达,说明IL-17能促进HSCs活化。10、100、500 ng/mL的IL-17作用HSCs 48、72 h具有明显促进其增殖的作用,并且呈浓度-时间依赖性。同时,IL-17作用HSCs 24 h能显著提高MMP-9和TIMP-1 mRNA表达和蛋白的分泌,IL-17浓度在10、100、500 ng/mL范围时,随着浓度的增高MMP-9和TIMP-1 mRNA和蛋白表达逐渐增高,各浓度组与对照组比差异均有统计学意义(P<0.01)。另外我们观察到,在一定浓度范围内,TIMP-1/MMP-9的比值也随药物浓度的增加而增加。
综上所述,IL-17在肝纤维化发生发展中的作用可能是:①激活HSCs,使之具有成纤维细胞活性;②促进HSCs的增殖,分泌更多的ECM;③提高HSCs MMP-9的表达,促进正常的基底膜的降解,破坏HSCs的微环境,从而促进HSCs的激活和迁移;④促进HSCs TIMP-1的表达,抑制MMPs(主要为MMP-1/MMP-13)的活性,抑制ECM的降解;⑤提高HSCs TIMP-1/ MMP-9的比值,破坏TIMPs/MMPs的平衡,使ECM代谢紊乱。
因此,通过抑制IL-17及其受体的表达、阻断其信号转导通路或许能够为肝纤维的预防和治疗提供新的思路。
[1] Friendman SL. Hepatic fbrosis—overview[J]. Toxicology, 2008, 254(3): 120-129.
[2] Zhang JY, Zhang Z, Lin F, et al. Interleukin-17-producing CD4(+) T cells increase with severity of liver damage in patients with chronic hepatitis B[J]. Hepatology, 2010, 51(1): 81-91.
[3] Lemmers A, Moreno C, Gustot T, et al. The interleukin-17 pathway is involved in human alcoholic liver disease[J]. Hepatology, 2009, 49(2): 646-657.
[4] Lan RY, Salunga TL, Tsuneyama K, et al. Hepatic IL-17 responses in human and murine primary biliary cirrhosis[J]. J Autoimmun, 2009, 32(1): 43-51.
[5] Yasumi Y, Takikawa Y, Endo R, et al. Interleukin-17 as a new marker of severity of acute hepatic injury[J]. Hepatol Res, 2007, 37(4): 248-254.
[6] 余盼攀, 张胜初, 季世强, 等. Optiprep法分离SD大鼠肝星状细胞的实验研究[J]. 温州医学院学报, 2011, 41(6): 511-514.
[7] Hernandez GV, Friendman SL. Pathogenesis of live fbrosis [J]. Annu Rev Pathol, 2011, 6(2): 425-456.
[8] Zhong MT, Xiao FQ, Run QJ, et al. IL-17A plays a critical role in the pathogenesis of liver fbrosis through hepatic stellate cell activation[J]. J Immunol, 2013, 191(7): 1835-1844.
[9] Chen YW, Lid G, Wu JX, et al. Tetrandrine inhibits the ac-tivation of rat hepatic stellate cells via upregulation of smad7[J]. Chem Pharmacol Bull, 2005, 21(5): 563-567.
[10] Han YP, Zhou L, Wang JH, et al. Essential role of matrixmetallop roteinases in interleukine-1-induced myofbroblastic activation of hepaticstellate cell in collagen[J]. J Biol Chem, 2004, 279(2): 4820-4828.
[11] Stefanie H, Jürgen G, Martin R, et al. Expression of MMPs and TIMPs in liver fbrosis-a systematic review with special emphasis on anti-fibrotic strategies[J]. J Hepatol, 2007, 46(5): 955-975.
[12] Roderfeld M, Hemmann S, Roeb E. Mechanisms of fbrinolysis in chronic live injury (with special emphasis on MMPs and TIMPs)[J]. Z Gastroenterol, 2007, 45(3): 25-33.
[13] Moseley T. Interleukin-17 family and IL-17 receptors[J]. Cytokine Growth Factor Rev, 2003, 14(2): 155-174.
(本文编辑:吴健敏)
Objective:To investigate the effect of Interleukin17 (IL-17) on proliferation and expression of MMP-9, TIMP-1 in rat hepatic stellate cells in vitro.Methods:The HSCs were isolated by method of Optiprep. Immunocytochemical method was used to detect the α-SMA expression of HSCs. The HSCs was treated with different concentrations of IL-17 and the proliferation of HSCs was measured by MTT. The MMP-9 and TIMP-1 mRNA levels were detected by reverse-transcription polymerase chain reaction (RT-PCR). While the MMP-9 and TIMP-1 protein were measured by ELISA.Results:HSCs were isolated and cultured successfully. Stimulated with IL-17 could signifcantly increase proliferation and α-SMA expression in HSCs. IL-17 could promote the MMP-9 and TIMP-1 mRNA expression and increased protein secresion in HSCs by dose depedent manner. With increased of IL-17 concentration, the value of TIMP-1/MMP-9 was markedly upregulated. Conclusion: IL-17 can promote the proliferation of HSCs and also increases α-SMA, MMP-9 and TIMP-1 expression, then upregulate the value of TIMP-1/MMP-9 in HSCs, which may play an important role in live fbrosis.
interleukin17; hepatic stellate cells; α-SMA; MMP-9; TIMP-1; rats
R657.3
A
1000-2138(2014)12-0868-05
2014-05-15
浙江省外科学重中之重学科基金资助项目(2008-255)。
余盼攀(1986-),男,浙江衢州人,住院医师,医学硕士。
Effect of interleukin17 on collagen metabolism in hepatic stellate cells
YU Panpan1, ZHANG Qiyu2, JIN Huicheng1. 1.Department of General Surgery, the First People's Hospital of Hangzhou, Hangzhou, 310000; 2.Department of General Surgery, the First Affliated Hospital of Wenzhou Medical University, Wenzhou, 325015

